法規(guī)跟蹤
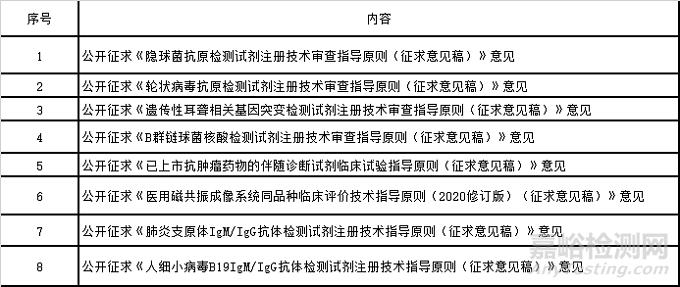
1)審評中心8月共發(fā)布或技術指導原則(征求意見稿)8篇���,詳見以下信息:
標準信息
1)全國醫(yī)用電器標準化技術委員會醫(yī)用超聲設備分技術委員會(SAC/TC10/SC)對以下三項行業(yè)標準征求意見:
1)超聲經(jīng)顱多普勒血流分析儀
2)醫(yī)用超聲耦合劑
3)超聲仿組織體模的技術要求
2)中檢院發(fā)布關于《醫(yī)用普通攝影數(shù)字化X射線影像探測器》等9項標準征求意見的通知
1)射線血液輻照設備
2)醫(yī)用動態(tài)數(shù)字化X射線影像探測器
3)醫(yī)用普通攝影數(shù)字化X射線影像探測器
4)X射線計算機體層攝影設備的體型特異性劑量估算值(SSDE)計算方法
5)骨接合植入物 金屬股骨頸固定釘
6)手術植入物 有源植入式醫(yī)療器械 第5部分:循環(huán)支持器械
7)手術植入物 有源植入式醫(yī)療器械 第3部分:植入式神經(jīng)刺激器
8)外科植入物 運動醫(yī)學植入物 縫線拉伸試驗方法
9)外科植入物涂層 第3部分:貽貝粘蛋白涂層通用要求
3)江蘇/上海/四川發(fā)布通知�����,2020年監(jiān)督抽查項目開啟���,對“中簽”的企業(yè)和產(chǎn)品進行臨床試驗監(jiān)督檢查
4)國家藥監(jiān)局召開醫(yī)療器械唯一標識系統(tǒng)試點工作推進會����,對醫(yī)療器械唯一標識系統(tǒng)試點工作進展和成效做出總結�����,并研究部署下一階段工作內(nèi)容,具體內(nèi)容如下:
摘要:
注冊人/備案人實施唯一標識的流程
1)注冊人/備案人按照《規(guī)則》和相關標準,結合企業(yè)實際情況選擇發(fā)碼機構���。
2)注冊人/備案人按照發(fā)碼機構的標準創(chuàng)建產(chǎn)品標識����,并確定該產(chǎn)品生產(chǎn)標識的組成。
3)《規(guī)則》10月1日正式實施�,申請醫(yī)療器械注冊、注冊變更或者辦理備案的���,注冊人/備案人應當在注冊/備案管理系統(tǒng)中提交產(chǎn)品標識��。
4)注冊人/備案人根據(jù)發(fā)碼機構標準選擇適當?shù)臄?shù)據(jù)載體��,對醫(yī)療器械最小銷售單元和更高級別的包裝或醫(yī)療器械產(chǎn)品上賦予醫(yī)療器械唯一標識數(shù)據(jù)載體���。
5)注冊人/備案人在產(chǎn)品上市銷售前將產(chǎn)品標識和相關信息上傳至醫(yī)療器械唯一標識數(shù)據(jù)庫�����。
6)產(chǎn)品標識及數(shù)據(jù)相關信息變化時,注冊人/備案人及時更新醫(yī)療器械唯一標識數(shù)據(jù)庫��。
工作動態(tài)
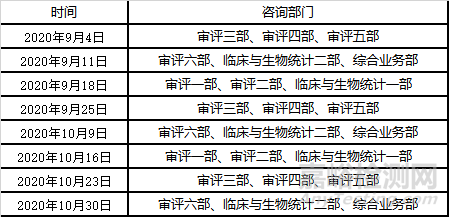
1)關于2020年9月~10月醫(yī)療器械注冊受理前技術問題咨詢工作安排
2)FDA推進環(huán)氧乙烷滅菌相關改革工作簡述
摘要:
醫(yī)療器械的滅菌方法多種多樣���,包括濕熱法�����、干熱法��、輻照法���、環(huán)氧乙烷滅菌法等。環(huán)氧乙烷滅菌是器械制造商為保證醫(yī)療器械安全而廣泛采用的一種方法�����。資料表明美國大約50%的無菌醫(yī)療器械采用環(huán)氧乙烷滅菌。對于一些產(chǎn)品來說�����,例如材質為特殊聚合物�����,含有多層包裝���、含有難滅菌組件的產(chǎn)品�,環(huán)氧乙烷滅菌具有不可替代性�。
大多數(shù)無菌醫(yī)療器械上市之前,美國食品藥品監(jiān)督管理局(FDA)會對提交的材料進行審查以評估滅菌相關資料是否符合FDA的法規(guī)和要求�����,以及是否符合FDA認可的國際標準����。環(huán)氧乙烷滅菌相關的兩個標準(ANSI AAMI ISO 11135和ANSI AAMI ISO 10993.7)闡述了如何開發(fā)、驗證和控制滅菌過程��,以及控制環(huán)氧乙烷相關殘留物的可接受水平等內(nèi)容。
原文鏈接:https://www.cmde.org.cn/CL0033/21508.html
3)骨科植入醫(yī)療器械產(chǎn)品的生物學評價資料應如何提交
摘要:
申請人應參照GB/T 16886.1的要求進行生物學評價���。對于需進行生物學試驗的����,應提交相應的生物學試驗報告�����,生物學試驗應針對申報產(chǎn)品開展�。若提交原材料的生物學試驗報告��,應論證從原材料到終產(chǎn)品的加工工序過程沒有對產(chǎn)品引入新的生物學風險�����。關于生物學評價相關規(guī)定�����,請參考《關于印發(fā)醫(yī)療器械生物學評價和審查指南的通知》(國食藥監(jiān)械[2007]345號)�。
4)嬰兒培養(yǎng)箱中皮膚溫度探頭配合使用的一次性固定粘貼片是否可以和主機作為同一注冊單元申報
摘要:
次性固定粘貼片為無源耗材, 根據(jù)《醫(yī)療器械注冊單元劃分指導原則》要求:與有源醫(yī)療器械配合/組合使用的無源類耗材原則上與該有源醫(yī)療器械劃分為不同的注冊單元����。
5)醫(yī)療器械不良事件檢索方式及案例解析
摘要:
目前很多國家已建立了醫(yī)療器械不良事件監(jiān)測系統(tǒng)���,對于已收集到的不良事件也會定期公布,供公眾檢索����。本文匯總了中國NMPA、美國FDA���、英國MHRA�����、澳大利亞TGA����、加拿大Health Canada���、日本PMDA��、德國BfArM等國家的醫(yī)療器械不良事件檢索方式��,并提供了對于已檢索到的醫(yī)療器械不良事件進行匯總分析的方法����,以期為行業(yè)內(nèi)進行醫(yī)療器械不良事件監(jiān)測的人員提供參考。
原文鏈接:https://www.cmde.org.cn/CL0033/21451.html
6)申請體外診斷設備注冊變更時�����,什么情況下需要補充網(wǎng)絡安全注冊檢驗/委托檢驗
摘要:
依據(jù)《醫(yī)療器械網(wǎng)絡安全注冊技術審查指導原則》��,注冊申請人應在產(chǎn)品技術要求性能指標中明確數(shù)據(jù)接口���、用戶訪問控制的要求�����。指導原則發(fā)布之前批準的產(chǎn)品如未體現(xiàn)該指標��,在申請注冊變更時若涉及網(wǎng)絡安全內(nèi)容,應在產(chǎn)品技術要求中補充網(wǎng)絡安全的性能指標����,并在有資質的檢驗機構對補充項目進行注冊檢驗或委托檢驗,申報資料中應同時提交網(wǎng)絡安全描述文檔����。
7)血液透析器產(chǎn)品的清除率試驗條件應如何設計
摘要:
根據(jù)YY 0053規(guī)定�����,透析器產(chǎn)品的清除率試驗中����,血液和透析液流速應覆蓋生產(chǎn)企業(yè)規(guī)定的范圍���。試驗一般選擇透析液流速的最低和最高點��,分別對應企業(yè)規(guī)定的血液流速的最低流速��,及每增加100ml/min的血液流速���,直至企業(yè)規(guī)定的最高血液流速。
8)醫(yī)療器械設計和開發(fā)輸入要求和應用淺析
摘要:
醫(yī)療器械是用于促進和保護公眾健康的產(chǎn)品����,安全性有效性直接關系到使用者的身體健康和生命安全,其設計和開發(fā)���、生產(chǎn)管理���、質量控制等過程具有專業(yè)性和特殊性����。為保證醫(yī)療器械生產(chǎn)企業(yè)持續(xù)�、穩(wěn)定地提供符合臨床需求和質量合格的產(chǎn)品,產(chǎn)品研制�、生產(chǎn)相關過程需要在質量管理體系控制下有效運行。質量源于設計��,設計和開發(fā)過程在監(jiān)管法規(guī)和質量管理體系標準中均作為產(chǎn)品實現(xiàn)重要環(huán)節(jié)進行了要求���,輸入為產(chǎn)品的設計和開發(fā)提供了基礎和依據(jù)����,決定了產(chǎn)品結構組成��、生產(chǎn)工藝����、性能評價體系等內(nèi)容的輸出,設計和開發(fā)輸入不僅影響產(chǎn)品研制和生產(chǎn)�,在產(chǎn)品全生命周期管理和推動產(chǎn)業(yè)高質量發(fā)展中同樣具有重要作用��。本文結合醫(yī)療器械設計和開發(fā)輸入相關標準和法規(guī)要求,對設計和開發(fā)輸入在醫(yī)療器械產(chǎn)品性能評價中的應用進行探討��。
原文鏈接:https://www.cmde.org.cn/CL0033/21443.html
9)軟性親水接觸鏡為離子型或非離子型���,應提交哪些資料
摘要:如制造商宣稱軟性親水接觸鏡為離子/非離子型��,應依據(jù)GB/T 11417.1-2012中給出的離子型�����、非離子型的定義進行判定�����。首先需明確產(chǎn)品配方中各單體的性質�����,如離子型�����、非離子型等���,其次計算離子型單體的含量(用摩爾分數(shù)表示),最后依據(jù)GB/T 11417.1-2012的相關要求做出結論,并在產(chǎn)品技術要求附錄中明確軟性親水接觸鏡為離子型或非離子型����。
10)體外診斷試劑臨床試驗中對比結果不一致的樣本,其確認結果能否納入一致性統(tǒng)計
摘要:體外診斷試劑臨床試驗過程中�����,為了控制試驗偏倚��,針對考核試劑與對比試劑的一致性統(tǒng)計分析���,應采用樣本揭盲前的檢測結果�����。針對不一致樣本的復測結果或第三方確認結果���,如在臨床試驗揭盲以后納入統(tǒng)計分析會引入偏倚,因此����,不建議將此部分結果納入統(tǒng)計分析。但考核試劑復測結果和第三方復核試劑檢測結果可結合該樣本對應病例的臨床診斷信息����,用于進一步分析考核試劑與對比試劑檢測結果不一致的原因。
11)通過戊二醛浸泡進行消毒�����、滅菌的醫(yī)療器械���,其殘留毒性如何評價
摘要:
關于戊二醛殘留的限值和殘留的測試目前沒有公認的標準和方法��,根據(jù)GB/T 16886.1-2011中4.3b)規(guī)定���,總體生物學評價應考慮預期的添加劑、工藝污染物和殘留物����,如果對生物學試驗的醫(yī)療器械樣品按照制造商規(guī)定的方法進行了戊二醛消毒、滅菌���,且符合生物相容性要求��,則認為其殘留毒性是可接受的��。
12)上海藥監(jiān)局發(fā)布了《上海市第二類創(chuàng)新醫(yī)療器械特別審查申報資料編寫指南(試行)》的通告
摘要:
海藥監(jiān)局發(fā)布了《上海市第二類創(chuàng)新醫(yī)療器械特別審查申報資料編寫指南(試行)》的通告�����,對申報資料內(nèi)容���、申報資料格式及其他申報資料相關要求作出具體規(guī)定����,具體內(nèi)容如下:
申報資料內(nèi)容目錄
(一)第二類創(chuàng)新醫(yī)療器械特別審查申請表
(二)申請人資質證明文件
(三)產(chǎn)品管理類別
(四)概述
(五)產(chǎn)品知識產(chǎn)權情況及證明文件
(六)產(chǎn)品研發(fā)過程及結果綜述
(七)產(chǎn)品技術文件����,至少應當包括:
(八)產(chǎn)品創(chuàng)新的證明性文件
(九)產(chǎn)品風險分析資料
(十)產(chǎn)品說明書(樣稿)
(十一)其他證明產(chǎn)品符合《上海市第二類創(chuàng)新醫(yī)療器械特別審查程序》第三條的資料
(十二) 所提交資料真實性的自我保證聲明
質量公告
1)8月份產(chǎn)品召回信息
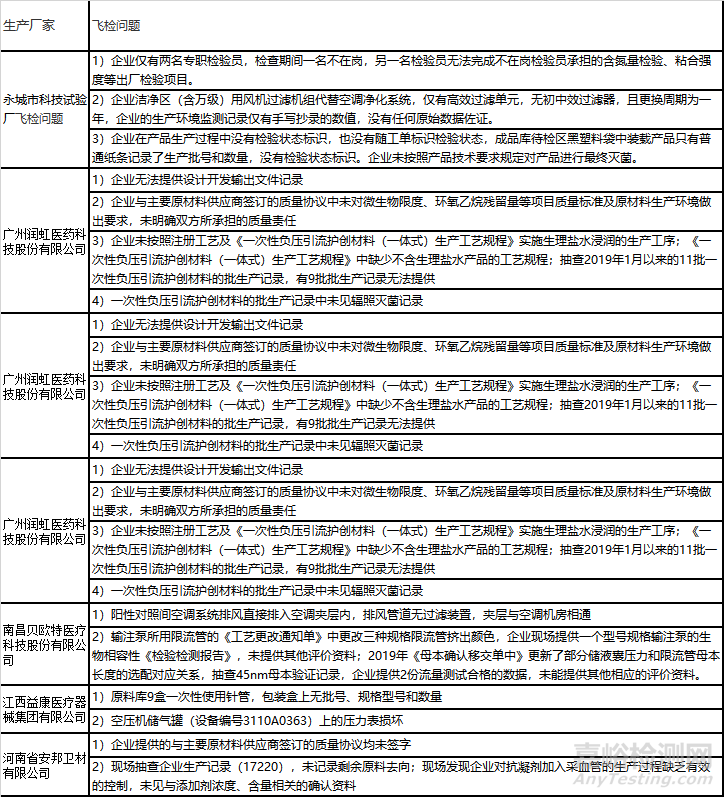
2)飛行檢查情況的通告
產(chǎn)品信息
1)國家藥監(jiān)局關于批準注冊102個醫(yī)療器械產(chǎn)品公告
2020年7月,國家藥品監(jiān)督管理局共批準注冊醫(yī)療器械產(chǎn)品102個��。其中��,境內(nèi)第三類醫(yī)療器械產(chǎn)品73個�����,進口第三類醫(yī)療器械產(chǎn)品11個��,進口第二類醫(yī)療器械產(chǎn)品17個���,港澳臺醫(yī)療器械產(chǎn)品1個����。
經(jīng)過查詢,上海欣吉特生物科技有限公司的牛心包人工心臟瓣膜(外科瓣)已批準注冊��。
2)創(chuàng)新醫(yī)療器械特別審查申請審查結果公示
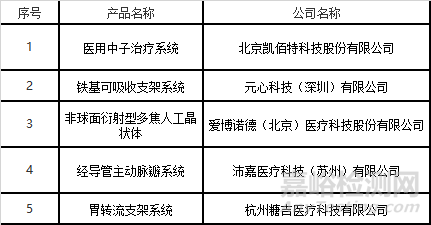
8月審評中心共發(fā)布創(chuàng)新審查結果2批����,涉及5個產(chǎn)品���。
3)臨床試驗默式許可
4)醫(yī)療器械優(yōu)先審批申請審核結果公示