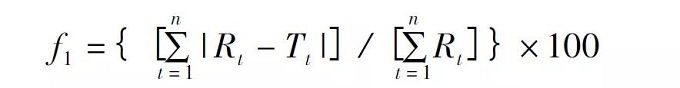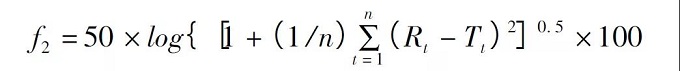固體制劑口服給藥后�����,藥物的吸收取決于藥物從制劑中的溶出以及在胃腸道的滲透���。由于藥物的溶出對吸收具有重要影響���,因此藥物體外溶出度試驗(yàn)可能會與體內(nèi)行為具有一定關(guān)聯(lián)�����。
對于仿制藥而言�,與原研制劑體外溶出曲線具有相似性���,雖然不能完全證明與原研制劑具有相同的生物等效性���,但卻可以大大提高生物等效性試驗(yàn)( BE 試驗(yàn)) 的成功率�,而體外溶出曲線不相似��,BE 試驗(yàn)的失敗率將大大提高��。
目前國外已有相關(guān)指導(dǎo)原則用于溶出曲線試驗(yàn)的指導(dǎo)�。本文主要對美����、日有關(guān)仿制藥指導(dǎo)原則中溶出曲線相似性方法內(nèi)容進(jìn)行介紹���,希望通過對兩者的解讀�,能為我國仿制藥質(zhì)量一致性評價(jià)固體口服制劑體外評價(jià)方法提供借鑒�。
1����、美國溶出曲線相似性判定方法
FDA 在1997 年發(fā)布的普通口服固體制劑溶出度試驗(yàn)技術(shù)指導(dǎo)原則中�,采用非模型依賴法和模型依賴法進(jìn)行溶出曲線的比較���。
1.1 非模型依賴法( Model IndependentApproaches)
差異因子( f1) 和相似因子( f2) 是一種簡單的模型非依賴方法用于溶出曲線的比較{ A simple model independentapproach uses a difference factor ( f1) and asimilarity factor( f2) to compare dissolutionprofiles}�����。差異因子( f1) 法是計(jì)算兩條溶出曲線在每一時(shí)間點(diǎn)差異����,是衡量兩條曲線相對偏差的參數(shù)�,計(jì)算公式如下:
其中n 為取樣時(shí)間點(diǎn)個(gè)數(shù)���,Rt為參比制劑( 或變更前產(chǎn)品) 在t 時(shí)刻的溶出度值����,Tt為試驗(yàn)批次( 變更后樣品) 在t 時(shí)刻的溶出度值�����。
相似因子( f2) 是衡量兩條溶出曲線相似度的參數(shù),計(jì)算公式如下:
其中n 為取樣時(shí)間點(diǎn)個(gè)數(shù)�����,Rt為參比制劑( 或變更前產(chǎn)品���,后面統(tǒng)稱為參比制劑) 在t 時(shí)刻的溶出度值��,Tt為試驗(yàn)批次( 變更后樣品) 在t 時(shí)刻的溶出度值�����。
1.1.1 差異因子和相似因子應(yīng)用條件
①分別取受試制劑和參比制劑各12 片( 粒) �,測定其溶出曲線���。取12 片( 粒) 進(jìn)行測定是其統(tǒng)計(jì)學(xué)計(jì)算所必須的最小單位。
②取兩條曲線上各時(shí)間點(diǎn)的平均溶出度值,根據(jù)上述公式計(jì)算差異因子( f1) 或相似因子( f2) ���。
③應(yīng)在完全相同的條件下對受試和參比制劑的溶出曲線進(jìn)行測定。兩條曲線的取樣點(diǎn)應(yīng)相同( 如15�、30�����、45��、60 分鐘) ����。
④藥物溶出量超過85%的取樣點(diǎn)不超過一個(gè)�����。
⑤第一個(gè)取樣時(shí)間點(diǎn)( 如15 分鐘) 的溶出量相對標(biāo)準(zhǔn)偏差不得過20%,其余取樣時(shí)間點(diǎn)的溶出量相對標(biāo)準(zhǔn)偏差不得過10%��。
1.1.2 相似性判定
f1值越接近0��,f2值越接近100,則認(rèn)為兩條曲線相似�。一般情況下,f1值小于15��,且f2值高于50��,可認(rèn)為兩條曲線具有相似性
1.2 模型依賴法( Model dependent Approaches)
早已有一些擬合溶出度曲線的數(shù)學(xué)模型的報(bào)道����。采用這些模型比較溶出度曲線,建議采取以下步驟:
①選擇最適當(dāng)?shù)哪P捅容^溶出度曲線相似性���。建議采用的模型不多于三個(gè)參數(shù)( 如線性模型、二次模型、對數(shù)模型�、概率模型和威布爾模型) 。
②根據(jù)各樣品的溶出數(shù)據(jù)繪制溶出曲線并采用最合適的模型擬合���。
③根據(jù)參比制劑擬合模型的參數(shù)變異性���,設(shè)定相似區(qū)間���。
④計(jì)算受試和參比制劑擬合模型參數(shù)的MSD�����。
⑤確定受試與參比制劑間溶出差異的90%置信區(qū)間��。
⑥比較置信區(qū)間與相似性限度。如果置信區(qū)間落在相似性限度內(nèi)�,可認(rèn)為受試與參比制劑具有相似的溶出曲線。
2�����、日本溶出曲線相似性判定方法
日本《仿制藥生物等效性試驗(yàn)指導(dǎo)原則》中試驗(yàn)制劑與參比制劑要比較四種不同溶出介質(zhì)下的溶出曲線相似性。對于藥物在四種溶出介質(zhì)中的溶出量是有一定要求的����,通常在規(guī)定的時(shí)間內(nèi),四種溶出介質(zhì)中參比制劑至少在其中一個(gè)溶出介質(zhì)的平均溶出量( 12 片/粒) 達(dá)85%以上���。
試驗(yàn)制劑與參比制劑溶出曲線相似性是采用兩種非模型依賴法—直接比較法和相似因子( f2) 法進(jìn)行判定的��。日本普通口服固體制劑與口服緩釋制劑的比較方法是不同的��,本文只介紹普通口服固體制劑比較法相關(guān)內(nèi)容���,詳見如下:無論采用哪種判定方法,溶出曲線只要滿足于下列任何一個(gè)判定要求���,都被認(rèn)為具有相似性�。
2.1 參比制劑在15分鐘以內(nèi)平均溶出量達(dá)85% 以上時(shí)�,試驗(yàn)制劑在15分鐘以內(nèi)平均溶出量也達(dá)85%以上; 或15分鐘時(shí),試驗(yàn)制劑與參比制劑( 以下簡稱“兩者”) 平均溶出量的差在±15%范圍內(nèi)�。
2.2 參比制劑在15~30分鐘平均溶出量達(dá)85%以上時(shí),選取參比制劑平均溶出量分別為60% 和85%附近的兩個(gè)時(shí)間點(diǎn)���,兩者平均溶出量的差均在±15%范圍內(nèi); 或f2因子大于42�。
2.3 參比制劑在30 分鐘內(nèi)平均溶出量未達(dá)85%時(shí)�,只要滿足以下任何一個(gè)條件,仍可判定溶出曲線相似�。
2.3.1 參比制劑的平均溶出量在規(guī)定時(shí)間( 藥物溶出量達(dá)到85%的時(shí)間�,如果達(dá)不到85%�,酸性介質(zhì)最長不超過2 小時(shí),其它介質(zhì)不超過6 小時(shí)) 內(nèi)達(dá)85%以上時(shí)����,選取參比制劑平均溶出量分別為40% 和85%附近的兩個(gè)時(shí)間點(diǎn),兩者平均溶出量的差均在± 15%范圍內(nèi); 或f2因子大于42��。
2.3.2 參比制劑平均溶出量在規(guī)定時(shí)間內(nèi)達(dá)50%以上但未達(dá)85% 時(shí)�,選取參比制劑最終時(shí)間點(diǎn)和溶出量1 /2 所對應(yīng)的時(shí)間點(diǎn),兩者平均溶出量的差均在± 12%范圍內(nèi); 或f2因子大于46�����。2.3.3 參比制劑平均溶出量在規(guī)定時(shí)間內(nèi)達(dá)不到50%時(shí)����,選取參比制劑平均溶出量的1 /2 所對應(yīng)的時(shí)間點(diǎn)和最終時(shí)間點(diǎn)��,兩者平均溶出量的差均在± 9%范圍內(nèi); 或f2因子大于53。但是�,規(guī)定試驗(yàn)時(shí)間內(nèi)���,參比制劑的平均溶出量低于10% 時(shí)����,只以規(guī)定試驗(yàn)時(shí)間作為評價(jià)手段�,兩者平均溶出量差在± 9%范圍內(nèi)。
3��、討論
3.1 美國溶出曲線相似性判定方法分析
用于比較口服固體制劑溶出曲線相似性的方法很多。美國食品藥品監(jiān)督管理局( FDA) 推薦采用非模型依賴法差異因子(f1) 和相似因子(f2) 作為兩條溶出曲線相似性的首選方法�,并認(rèn)為f1小于15�,f2大于50 的兩條溶出曲線具有相似性�。
差異因子(f1) 和相似因子(f2) 是運(yùn)用統(tǒng)計(jì)學(xué)方法比較溶出曲線的差異性或相似性��,通常采用其中一種方法就可對溶出曲線的相似性進(jìn)行判斷����。相似因子(f2) 法的原理是基于生物等效性的基本假設(shè)進(jìn)行體外溶出度的等效性評價(jià)���,認(rèn)為試驗(yàn)制劑與參比制劑的累積溶出量差的平方和最小���。此種評價(jià)方法可用于評價(jià)工藝或處方改變后溶出曲線的差異性�����,以及試驗(yàn)制劑與參比制劑溶出曲線的差異性���。
差異因子和相似因子的優(yōu)點(diǎn):便于計(jì)算����,可通過溶出量數(shù)據(jù)直接進(jìn)行統(tǒng)計(jì)分析����。
差異因子和相似因子的缺點(diǎn):藥品變異系數(shù)不宜過高��,否則無法用于比較; f1和f2的數(shù)值與參與計(jì)算的溶出量取樣時(shí)間點(diǎn)有較大關(guān)系,一般溶出量大于85%的時(shí)間點(diǎn)只能有一個(gè); 溶出曲線方法既要有區(qū)分能力�,又要避免過于靈敏�����,對于某些藥品而言,建立一個(gè)能夠反映藥物特性的溶出曲線方法具有一定難度�����。
3.2 日本溶出曲線相似性判定方法分析
日本溶出曲線相似性判定方法主要有兩種比較方式: 直接比較法和相似因子( f2) 法。
直接比較法是將試驗(yàn)制劑的溶出量與參比制劑的溶出量進(jìn)行比較研究��,對固定時(shí)間(h) 的溶出度數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析���,研究相似等效性��。日本在其《仿制藥生物等效性試驗(yàn)指導(dǎo)原則》中選取多個(gè)比較時(shí)間點(diǎn)( 多數(shù)為2個(gè)) ,在此時(shí)間點(diǎn)上比較試驗(yàn)制劑與參比制劑溶出量的差值�。差值范圍是根據(jù)最終溶出量決定的,最終溶出量大于85% 的差值范圍為±15%��,50%~85%之間的差值范圍為±12%���,小于50%的差值范圍為± 9%�,可見隨著最終溶出量的減少,所允許的差值也相應(yīng)減小�����。
相似因子(f2) 比較法日本取樣時(shí)間點(diǎn)的設(shè)定與FDA 指導(dǎo)原則有所不同。FDA 指導(dǎo)原則中對取樣時(shí)間點(diǎn)沒有具體要求��,而日本《仿制藥生物等效性試驗(yàn)指導(dǎo)原則》為了彌補(bǔ)f2因子計(jì)算結(jié)果具有依存于比較時(shí)間點(diǎn)個(gè)數(shù)特性的缺點(diǎn)���,規(guī)定了具體的比較時(shí)間點(diǎn)( Ta/4,2Ta/4,3Ta/4,Ta;Ta為參比制劑平均溶出量在85%附近的時(shí)間) ���。但對于具體品種而言,不應(yīng)完全拘泥于上述時(shí)間點(diǎn)�,而應(yīng)依據(jù)參比制劑實(shí)際溶出量的情況來進(jìn)行適當(dāng)?shù)恼{(diào)整。
無論直接比較法還是相似因子(f2) 法本身都存在一定的缺陷��。當(dāng)采用直接比較法對溶出曲線進(jìn)行判定時(shí),由于制劑溶出速度的特性���,若某個(gè)比較時(shí)間點(diǎn)位的數(shù)據(jù)略微超出所規(guī)定的范圍���,就做出“非相似性”的判斷����,是存在一定問題的����。
正是基于這樣的考慮�,日本《仿制藥生物等效性試驗(yàn)指導(dǎo)原則》中才有了第二種判定方法—相似因子(f2) 法���,從而減少誤判現(xiàn)象的出現(xiàn)。但相似因子(f2) 法雖然綜合全面的考慮了溶出行為間的差異���,其結(jié)果具有依存于比較時(shí)間點(diǎn)個(gè)數(shù)的特性的缺點(diǎn),日本又在《仿制藥生物等效性試驗(yàn)指導(dǎo)原則》中規(guī)定了具體比較時(shí)間點(diǎn)彌補(bǔ)這一缺陷��。