2020版《中國藥典》9099分析方法確認(rèn)指導(dǎo)原則���、9100分析方法轉(zhuǎn)移指導(dǎo)原則明確了分析方法確認(rèn)及轉(zhuǎn)移的相關(guān)要求���,但沒有細(xì)化到操作層面�����,本人根據(jù)《中國藥品檢驗標(biāo)準(zhǔn)操作規(guī)范》�����,結(jié)合工作中的實際情況,整理了分析方法轉(zhuǎn)移與確認(rèn)過程中的關(guān)鍵點��,文中的缺陷和不足�,望同行批評指正。
1分析方法轉(zhuǎn)移應(yīng)考慮的關(guān)鍵點
方法轉(zhuǎn)移的目的是證明方法接受實驗室能夠成功的操作方法���,適用范圍包括某些進(jìn)口藥品的標(biāo)準(zhǔn)復(fù)核�,企業(yè)內(nèi)部分析方法由研發(fā)部門轉(zhuǎn)移到質(zhì)控部門�;企業(yè)位于不同地點的生產(chǎn)工廠之間的方法轉(zhuǎn)移;委托檢測等�。
1.1、比對性測試應(yīng)考慮的因素
分析方法轉(zhuǎn)移包含比對性測試����,相關(guān)測試中考慮的因素包括:被測樣品的數(shù)量(批次2~5批)�;被測樣品的濃度級別(1~3個濃度)��;重復(fù)測定次數(shù)(比如4~6次)��;被分析物個數(shù)(比如1~2個��;)分析時間(比如2~5天)���;來自1個或多個企業(yè)的分析儀器(2個實驗室都用相同的儀器)����。若被測樣品有多個規(guī)格��,那么原則上方法轉(zhuǎn)移應(yīng)涵蓋樣品的幾個規(guī)格(如最高規(guī)格和低規(guī)格)�。如果相同的檢驗方法被用于樣品不同的檢驗項目,例如含量測定和含量均勻度檢查�����,那么可以只做含量測定方法轉(zhuǎn)移而不需要再額外進(jìn)行含量均勻度檢查方法的轉(zhuǎn)移�����。另外需要注意的是�����,如果對照品溶液和供試品溶液的制備略有差別,如提取溶劑的量和容量器具具有規(guī)格相應(yīng)縮放���,而其他步驟和操作都是相同的�����,那么這些分析方法也被認(rèn)為是相同的而不需要進(jìn)行方法轉(zhuǎn)移���。
1.2�����、轉(zhuǎn)移方案應(yīng)考慮的關(guān)鍵點
轉(zhuǎn)移方案應(yīng)根據(jù)被測樣品的穩(wěn)定性����、樣品的檢測結(jié)果、方法學(xué)驗證數(shù)據(jù)來制定轉(zhuǎn)移方案�。方案中應(yīng)規(guī)定樣品的選擇、檢驗批數(shù)及每次檢驗所需制備的樣品份數(shù)以及接受標(biāo)準(zhǔn)�。方法轉(zhuǎn)移方案中需要明確以下細(xì)節(jié):文件號;轉(zhuǎn)移的目的和范圍�;轉(zhuǎn)出實驗室和接收實驗室的名稱和信息����;樣品信息(如劑型�����、規(guī)格�、批號、儲存條件�、運(yùn)輸條件等);被轉(zhuǎn)移的分析方法(名稱�����、標(biāo)識號�、版本號等);測試的批數(shù)和每批重復(fù)的次數(shù)�����;轉(zhuǎn)移方法所需實驗用品和試劑清單(包括標(biāo)準(zhǔn)物質(zhì))等��;轉(zhuǎn)出實驗室提供的文件清單����;轉(zhuǎn)移方法所需的設(shè)備清單���;計劃的檢驗步驟;需要檢驗的項目和結(jié)果評估的標(biāo)準(zhǔn)�����;報告結(jié)果的要求(如結(jié)果的修約��、小數(shù)點位數(shù)等)�;根據(jù)轉(zhuǎn)移方法的復(fù)雜程度,轉(zhuǎn)移前轉(zhuǎn)出實驗室應(yīng)派1名檢驗人員到接收實驗室進(jìn)行現(xiàn)場培訓(xùn)��。
1.3����、分析方法不同轉(zhuǎn)移類型應(yīng)考慮的關(guān)鍵點
ü 比對相同批次的樣品的檢測結(jié)果�����,需要檢驗的樣品批數(shù)和每批樣品需要檢驗的次數(shù)根據(jù)被測樣品的特性和檢驗方法的類型來確定�����,通常以平均值和偏差來評估����,確認(rèn)接收方有能力操作分析方法�。
ü 通過共同驗證進(jìn)行方法轉(zhuǎn)移�,分析方法在轉(zhuǎn)移前原則上已經(jīng)過驗證。然而可以將分析方法的驗證和轉(zhuǎn)移合并在一起來滿足1個轉(zhuǎn)出實驗室向1個或多個接受實驗室進(jìn)行方法轉(zhuǎn)移的要求����。方法重現(xiàn)性實驗需評估實驗室間的差異(如不同儀器、不同檢驗人員����、不同經(jīng)驗及檢驗?zāi)芰Γ�����?梢赃x擇1批或多批樣品由2個或2個以上實驗室的多個檢驗人員在不同時間進(jìn)行多次檢驗�����。該批樣品必須要有代表性���,如對于雜質(zhì)檢測來說�,該批樣品至少包含所有相關(guān)的雜質(zhì)。對于具有不同規(guī)格的樣品����,通常每個規(guī)格需要檢驗1批。如果規(guī)格等比例����,至少應(yīng)包括最低規(guī)格和最高規(guī)格的批次。轉(zhuǎn)移雙方應(yīng)盡量使用相同/等同的檢測設(shè)備���。
ü 通過再驗證進(jìn)行方法轉(zhuǎn)移��,在驗證的方法學(xué)參數(shù)根據(jù)將要轉(zhuǎn)移的方法的特點和復(fù)雜程度來確定��。例如��,含量均勻度檢驗主要是方法的準(zhǔn)確性和精密度決定的�,因此方法接受實驗室至少對方法的準(zhǔn)確度和精密度做再驗證�。
ü 通過免除實驗進(jìn)行方法轉(zhuǎn)移,采用該方式一定要有記錄并說明原因����,如接收實驗室已經(jīng)檢驗過這個樣品或類似樣品���,并且對檢驗步驟很熟悉���;新劑型與接收實驗室以前檢驗過的劑型有類似的活性組分和含量���;分析方法與已在應(yīng)用的方法類似或相同;接收實驗室對別的樣品分析方法驗證時已包括類似新方法���,建立分析方法的檢驗人員加入了接收實驗室����;新方法與以前已轉(zhuǎn)移的方法之間只有微小的變更�;接收方檢驗人員與轉(zhuǎn)出方檢驗人員的技術(shù)水平相當(dāng);需要轉(zhuǎn)移的方法為通用的檢驗方法并且接受實驗室具有足夠的經(jīng)驗���。
1.4分析方法轉(zhuǎn)移可接收標(biāo)準(zhǔn)
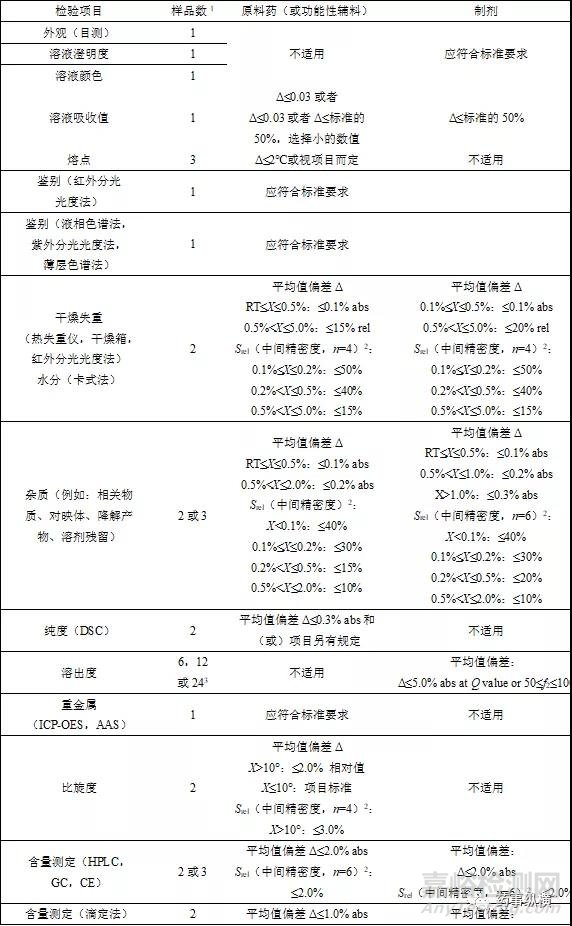
分析方法轉(zhuǎn)移可接受標(biāo)準(zhǔn)各國藥典����、指導(dǎo)原則未規(guī)定其可接受標(biāo)準(zhǔn)����,根據(jù)《中國藥品檢驗標(biāo)準(zhǔn)操作規(guī)范》相關(guān)規(guī)定,可接受標(biāo)準(zhǔn)可參照下表
Δ:轉(zhuǎn)出實驗室和接收實驗室的平均值絕對偏差�。
RT:報告閾值(report threshold value).
1:每批樣品需要配制的供試品溶液數(shù)���。
2:中間精密度,如n=4����,則是在轉(zhuǎn)移實驗室和接收實驗室進(jìn)行的2個重復(fù)測定的相對標(biāo)準(zhǔn)偏差。
3:根據(jù)USP����,EP和JP制定。
分析方法轉(zhuǎn)移報告通常有接收方實驗室匯總����,內(nèi)容應(yīng)包括被測樣品的名稱;轉(zhuǎn)移的分析方法(名稱�,版本號);方法轉(zhuǎn)移方案���;接受實驗室人員的培訓(xùn)記錄����;責(zé)任(如方法轉(zhuǎn)移總結(jié)報告的審核和批準(zhǔn))����;轉(zhuǎn)移中使用的儀器、器具和試劑�����;轉(zhuǎn)出實驗室及接收實驗室的檢驗結(jié)果�����;評估方法轉(zhuǎn)移報告中的偏差及異常結(jié)果的調(diào)查�����;根據(jù)接收標(biāo)準(zhǔn)評估數(shù)據(jù)�����;總結(jié)與結(jié)論�。
2分析方法確認(rèn)應(yīng)考慮的關(guān)鍵點
2.1、無需方法確認(rèn)的檢測項目
一般來說�����,藥典中收載的基本檢測方法不要求進(jìn)行方法確認(rèn)�。基本檢驗方法包括:干燥失重����、熾灼殘渣�����、重金屬�����、熱分析法等���,以及各種濕法化學(xué)分析(比如酸值測定)和用簡單的儀器進(jìn)行的檢測(如pH測定)等。
2.2����、方法確認(rèn)項應(yīng)考慮的關(guān)鍵點
在參考?xì)W洲OMCL的《分析方法驗證》、AOAC的《如何達(dá)到ISO 17025對方法確認(rèn)的要求》以及《美國藥典》附錄<1226>的基礎(chǔ)之上����,并結(jié)合藥品研發(fā)實際工作內(nèi)容,方法確認(rèn)的項目分為三類
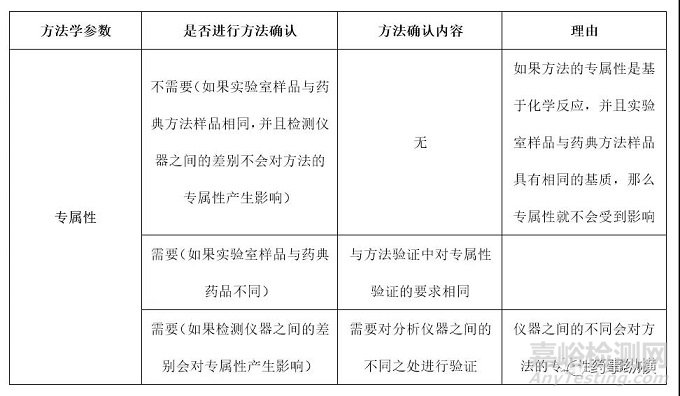
鑒別檢查 鑒別檢查是藥典分析方法中最常見的一個檢驗項目�����。由于鑒別檢查的目的是為了判斷被檢測物是否是目標(biāo)檢測物���,因此���,對于鑒別檢查來說最重要的一個方法學(xué)參數(shù)就是專屬性。
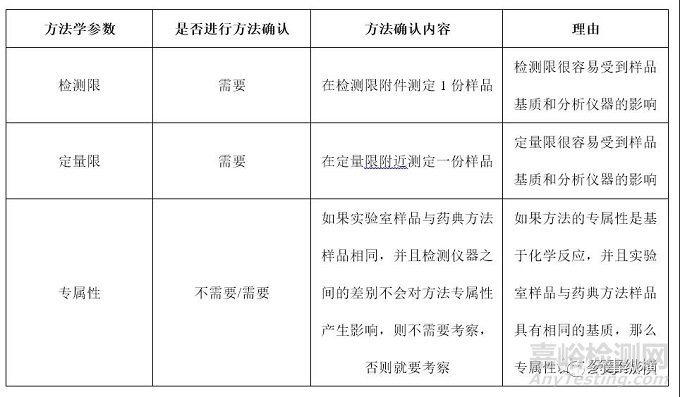
被測物濃度在定量限附近的檢測檢查 對于藥典方法中收載限度檢查來說��,有一部分限度檢查是被測物濃度在定量限附近的檢測�,此類檢測最為常用的一類就是殘留溶劑檢查法。
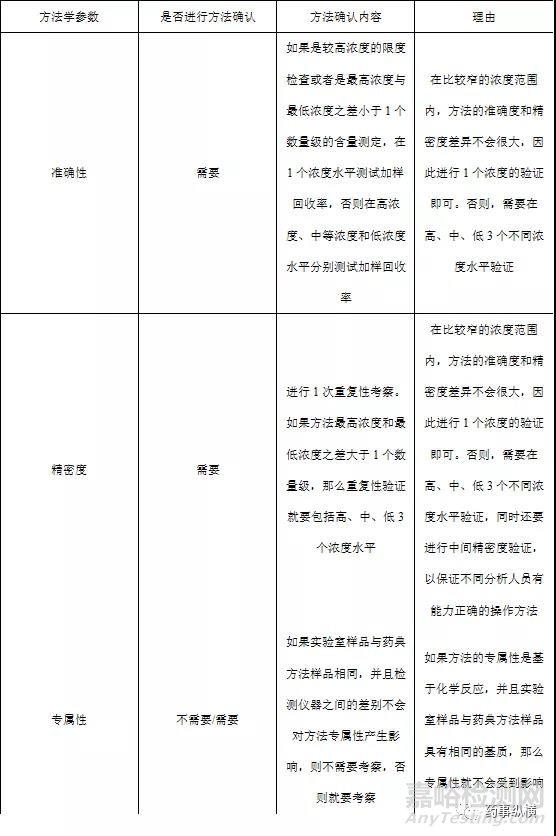
較高濃度的限度檢查和含量測定藥典中收載品種的各論項下的有關(guān)物質(zhì)檢查很多都是被測物濃度較高的限度檢查���,另外還有水分測定�����、2-乙基己酸測定等很多特定檢測項目都屬于此類檢驗�。由于被測物濃度相對較高���,從方法學(xué)確認(rèn)的角度來說�,此類檢驗與含量測定屬于同一個類別��。
實驗室和方法確認(rèn)的有關(guān)文件應(yīng)該包括:確認(rèn)計劃����、被確認(rèn)方法的詳細(xì)描述����、需要進(jìn)行確認(rèn)的方法學(xué)參數(shù)的詳細(xì)描述確認(rèn)結(jié)果的判定標(biāo)準(zhǔn)���、對偏差的合理解釋����。
參考文獻(xiàn)
[1] 2019年版中國藥品檢驗標(biāo)準(zhǔn)操作規(guī)范
[2].Guidance forindustry:analytical proceduires and methods validation:chemistry����,manufacturing,and control and documentation[EB/OL]
[3] Guidance for industry:bioanalyticalmethod validation[EB/OL]