今日頭條
泰它西普治療干燥綜合征Ⅱ期臨床積極���。榮昌生物在ACR2022年會(huì)上公布BLyS/APRIL雙靶點(diǎn)融合蛋白泰它西普治療原發(fā)性干燥綜合征的中國(guó)Ⅱ期臨床研究結(jié)果��。研究采用重復(fù)測(cè)量混合效應(yīng)模型(MMRM)�����,在全分析集(FAS)和符合方案集(PPS)分析中���,與安慰劑相比,泰它西普160mg組患者12周和24周的ESSDAI評(píng)分均較基線顯著降低��。泰它西普240mg組與安慰劑組相比���,在PPS分析中24周的ESSDAI較基線顯著降低���;在FAS分析中12周的ESSDAI較基線顯著降低。臨床中無嚴(yán)重的不良事件發(fā)生。
國(guó)內(nèi)藥訊
1.連花清瘟和連花清咳啟動(dòng)新冠IV期臨床��。以嶺藥業(yè)連花清瘟膠囊和連花清咳片在臨床試驗(yàn)注冊(cè)網(wǎng)站(Clinicaltrials.gov)登記兩項(xiàng)IV期臨床��,分別是連花清瘟膠囊用于新冠病毒感染患者長(zhǎng)期康復(fù)的療效和安全性研究��、連花清咳片用于奧密克戎病毒感染患者長(zhǎng)期康復(fù)療效和安全性的6個(gè)月隨訪研究��。兩項(xiàng)試驗(yàn)均由山東大學(xué)齊魯醫(yī)院心內(nèi)科研究員�����、副主任醫(yī)師郝盼盼發(fā)起���。
2.前沿生物吸入型新冠藥獲批II/III期臨床�����。前沿生物宣布��,國(guó)家藥監(jiān)局已批準(zhǔn)霧化吸入用FB2001(Bofutrelvir)用于治療輕型��、普通型新冠病毒(SARSCoV-2)感染患者的II/III期臨床試驗(yàn)方案。FB2001是前沿生物與中科院上海藥物所���、中科院武漢病毒所共同開發(fā)的3CL蛋白酶抑制劑��。臨床前研究顯示��,經(jīng)霧化吸入給藥��,F(xiàn)B2001在大鼠和犬具有良好的安全性�����,在大鼠和犬的上呼吸道和肺部有很高的藥物濃度��。
3.基準(zhǔn)醫(yī)療膀胱癌無創(chuàng)早檢產(chǎn)品上臨床�����。基準(zhǔn)醫(yī)療基于DNA甲基化檢測(cè)技術(shù)開發(fā)的膀胱癌早檢產(chǎn)品UriFind在美國(guó)的注冊(cè)臨床試驗(yàn)首例患者入組���。UriFind是一款膀胱癌無創(chuàng)早檢產(chǎn)品�����,其具備無痛���、無創(chuàng)、操作簡(jiǎn)便的特點(diǎn),只需受檢者提供尿液�����,通過對(duì)尿液中脫落細(xì)胞DNA進(jìn)行甲基化檢測(cè)��,便可準(zhǔn)確檢測(cè)膀胱癌�����。去年7月��,F(xiàn)DA已授予UriFind“突破性醫(yī)療器械”認(rèn)定���,以及快速審評(píng)資格�����。今年8月�����,UriFind也獲得NMPA的優(yōu)先審評(píng)資格���。
4.歌禮新冠口服藥獲FDA臨床許可���。歌禮新冠口服候選藥物蛋白酶(3CLpro)抑制劑ASC11獲FDA批準(zhǔn)��,即將開展I期臨床��,評(píng)估不同劑量ASC11聯(lián)合利托那韋片劑(100mg)用于健康受試者的安全性和初步療效�����,同時(shí)也為在新冠病人中開展關(guān)鍵II/III期臨床確定合適劑量�����?����?剐鹿诓《炯?xì)胞實(shí)驗(yàn)顯示���,ASC11的抗病毒活性(EC90)為奈瑪特韋的31倍 (155/5)���,S-217622的120倍(600/5),PBI-0451的16倍(78/5)以及EDP-235的7倍 (33/5)�����;而且,ASC11對(duì)奧密克戎變異株如BA.1和BA.5均保持活性���。
5.京東方再生醫(yī)學(xué)干細(xì)胞膜片獲批臨床��。京東方再生醫(yī)學(xué)申報(bào)的“人臍帶間充質(zhì)干細(xì)胞膜片”獲國(guó)家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可���,擬用于行冠狀動(dòng)脈旁路移植術(shù)(CABG)治療預(yù)期效果不佳的低射血分?jǐn)?shù)冠心病,這也是國(guó)內(nèi)首款獲批臨床的干細(xì)胞膜片新藥���。在臨床前有效性評(píng)價(jià)試驗(yàn)中��,使用該產(chǎn)品治療26周后觀察到明顯的心臟功能改善���,EF值升高(58%vs40%)、血管生成增多���、心肌纖維化和心肌梗死率降低(5.56%vs12.88%)�����。
6.康弘眼科AAV基因療法在美獲批臨床���。康弘藥業(yè)旗下弘基生物KH631眼用注射液獲FDA臨床許可�����,擬定適應(yīng)癥為新生血管性(濕性)年齡相關(guān)性黃斑變性(nAMD)的治療。KH631是新一代眼科基因治療產(chǎn)品��,通過腺相關(guān)病毒(AAV)遞送目標(biāo)基因�����,以糾正或補(bǔ)償缺陷和異?��;?����,達(dá)到治療目的��。11月17日���,KH631在中國(guó)獲批開展nAMD的臨床試驗(yàn)。
國(guó)際藥訊
1.艾伯維IL-23抗體在歐盟獲批新適應(yīng)癥��。艾伯維IL-23抑制劑Skyrizi(risankizumab)的新適應(yīng)癥上市申請(qǐng)獲歐盟委員會(huì)(EC)批準(zhǔn),用于治療中重度活動(dòng)性克羅恩病成人患者�����。IL-23是一種參與炎癥過程的細(xì)胞因子���,與許多慢性免疫介導(dǎo)的疾病有關(guān)�����。該藥此前已在美國(guó)�����、歐盟獲批用于治療成人銀屑病和銀屑病關(guān)節(jié)炎��。在中國(guó)�����,該藥正在國(guó)際(含中國(guó))Ⅲ期臨床中評(píng)估治療克羅恩病和潰瘍性結(jié)腸炎的潛力�����。
2.武田四價(jià)登革熱疫苗在美報(bào)BLA���。FDA受理武田登革熱候選疫苗TAK-003的生物制品許可申請(qǐng)���,并授予優(yōu)先審評(píng)資格。Qdenga是一種減毒活疫苗�����,設(shè)計(jì)用以保護(hù)人體四種血清型的登革熱�����。在關(guān)鍵Ⅲ期TIDES臨床中���,4~16歲兒童接種TAK-003后12個(gè)月時(shí),疫苗的保護(hù)效力達(dá)到80.2%�����;在隨訪時(shí)間為54個(gè)月時(shí)�����,TAK-003預(yù)防因登革熱住院的效力為84%�����,預(yù)防出現(xiàn)癥狀的登革熱的效力為61%。
3.楊森創(chuàng)新鼻噴劑抑郁癥Ⅲb期臨床積極���。楊森NMDA受體拮抗劑Spravato(esketamine鼻噴霧劑)在治療難治性抑郁癥(TRD)的Ⅲb期臨床(ESCAPE-TRD)達(dá)到主要終點(diǎn)���。與喹硫平緩釋片組相比,esketamine組第8周時(shí)達(dá)到緩解的患者比例顯著提高(27.1% vs17.6%)�����,第32周時(shí)達(dá)到緩解的患者比例明顯更高(55% vs37%)��。藥物的安全性與之前研究一致���。2019年3月���,該藥首次獲得FDA批準(zhǔn)上市,與口服抗抑郁藥物聯(lián)用治療嚴(yán)重抑郁癥患者�����。
4.口服JAK抑制劑斑禿III期臨床數(shù)據(jù)積極。Concert公司公布口服JAK抑制劑deuruxolitinib (CTP-543)治療中重度斑禿的III期THRIVE-AA1試驗(yàn)最新數(shù)據(jù)�����。CTP-543治療使重度脫發(fā)(SALT評(píng)分≥95)和脫發(fā)持續(xù)≥4年的斑禿患者頭皮毛發(fā)再生得到顯著改善��;deuruxolitinib(8mg和12mg)治療使重度脫發(fā)患者24周后SALT評(píng)分達(dá)到20及以下的患者比例分別達(dá)到20%和30%���,在脫發(fā)持續(xù)≥4年患者中這一數(shù)值分別為23%和29%���。預(yù)計(jì)明年上半年遞交新藥申請(qǐng)。
5.重癥肌無力藥物獲FDA優(yōu)先審評(píng)資格���。FDA受理argenx公司皮下注射efgartigimod用于治療全身性重癥肌無力(gMG)的生物制品許可申請(qǐng),并授予優(yōu)先審評(píng)資格���,PDUFA日期為明年3月20日���。去年年底,efgartigimod的靜脈注射劑型已獲FDA批準(zhǔn)上市���,成為全球首款獲批的FcRn單抗���。在一項(xiàng)III期ADAPT-SC研究中�����,efgartigimod皮下注射與靜脈輸注相比��,使患者IgG的降幅達(dá)非劣效性標(biāo)準(zhǔn)(66.4%vs62.2%�����,p<0.0001)���。再鼎醫(yī)藥擁有efgartigimod在大中華區(qū)的開發(fā)和商業(yè)化權(quán)益。
6.GSK撤銷BCMA ADC美國(guó)上市適應(yīng)癥��。葛蘭素史克宣布從美國(guó)市場(chǎng)上撤回BCMA ADC藥物Blenrep(belantamab mafodin blmf)用于治療接受過至少四種療法的復(fù)發(fā)/難治多發(fā)性骨髓瘤(RRMM)的上市適應(yīng)癥��。在III期DREAMM-3試驗(yàn)中�����,與pomalidomide聯(lián)合低劑量地塞米松相比���,Blenrep單藥未達(dá)到PFS優(yōu)效性主要終點(diǎn)(中位PFS:11.2個(gè)月vs7個(gè)月)�����。2020年8月�����,基于DREAMM-2研究積極結(jié)果��,Blenrep獲得FDA加速批準(zhǔn)上市�����,成為全球首個(gè)BCMA靶向療法��。
醫(yī)藥熱點(diǎn)
1.宋爾衛(wèi)院士榮獲2022年“世界科學(xué)院獎(jiǎng)”���。聯(lián)合國(guó)教科文組織—世界科學(xué)院(UNESCO-TWAS)第十六屆大會(huì)11月21日至24日召開���。2022年世界科學(xué)院獎(jiǎng)(2022 TWAS Awards)授予來自中國(guó)��、巴西��、阿根廷��、沙特阿拉伯、墨西哥���、土耳其等國(guó)共計(jì)13位科學(xué)家��。中山大學(xué)孫逸仙紀(jì)念醫(yī)院院長(zhǎng)宋爾衛(wèi)院士榮獲2022年世界科學(xué)院獎(jiǎng)——醫(yī)學(xué)科學(xué)領(lǐng)域�����,以表彰他“在腫瘤微環(huán)境和免疫治療方面取得了系列原創(chuàng)性學(xué)術(shù)成果�����、并創(chuàng)新性提出腫瘤生態(tài)學(xué)說”�����。
2.基層衛(wèi)生健康綜合試驗(yàn)區(qū)將動(dòng)態(tài)調(diào)整��。近日���,國(guó)家衛(wèi)健委印發(fā)《關(guān)于建立動(dòng)態(tài)調(diào)整機(jī)制加快推進(jìn)基層衛(wèi)生健康綜合試驗(yàn)區(qū)建設(shè)的通知》,新增北京市密云區(qū)�����、廣西壯族自治區(qū)防城港市上思縣、海南省東方市�����、貴州省遵義市習(xí)水縣等4個(gè)縣(市���、區(qū))為全國(guó)基層衛(wèi)生健康綜合試驗(yàn)區(qū)�����,并決定對(duì)試驗(yàn)區(qū)建設(shè)情況開展評(píng)價(jià)和調(diào)整�����,明確連續(xù)兩年評(píng)價(jià)排名后兩位的試驗(yàn)區(qū)將被調(diào)整至候補(bǔ)試驗(yàn)區(qū)��,候補(bǔ)試驗(yàn)區(qū)建設(shè)成效顯著的調(diào)整為試驗(yàn)區(qū)���。
3.上海市健康科普影響力排行榜出爐。近日�����,來自上海市醫(yī)療機(jī)構(gòu)��、社區(qū)衛(wèi)生服務(wù)中心��、醫(yī)務(wù)人員健康科普影響力三個(gè)指數(shù)排行榜顯示:復(fù)旦大學(xué)附屬中山醫(yī)院�����、上海交通大學(xué)醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院�����、上海市第一婦嬰保健院等入選醫(yī)療機(jī)構(gòu)健康科普影響力指數(shù)排行榜50強(qiáng)���;黃浦區(qū)打浦橋街道社區(qū)衛(wèi)生服務(wù)中心�����、松江區(qū)泗涇鎮(zhèn)社區(qū)衛(wèi)生服務(wù)中心���、奉賢區(qū)南橋鎮(zhèn)社區(qū)衛(wèi)生服務(wù)中心等入選社區(qū)衛(wèi)生服務(wù)中心健康科普影響力指數(shù)排行榜50強(qiáng);段濤��、崔松�����、楊陽等入選醫(yī)務(wù)人員健康科普影響力指數(shù)排行榜100強(qiáng)。
4.上海積極推薦細(xì)胞治療創(chuàng)新產(chǎn)品進(jìn)入醫(yī)保���。上海市科技委聯(lián)合上海市衛(wèi)健委等部門發(fā)布《上海市促進(jìn)細(xì)胞治療科技創(chuàng)新與產(chǎn)業(yè)發(fā)展行動(dòng)方案(2022—2024年)》�����?��!斗桨浮樊?dāng)中提出:“積極推薦已上市細(xì)胞治療創(chuàng)新產(chǎn)品進(jìn)入國(guó)家醫(yī)保藥品目錄和“滬惠保”等惠民型商業(yè)醫(yī)療保險(xiǎn)。發(fā)揮多層次商業(yè)醫(yī)療保險(xiǎn)作用��,推動(dòng)本市企業(yè)���、商業(yè)保險(xiǎn)公司及醫(yī)療機(jī)構(gòu)等共同合作探索分期付費(fèi)���、按療效付費(fèi)等創(chuàng)新支付模式。”
評(píng)審動(dòng)態(tài)
1. CDE新藥受理情況(11月23日)
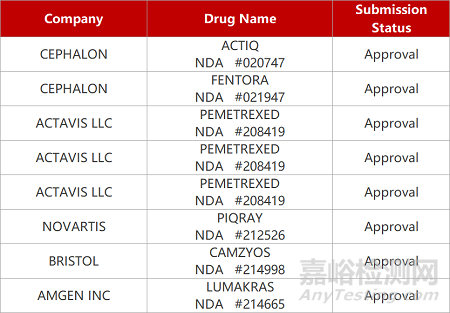
2. FDA新藥獲批情況(北美11月22日)