本文對FDA在2022財年(2021年10月1日至2022年9月30日)發(fā)布的警告信和483中所涉及的所有缺陷項按照類別和出現(xiàn)頻率進行了統(tǒng)計梳理,從而幫助業(yè)界更清楚地了解FDA檢查的最新關(guān)注點和GMP檢查中最常出現(xiàn)的缺陷項��,進而有針對性地進行自檢和改進工作��。
警告信中的缺陷項
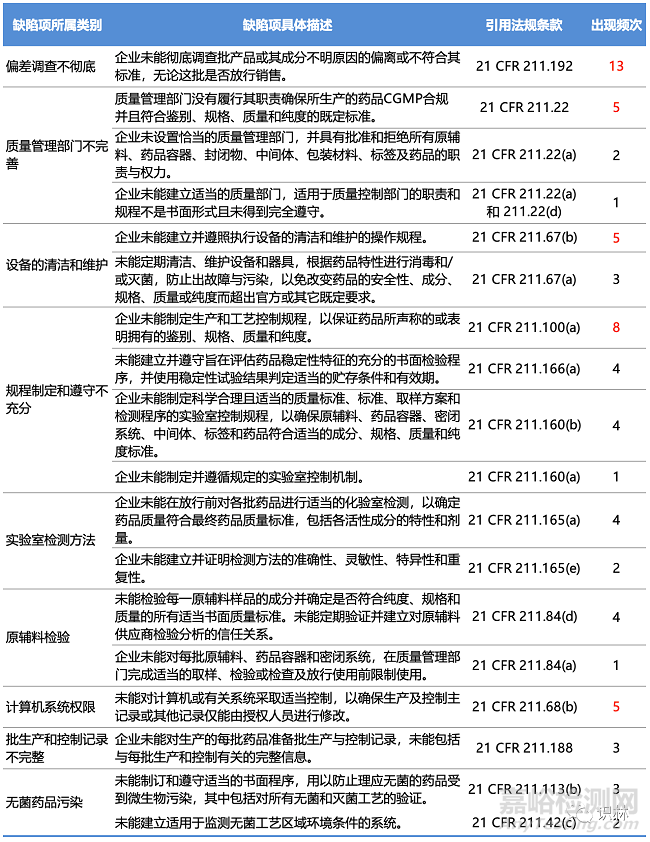
以識林當前已經(jīng)翻譯的32封FDA在2022財年發(fā)布的藥品相關(guān)警告信為樣本����,其中包括制劑25封,原料藥6封����,生物制品1封。這32封警告信中共涉及92條缺陷項����,下表將出現(xiàn)頻次較高的缺陷項劃分了幾個主要類別,并統(tǒng)計了各缺陷項所對應(yīng)的21 CFR 211條款和出現(xiàn)頻次(標注紅色的為出現(xiàn)頻次較高的缺陷項)����。
483中的缺陷項
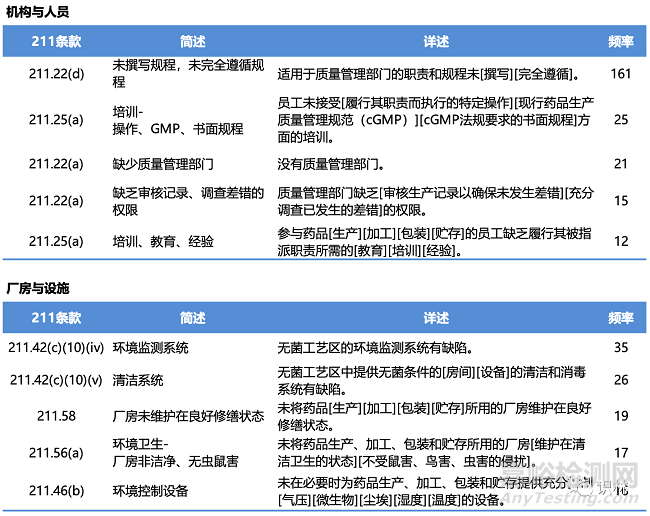
在2022年財年,F(xiàn)DA與藥品有關(guān)的現(xiàn)場檢查��,有483缺陷的總計466次����;與生物制品有關(guān)的現(xiàn)場檢查,有483缺陷的總計61次�����;與醫(yī)療器械有關(guān)的現(xiàn)場檢查��,有483缺陷的總計528次����。其中與211有關(guān)的缺陷項分類、簡述��、詳述、頻率以及具體條款��,見下列各表����。(注:下列各表中僅列舉各類別中出現(xiàn)頻率較高的缺陷項類別,并非所有483缺陷項)