面對生產(chǎn)低風(fēng)險醫(yī)療器械的制造商普遍關(guān)心的問題����,MDSAP認證是可以豁免的么�����?新版MDSAP審計方法為大家?guī)砹舜鸢浮?/span>
2022年MDSAP AUDIT APPROACH 迎來了更新版本�����,其中一個顯著變化是�����,新增了附錄6�����,澄清了MDSAP五國的監(jiān)管機構(gòu)允許的豁免政策�����。
"審核組織不得將任何過程�����、產(chǎn)品或服務(wù)排除在審核范圍或證書范圍之外�����,除非認可的監(jiān)管機構(gòu)所管理的法規(guī)允許排除"��。這一要求被用來證明參加MDSAP的組織必須接受認證范圍的審核��,包括所有醫(yī)療器械分銷的司法管轄區(qū)��,以及在這些司法管轄區(qū)分銷的所有醫(yī)療設(shè)備��。
有資格被排除在MDSAP計劃之外的活動/過程�����、產(chǎn)品或設(shè)備首次在MDSAP AUDIT APPROACH中以附件的方式列出��。
請注意:
● 一個設(shè)備只有在符合所有適用于審計的管轄區(qū)的相應(yīng)排除標(biāo)準(zhǔn)時,才能被排除在MDSAP的審計范圍之外��。
● 一個轄區(qū)只有在沒有任何醫(yī)療設(shè)備在該轄區(qū)銷售的情況下才可以被排除�����,或者在該轄區(qū)銷售的所有醫(yī)療設(shè)備都可以被排除�����。
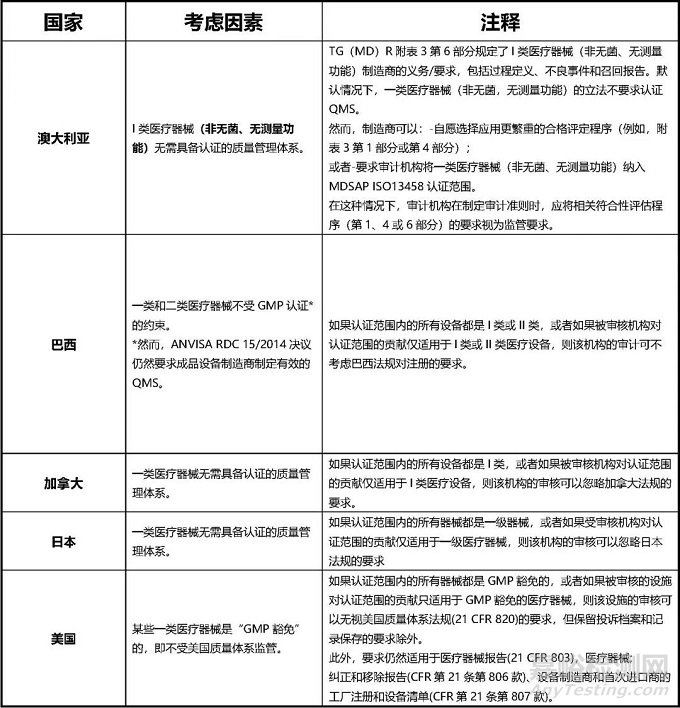
從上我們可以看到�����,并非所有的一類醫(yī)療器械制造商可以豁免在質(zhì)量體系認證之外����,比如澳大利亞對一類滅菌和一類帶測量功能的設(shè)備是不能豁免的����;巴西雖然對一類醫(yī)療器械制造商豁免體系認證,但仍要求成品制造商制定有效的質(zhì)量管理體系����。
美國的要求中明確指明了僅GMP豁免的一類器械才可以。
從如下FDA官網(wǎng)中我們可以查詢510(k)豁免清單和GMP的要求:
Medical Device Exemptions 510(k) and GMP Requirements (fda.gov)
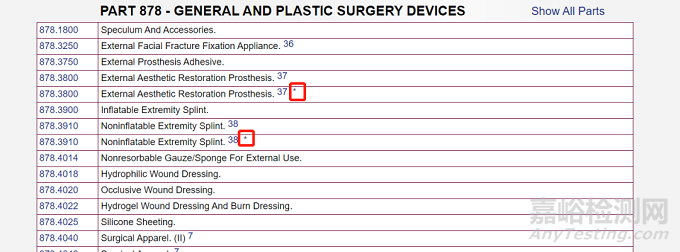
在網(wǎng)頁上我們可以看到重要提醒:只有帶星號(*)的I類器械也被豁免于GMP法規(guī)。
而從下面的截圖我們可以看到只有極少數(shù)產(chǎn)品標(biāo)注了*號����。這就是說美國可以豁免GMP的器械其實是很少的。