如何充分利用動(dòng)物實(shí)驗(yàn)信息����,以提高探索性臨床試驗(yàn)的效率,一直是藥物開(kāi)發(fā)人員關(guān)心的重大課題�。目前主要有三大應(yīng)用場(chǎng)景:首次人體試驗(yàn),最大起始推薦劑量(MRSD)����;II期劑量探索試驗(yàn)有效劑量范圍的初步估算;通過(guò)給與人化劑量觀測(cè)動(dòng)物模型的有效性和安全性�。前兩種需要從動(dòng)物劑量換算至人體劑量,后一種需要從人體劑量推算動(dòng)物劑量����。本文詳細(xì)綜述了幾種動(dòng)物和人劑量轉(zhuǎn)換的幾種方法,可以為業(yè)內(nèi)人員提供有益的指導(dǎo)和幫助����。
臨床中人體起始劑量及其在物種間的轉(zhuǎn)換是一個(gè)復(fù)雜的過(guò)程。在許多情況下����,無(wú)法獲得針對(duì)特定物種的初始藥物劑量。種屬之間的類(lèi)推可用于從適當(dāng)?shù)膭?dòng)物數(shù)據(jù)預(yù)測(cè)人血漿藥物濃度曲線(xiàn)和藥代動(dòng)力學(xué)參數(shù)����。然而,通常的劑量轉(zhuǎn)換假設(shè)僅基于體重是不合適的�,因?yàn)樯锘瘜W(xué)功能系統(tǒng)在物種之間是不同的,并最終改變PK參數(shù)��。從動(dòng)物到人的劑量外推需要考慮體表面積�、藥理、生理和解剖因素����、PK參數(shù)、代謝功能����、受體和壽命,以確保臨床試驗(yàn)的安全性�。在眾多因素中,體重和體表面積可用于劑量換算。
異速放大法(Allometric scaling)是一種經(jīng)驗(yàn)方法����,該方法依據(jù)臨床前各種屬的體內(nèi)數(shù)據(jù)采用整體異速放大的方法來(lái)推測(cè)人體劑量。其中劑量的相互關(guān)系取決于劑量對(duì)身體表面積的標(biāo)準(zhǔn)化產(chǎn)生等效的生物效應(yīng)的假設(shè)�。異速放大法因其相對(duì)簡(jiǎn)單而得到了最廣泛的應(yīng)用;然而����,由于它的經(jīng)驗(yàn)性質(zhì),人們?cè)谑褂盟鼤r(shí)應(yīng)該謹(jǐn)慎��。異速放大方法假設(shè)存在特定的特征����,這些特征在物種之間是獨(dú)一無(wú)二的,并考慮動(dòng)物的PKs可能的差異����。
1 FIRST-IN-HUMAN劑量
對(duì)于任何在臨床前研究中成功表現(xiàn)出良好效果的治療分子,在初始臨床試驗(yàn)中選擇首次人用(FIH)劑量都是臨床藥物開(kāi)發(fā)的重要任務(wù)�。重要的是要有一個(gè)理想和安全的人體起始劑量,因?yàn)楦邉┝靠赡軐?dǎo)致嚴(yán)重的毒性��,而低劑量可能會(huì)延長(zhǎng)劑量上升過(guò)程��,延遲臨床結(jié)果,并增加在FIH臨床試驗(yàn)中暴露于無(wú)效劑量的患者數(shù)量��。
有許多方法可以確定FIH劑量�,包括DOSE-BY-FACTOR(基于未觀察到的不良反應(yīng)水平[NOAELs])、藥代動(dòng)力學(xué)指導(dǎo)方法����、最小預(yù)期生物效應(yīng)水平(MABEL)��、PK-PD模型����、類(lèi)似藥物方法和微給藥。歐洲藥品管理局(EMA)建議�,如果不同的方法對(duì)人體的安全劑量給出了不同的預(yù)計(jì),那么應(yīng)該考慮使用最低值作為FIH研究的起點(diǎn)��。下文將重點(diǎn)闡述劑量因子法(DOSE-BY-FACTOR)����。
DOSE-BY-FACTOR
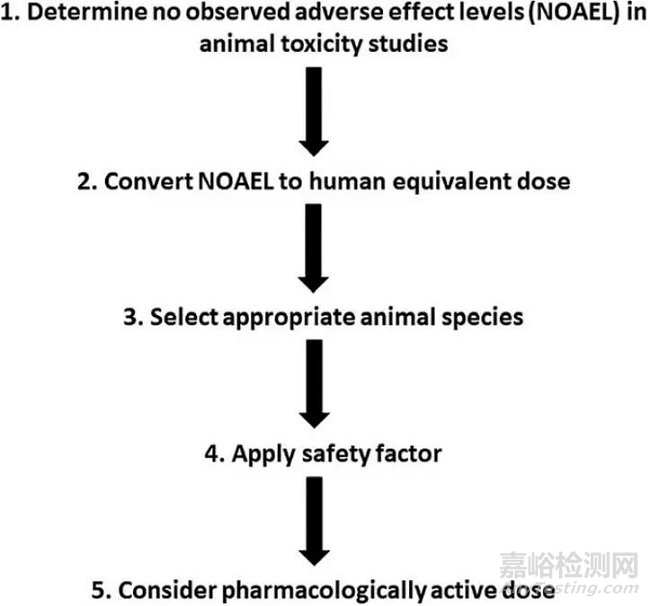
圖1 人體研究中預(yù)估起始劑量的示意圖表示
劑量因子法(DOSE-BY-FACTOR)是一種常用的經(jīng)驗(yàn)方法,從精心設(shè)計(jì)的動(dòng)物毒理學(xué)研究的劑量-反應(yīng)曲線(xiàn)關(guān)注藥物的NOAEL��。在這種方法中�,劑量的選擇是基于最小的毒性風(fēng)險(xiǎn),而不是最小的人體藥理活性。這種經(jīng)驗(yàn)方法對(duì)作用于已確定靶點(diǎn)的新分子和/或具有相對(duì)成熟的藥理學(xué)的新分子很有效����。FDA 指南推薦劑量因子方法,其中使用異速生長(zhǎng)因子調(diào)整的任何新藥或生物療法的 NOAEL(在動(dòng)物中評(píng)估)用于估計(jì)健康人類(lèi)受試者臨床研究的最大推薦起始劑量(MRSD)�。
這種方法考慮了每個(gè)物種體表面積的大小,這與它們的新陳代謝有關(guān)����。此外,假設(shè)對(duì)體表面積進(jìn)行歸一化處理時(shí)����,物種之間存在1:1的關(guān)系,從而確定MRSD����。其他考慮的信息包括相關(guān)的臨床前數(shù)據(jù)、藥理活性劑量(PADs)�、毒理學(xué)特征和 PKs 。一般來(lái)說(shuō)��,MRSD是根據(jù)臨床前毒理學(xué)研究估計(jì)的����,并進(jìn)一步應(yīng)用安全系數(shù)����。用于預(yù)估人體研究中MRSD的五個(gè)步驟如圖1所示����。步驟包括確定動(dòng)物物種的NOAEL,將NOAEL轉(zhuǎn)化為人當(dāng)量劑量(HED)�,選擇物種,應(yīng)用安全系數(shù)�,最后考慮藥理活性劑量(PADs)��。
1 確定NOAEL
NOAEL是不會(huì)引起顯著不良反應(yīng)的最高劑量水平�,是從典型動(dòng)物毒性研究的劑量-反應(yīng)曲線(xiàn)中得出的安全劑量水平。應(yīng)在至少三種動(dòng)物中確定NOAEL值����,其中一種應(yīng)是非嚙齒類(lèi)動(dòng)物。
2 將NOAEL轉(zhuǎn)換為人體當(dāng)量劑量(HED)
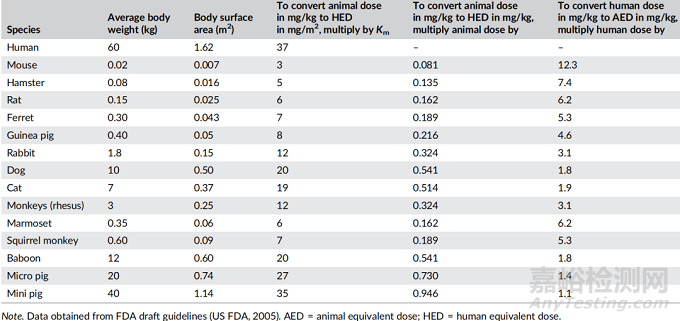
對(duì)體表面積的修正可能是有利的�,因?yàn)樗黾恿税踩担?dǎo)致更保守的起始劑量�。因此,在這一步中��,NOAEL劑量轉(zhuǎn)換為以體表面積為基礎(chǔ)�,使用表1所述的不同動(dòng)物種屬的適當(dāng)比例因子進(jìn)行HED換算����。換算的概念是體表面積取決于動(dòng)物體重(W)�,并隨W0.67而變化,因此使用的換算系數(shù)為W0.67(Shin & Seol, 2010)�。
動(dòng)物種類(lèi)的表面積(A)一般取A = KW0.67,其中K為常數(shù)����,W為動(dòng)物體重(g)。“K”值隨物種的不同而改變�,如小鼠(9),大鼠(9.6)��,豚鼠(9)�,兔子(10),犬(11)�,貓(8.7),猴子(11.8)����。因此,體重為150克的大鼠��,其表面積可計(jì)算為A = 9.6×1500.67= 275 cm2或0.0275m2��。下面將詳細(xì)介紹用不同方法測(cè)定HED。
表1 基于動(dòng)物和人類(lèi)的劑量轉(zhuǎn)換
3 種屬的選擇
在接下來(lái)的步驟中��,選擇最適合估計(jì)HED的種屬��。在無(wú)法確定最合適的種屬的情況下����,使用HED最低的動(dòng)物種屬(被認(rèn)為是最敏感的種屬)來(lái)推導(dǎo)潛在的人類(lèi)暴露參數(shù)。選擇最優(yōu)種屬的關(guān)鍵因素是藥物在不同種屬之間的吸收��、分布�、代謝和排泄(ADME)和作用方式的差異。然而�,人類(lèi)的ADME可能不同����,但基于體外研究比較的代謝數(shù)據(jù)可能是可用的,可以使用����。
因此,還可以根據(jù)ADME選擇特定的動(dòng)物種屬��。并且�,以前的研究表明��,特定的動(dòng)物種屬更能預(yù)測(cè)人類(lèi)對(duì)某一類(lèi)藥物的毒性����,可以在確定動(dòng)物種屬時(shí)加以考慮��。然而����,對(duì)于某些藥物,種屬的選擇需要額外的考慮�,因此,具有最低HED的種屬不是主要標(biāo)準(zhǔn)��。在這種情況下����,要考慮相關(guān)受體的表達(dá)、與毒性相關(guān)的生物化學(xué)和生理的相似性����,以及藥物有限的生物跨物種藥理反應(yīng)性等因素。
4 應(yīng)用安全系數(shù)
觀察到的HED進(jìn)一步調(diào)整為乘以默認(rèn)的安全系數(shù)����,以提供第一劑臨床用藥的人體受試者足夠的安全邊際�,此默認(rèn)值可能不適用于所有情況�。它可以在特定條件下增加或減少,以提供額外的安全保證����,以保護(hù)FIH劑量。這一安全因素導(dǎo)致了外推的可變性����、人類(lèi)更大敏感性的不確定性、感知毒性的困難��、受體密度或親和力的變化��、不可預(yù)測(cè)的毒性以及物種間ADME的差異��。
當(dāng)非臨床安全數(shù)據(jù)審查中提及以下任何問(wèn)題時(shí)����,安全系數(shù)通常會(huì)增加(>10)��,這些問(wèn)題包括陡峭的劑量-反應(yīng)曲線(xiàn)����、嚴(yán)重的毒性�、可變的生物利用度�、不可監(jiān)測(cè)的毒性、無(wú)先兆體征的毒性��、不可逆的毒性����、無(wú)法解釋的死亡率、劑量或血漿藥物水平誘導(dǎo)作用的大變動(dòng)性��、非線(xiàn)性的PKs�、劑量-反應(yīng)數(shù)據(jù)不充分、新的治療靶點(diǎn)�、或者解釋能力有限的動(dòng)物模型。
反之����,安全系數(shù)可以降低(<10),如藥物具有良好的特征����、通過(guò)相同的途徑給藥、或具有相似的代謝特征和生物利用度��。如果包括人類(lèi)在內(nèi)的所有被測(cè)試物種的毒性特征是相當(dāng)?shù)模敲窗踩禂?shù)也可以降低����;毒性易于監(jiān)測(cè)、可逆和可預(yù)測(cè)�,且與受測(cè)物種的毒性呈中-淺劑量-反應(yīng)關(guān)系時(shí)安全系數(shù)也可降低。與建議的人類(lèi)臨床時(shí)間表相比��,當(dāng)毒性研究持續(xù)時(shí)間較長(zhǎng)����,并假設(shè)毒性是累積的,毒性與治療濃度的急性峰值無(wú)關(guān)����,且在重復(fù)劑量研究早期沒(méi)有發(fā)生時(shí),也可以考慮較低的安全系數(shù)�。
5 考慮藥理活性劑量
最后,將MRSD值與人的PAD進(jìn)行比較�。人類(lèi)PAD的選擇是考慮了很多因素,這些因素通常在藥物類(lèi)別和臨床適應(yīng)癥之間有很大的差異��。PAD被定義為在具有預(yù)期藥理活性的動(dòng)物物種中測(cè)試的最小劑量����。一般來(lái)說(shuō),藥物分子的PAD值是由動(dòng)物研究或適當(dāng)?shù)乃幚韺W(xué)模型確定的�。得到的MRSD(步驟4)可以用來(lái)比較從合適的藥理學(xué)模型中得到的PAD值。
然而��,我們可以使用體表面積轉(zhuǎn)換因子從動(dòng)物的PAD值來(lái)估計(jì)HED�,然后與MRSD進(jìn)行比較。如果HED小于MRSD��,建議基于科學(xué)原因減少臨床劑量����。此外,對(duì)于某些種類(lèi)的藥物或生物制劑��,可能由于夸大的藥理作用而產(chǎn)生毒性����。在這種情況下,PAD可能是比NOAEL更敏感的潛在毒性指標(biāo)����,因此需要降低MRSD。在臨床實(shí)踐中�,通常建議開(kāi)始時(shí)劑量要低于MRSD(美國(guó)FDA, 2005)。
2 應(yīng)用和局限
劑量因子法的主要優(yōu)點(diǎn)之一是它對(duì)小分子有良好的安全記錄��,而且易于使用。這種方法主要適用于全身用藥����。然而,當(dāng)藥物經(jīng)鼻內(nèi)��、皮下或肌內(nèi)給藥時(shí)�,需要額外考慮。另一方面�,使用安全系數(shù)使得該方法非常保守。此外�,這一程序不適用于生理濃度下使用的內(nèi)源性激素和蛋白質(zhì)以及疫苗。并且��,它主要限于預(yù)期全身暴露的藥物劑型����,不涉及臨床試驗(yàn)中的劑量上升或最大可吸收劑量。
3 基于劑量-體表面積歸一化的轉(zhuǎn)換
使用體表面積來(lái)轉(zhuǎn)換物種間的劑量是一種經(jīng)典的方法����,主要是因?yàn)檎3扇说难獫{體積/總循環(huán)血漿蛋白與體表面積之間具有極好的相關(guān)性。在臨床試驗(yàn)中�,已發(fā)現(xiàn)體表面積異速標(biāo)度對(duì)物種間劑量轉(zhuǎn)換的影響可增加安全性。美國(guó)FDA還建議����,只有通過(guò)體表面積的歸一化,才能準(zhǔn)確地進(jìn)行物種間的劑量外推��。確定HED的一般方程為: HED(mg/kg)= Animal NOAEL(mg/kg)×[Weightamimal(kg)/Weighthuman(kg)](1-b)��。
一般來(lái)說(shuō)����,對(duì)于mg/m2歸一化,“b”應(yīng)為0.67�。因此,使用[Weightanimal(kg)/Weighthuman(kg)]0.33在動(dòng)物和人的體重范圍內(nèi)估計(jì)換算系數(shù)��。例如��,在體重185克的大鼠體內(nèi)��,已知NOAEL值(27 mg/kg)的新藥分子的HED可以確定為:HED(mg/kg)= 27(mg/kg)×[0.185(kg)/60(kg)](0.33)=4(mg/kg)��。此外�,F(xiàn)IH可以通過(guò)HED來(lái)計(jì)算,即4(mg/kg)乘以人體體重(60kg)得到240mg(每人),然后除以安全系數(shù)(10)得到人體研究的初始劑量為24mg(每人)�。另一方面,正常的種間mg/kg換算(不考慮體表面積)通常會(huì)導(dǎo)致顯著高于按劑量因子法的HED�。
4 根據(jù)mg/kg和mg/m2換算
劑量與體重之間的關(guān)系并不是影響劑量外推的唯一因素��。通過(guò)使用修正因子Km�,可以將mg/kg劑量轉(zhuǎn)換為mg/m2劑量�,從而實(shí)現(xiàn)劑量轉(zhuǎn)換。用物種的平均體重(kg)除以其體表面積(m2)得到����。因此,對(duì)人體來(lái)說(shuō)��,Km因子可以用平均體重(60公斤)除以體表面積(1.62 m2)得到37����。
表1總結(jié)了通常用于評(píng)估HED的不同動(dòng)物物種的Km因子值。以mg/kg為單位的動(dòng)物劑量計(jì)算HED的公式如下: HED(mg/kg)= Animal dose (mg/kg)×(Animal Km/Human Km)��。由于特定物種的Km因子是一個(gè)常數(shù)��,因此使用Km比可以進(jìn)一步簡(jiǎn)化上述方程�。通過(guò)動(dòng)物Km因子除以人類(lèi)Km因子,可以很容易地得到表1中提到的Km比值的值����。例如,小鼠的Km因子(3)除以人的Km因子(37)����,即0.081(表1)��。
此外����,對(duì)于小鼠NOAEL值為89 mg/kg的新藥分子��,可以通過(guò)將小鼠劑量(89 mg/kg)乘以Km比(0.081)來(lái)估計(jì)HED(mg/kg)����,即7.2 mg/kg�。然而,Km因子在不同的動(dòng)物種類(lèi)中是不同的����,并且在一個(gè)物種中,隨著體重的增加�,Km因子會(huì)按比例上升到W0.67。例如�,大鼠的Km值為5.2(100克大鼠)、6(150克大鼠)和7(250克大鼠)不等����。因此�,在體重為150克的大鼠中�,NOAEL值為50 mg/kg的藥物活性成分的HED測(cè)定方法為: HED(mg/kg)= 50 mg/kg×(6/37)= 8.1 mg/kg。
然而����,對(duì)于體重為100克的大鼠,Km因子值為5.2����,因此,HED計(jì)算為: HED(mg/kg)= 50 mg/kg×(5.2/37)=7 mg/kg�。在考慮表面積的同時(shí),還可以利用Km因子在動(dòng)物種類(lèi)之間轉(zhuǎn)換劑量(mg/kg)����。
例如,我們可以將小鼠體內(nèi)的劑量(50 mg/kg)轉(zhuǎn)換為兔體內(nèi)相應(yīng)的劑量��,假設(shè)其等效基于mg/m2�。兔子的Km比值的值首先由小鼠Km因子(表1中的3)除以兔子Km因子(表1中的12),即0.25確定��。然后將小鼠劑量(50 mg/kg)乘以計(jì)算出的兔Km比值的值(0.25)��,得到兔劑量(12.5 mg/kg)。將動(dòng)物或人的劑量單位(mg/kg改為mg/m2)的改變通常是利用表1中的Km因子: mg/m2= Km×mg/kg��。
5 動(dòng)物等效劑量的測(cè)定
現(xiàn)有或臨床可用藥物的動(dòng)物等效劑量(AED)的換算可根據(jù)體表面積進(jìn)行估算�,只需將人體劑量(mg/kg)乘以表1中提到的Km比,使用下式:AED(mg/kg) =Human dose(mg/kg)×Kmratio����。例如,一種藥物對(duì)人的最大劑量是3.25 mg/ kg�。然后,通過(guò)將HED(mg/kg)乘以Km比(表1中的12.3)��,可以很容易地估計(jì)出小鼠的AED��,即40mg/kg�。
6 劑量研究的總結(jié)
人體安全起始劑量的轉(zhuǎn)換和預(yù)估是研究實(shí)驗(yàn)和/或臨床研究中不可缺少的部分�。預(yù)估FIH劑量仍然具有挑戰(zhàn)性和復(fù)雜性,應(yīng)謹(jǐn)慎進(jìn)行�。有必要記住的是,實(shí)際的臨床研究不能完全被動(dòng)物研究取代�,因?yàn)闆](méi)有動(dòng)物物種在所有方面模仿人類(lèi)。有各種各樣的FIH劑量測(cè)定方法��,它們各具優(yōu)點(diǎn)和局限性����,但尚未就一種理想的或通用的方法達(dá)成共識(shí)����。
研究人員必須考慮每種技術(shù)的意義和局限性以及預(yù)期藥物部分的PK和PD��,以選擇最準(zhǔn)確的方法����。不同的方法用于確定FIH劑量意味著物種間的劑量轉(zhuǎn)換是至關(guān)重要的,需要在新藥開(kāi)發(fā)期間在劑量轉(zhuǎn)換之前進(jìn)行適當(dāng)?shù)淖⒁?。在不同方法給出的安全劑量值不同的情況下,應(yīng)考慮以最低劑量作為FIH研究的起點(diǎn)�,同時(shí)在估計(jì)人體實(shí)際起始劑量時(shí)考慮安全系數(shù)的邊際。
參考文獻(xiàn):
1.Shery Jacob, et al�;Dose translation between laboratory animals and human in preclinical and clinical phases of drug development. Drug Dev Res. 2018;79:373–382.
2.Shery Jacob, et al,; A simple practice guide for dose conversion between animals and human,J Basic Clin Pharma 2016;7:27-31.