體外釋放試驗(yàn)(in vitro release test���,IVRT)是表征和評(píng)價(jià)半固體制劑性能的有效手段���,體外釋放速率可以反映藥物的溶解度�、粒徑�、劑型流變性等多種理化參數(shù)的綜合作用,可辨別處方和工藝變化對(duì)制劑的影響����,是產(chǎn)品開發(fā)����、質(zhì)量控制�、穩(wěn)定性考察及產(chǎn)品批準(zhǔn)后變更的重要質(zhì)量控制項(xiàng)目。
IVRT主要用人工膜或合成膜進(jìn)實(shí)驗(yàn),相較于體外透皮試驗(yàn)( in vitro permeation test�,IVPT),具有可操作性強(qiáng),重現(xiàn)性高����,且靈敏度相對(duì)較高的特點(diǎn)。后者主要用于人體或動(dòng)物的離體皮膚進(jìn)行實(shí)驗(yàn)���,模擬外用藥物在生理?xiàng)l件下的透皮過程�,對(duì)藥物釋放性能的試驗(yàn)等效性進(jìn)行評(píng)價(jià)���,但存在皮膚難以獲得�、皮膚受種屬�、年齡、狀態(tài)���、部位等多因素干擾�、皮膚處理困難、方法可重現(xiàn)性差等困難因素���。
美國(guó)食品藥品監(jiān)督管理局(FDA)已發(fā)布了多個(gè)外用半固體制劑仿制藥的指導(dǎo)原則����,若干仿制藥如處方中的原料藥和輔料的質(zhì)量(Q1)���、數(shù)量(Q2)及物理性能與微觀結(jié)構(gòu)(Q3)和參比制劑相同或相似�,完成IVRT后可不必再進(jìn)行生物等效性研究����。各國(guó)藥品監(jiān)管部門發(fā)布的有關(guān)外用半固體制劑研究技術(shù)的指導(dǎo)原則中均有關(guān)于IVRT的指導(dǎo)意見的描述,但其中一些試驗(yàn)條件與操作方法仍缺乏統(tǒng)一的標(biāo)準(zhǔn)化信息����,同時(shí)由于語言的差異,導(dǎo)致研究人員在裝置設(shè)計(jì)和實(shí)驗(yàn)方案上仍有較大的隨意性�。研發(fā)工作的合理與否,將直接影響結(jié)果的可靠性���,因此有必要對(duì)外用半固體制劑IVRT相關(guān)指南及關(guān)鍵技術(shù)參數(shù)進(jìn)行對(duì)比歸納與總結(jié)。
IVRT相關(guān)指導(dǎo)原則匯總
1. 國(guó)外指南匯總
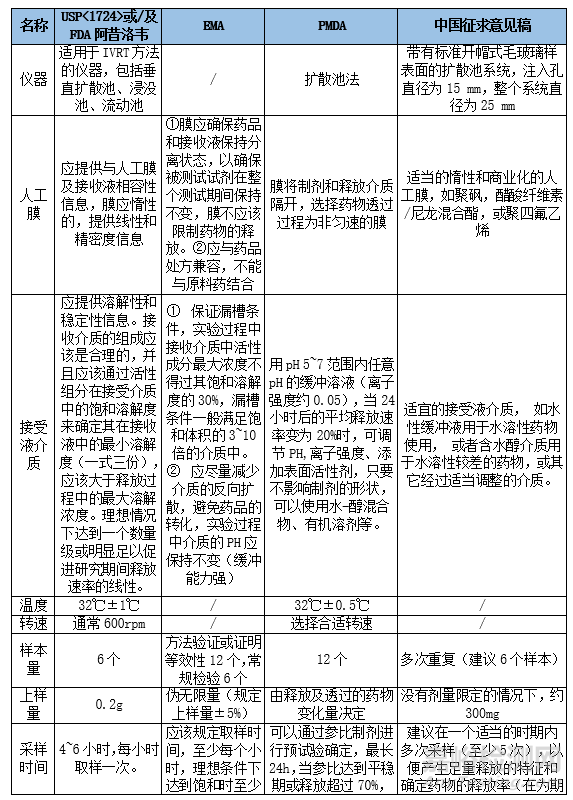
FDASUPAC-SS Nonsterile Semisolid Dosage Forms:Scale-Up and Postapproval Changes:Chemistry, Manufacturing, and Controls;In Vitro Release Testing and In Vivo Bioequivalence(1997年)(非無菌半固體制劑:擴(kuò)大規(guī)模和上市后變更:化學(xué)�、生產(chǎn)和控制的體外釋放和體外透皮生物等效原則)�,第一份關(guān)于IVRT的管理文件�,以支持SUPAC-SS通過IVRT證明變更前后批次之間的等效性。
PMDA: 局所皮膚適用製剤(半固形製剤及び貼付剤)の処方変更のための生物學(xué)的同等性試験ガイドラインについて(局部皮膚應(yīng)用制劑(半固體制劑和貼劑)制劑變化的生物等效性研究指南)����,應(yīng)用IVRT解釋釋放機(jī)制隨組成和工藝參數(shù)的變化情況。
USP總則<1724> Semisolid Drug Products - Performance Tests (半固體制劑的性能實(shí)驗(yàn))-提供半固體藥物產(chǎn)品性能測(cè)試方式�、原理和應(yīng)用于該測(cè)試的各種設(shè)備類型等信息。
FDA Draft Guidance on Acyclovir(2016)(阿昔洛韋指南草案)-為IVRT的方法開發(fā)���、方法驗(yàn)證���、新藥/仿制藥開發(fā)不同階段優(yōu)化工藝處方工藝的關(guān)鍵手段提供了指南。
EMA Draft guideline on quality and equivalence of topicalproducts(2018)(外用制劑質(zhì)量和等效性指南草案)���,與FDA相比���,提供更嚴(yán)格的參考標(biāo)準(zhǔn)。
USP<725> TOPICAL AND TRANSDERMAL DRUG PRODUCTS—PRODUCT PERFORMANCE TESTS(局部和透皮藥物產(chǎn)品-產(chǎn)品性能測(cè)定����,USP,2009年)����,提出了設(shè)備關(guān)鍵參數(shù)種類及可接受范圍�。
文獻(xiàn)�,Katrin I, Tiffnera, et .A comprehensive approach to qualify and validate the essential parameters of an in vitro release test (IVRT) method for acyclovir cream, 5%[J]In Pharmaceutics 535(2018)217-227,通過試驗(yàn)進(jìn)一步對(duì)設(shè)備關(guān)鍵參數(shù)種類及可接受范圍進(jìn)行評(píng)估�。
2. 國(guó)內(nèi)指南及權(quán)威文獻(xiàn)匯總
注冊(cè)分類的皮膚外用仿制藥的技術(shù)評(píng)價(jià)要求(征求意見稿,2018)�,附件中闡述了IVRT及IVPT具體實(shí)驗(yàn)方法。
《化學(xué)仿制藥透皮貼劑藥學(xué)研究技術(shù)指導(dǎo)原則(試行)》(2020年第52號(hào)):參考FDA/EMEA/PMDA設(shè)計(jì)和實(shí)施試驗(yàn)����。
CFDA文獻(xiàn)-郭滌亮等 《皮膚局部外用仿制藥質(zhì)量等同性評(píng)價(jià)的一般考慮》,參考國(guó)內(nèi)外相關(guān)技術(shù)指導(dǎo)原則及文獻(xiàn)����,針對(duì)皮膚局部外用仿制藥研發(fā)和評(píng)價(jià)面臨的復(fù)雜性與挑戰(zhàn),從與參比制劑質(zhì)量等同性考慮�,提出皮膚局部外用仿制藥應(yīng)與參比制劑保持最大程度的處方組成(Q1)、用量(Q2)和微觀結(jié)構(gòu)特性(Q3)等同的審評(píng)考慮����。
CFDA文獻(xiàn)-張星一等 《皮膚科藥物研發(fā)中的若干問題解析》,結(jié)合實(shí)際審評(píng)經(jīng)驗(yàn)�,對(duì)局部外用皮膚科藥物的科學(xué)處方開發(fā)、原輔料的來源和控制、雜質(zhì)分析的特點(diǎn)和技術(shù)要求����、透皮吸收試驗(yàn)的設(shè)計(jì)與評(píng)價(jià)�、穩(wěn)定性研究的特點(diǎn)等技術(shù)關(guān)鍵點(diǎn)進(jìn)行匯總和分析。
CFDA文獻(xiàn)-田潔 《皮膚外用半固體制劑體外透皮吸收對(duì)比試驗(yàn)常見問題分析》���,參考國(guó)內(nèi)外相關(guān)指導(dǎo)原則及文獻(xiàn)����, 結(jié)合皮膚外用半固體制劑仿制藥及相關(guān)變更申請(qǐng)的審評(píng)情況���, 闡述作者對(duì)自制樣品與原研產(chǎn)品進(jìn)行體外透皮吸收對(duì)比試驗(yàn)技術(shù)要求的認(rèn)識(shí)�,并分析審評(píng)資料常見問題���。
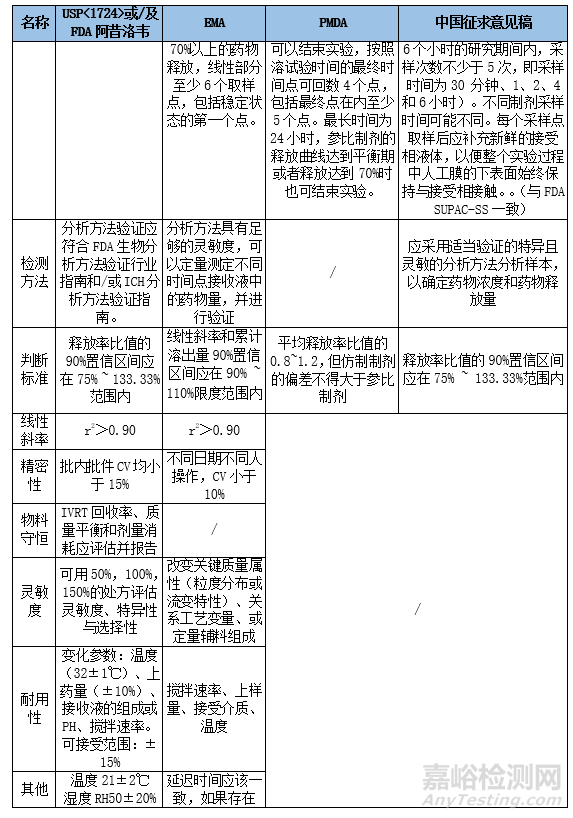
3. 指導(dǎo)原則摘要與關(guān)鍵指標(biāo)對(duì)比
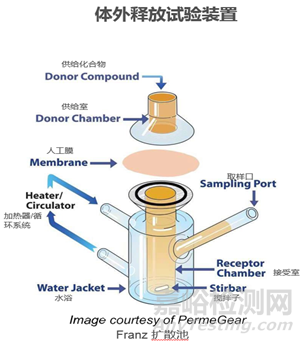
4. 常用檢測(cè)裝置示例(Franz擴(kuò)散池法)
Franz擴(kuò)散池裝置示意圖
原理:制劑處于釋放控制過程中時(shí)����,釋放與時(shí)間的平方根(t)呈比例���,因?yàn)獒尫艁碜运p范圍內(nèi)(Higuchi方程)
上樣:受試品置于擴(kuò)散池的開放供體腔人工膜的上側(cè)����,采樣液置于接受腔人工膜的另一側(cè)。
通過不同時(shí)間點(diǎn)取樣����,并多次重復(fù)(一般建議6或12個(gè)樣本)測(cè)定,得到制劑的釋放特征數(shù)據(jù)�。
以單位面積累積釋放的藥物量對(duì)時(shí)間平方根做圖,可得到制劑的釋放率����,計(jì)算自研制劑和參比制劑的中位體釋放率比值的90%置信區(qū)間。
5. 儀器及設(shè)備驗(yàn)證規(guī)程
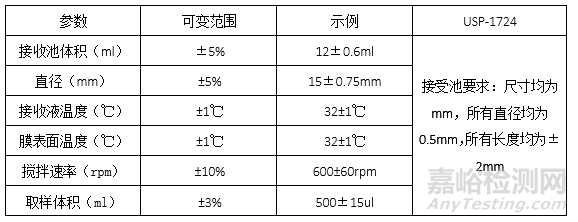
設(shè)備參數(shù)包括:接受室體積���、接收池直徑(決定接觸膜的大?���。?��、接受室液體溫度控制���、膜的溫度。不同儀器的工作原理和具體的測(cè)試程序不同���,可用制造商提供的有關(guān)安裝���、操作和性能鑒定的相關(guān)程序�,實(shí)驗(yàn)室鑒定擴(kuò)散池至少包括安裝膜孔徑的擴(kuò)散面積����、接收池體積���、膜表面溫度及攪拌速率(FDA阿昔洛韋)�。
性能參數(shù):按照USP<1724>章中規(guī)定的程序進(jìn)行���,通過使用氫化可的松乳膏進(jìn)行IVRT實(shí)驗(yàn)����,通過比較兩次IVRT運(yùn)行在兩個(gè)不同日期的氫化可的松的釋放速率����,評(píng)估兩次IVRT運(yùn)行的等效性,作為實(shí)驗(yàn)室鑒定的一部分���,運(yùn)行內(nèi)和運(yùn)行間的變化通過計(jì)算每次運(yùn)行和釋放的變化系數(shù)來確定���。
設(shè)備參數(shù)可接受范圍
實(shí)驗(yàn)室資質(zhì)可接受范圍
6. 結(jié)語
本文中的一些實(shí)驗(yàn)條件和評(píng)判標(biāo)準(zhǔn)為文獻(xiàn)值���,僅供參考。