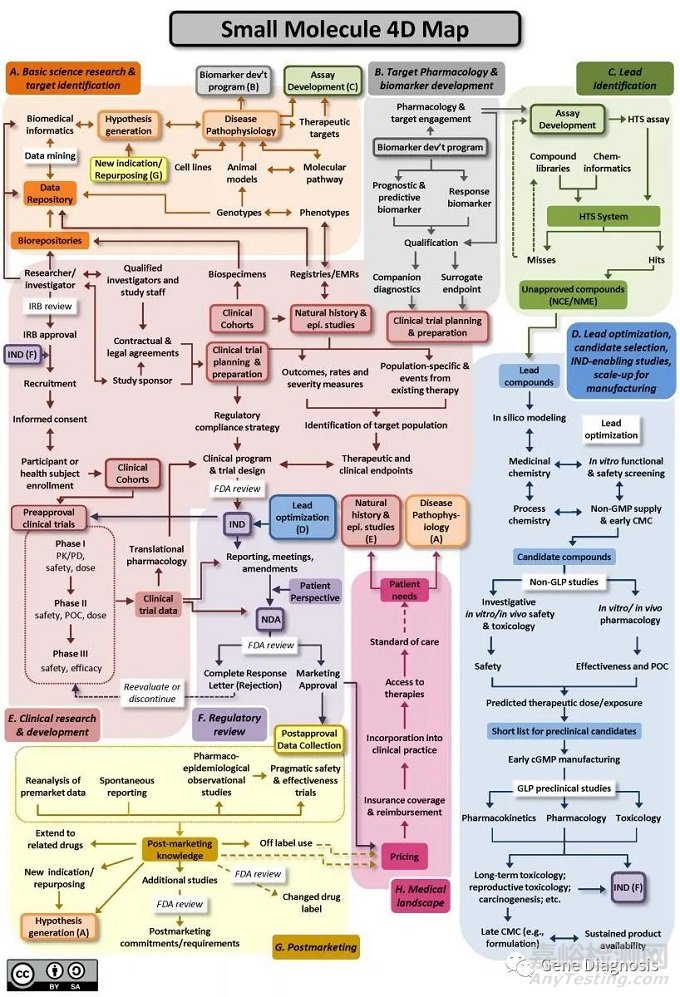
什么是創(chuàng)新藥?完成完整的研發(fā)周期���,具有自主知識產(chǎn)權(quán)的原研藥物���。創(chuàng)新藥,也稱為原研藥���,是一個相對于仿制藥的概念���,指的是從機(jī)理開始源頭研發(fā),具有自主知識產(chǎn)權(quán)���,具備完整充分的安全性有效性數(shù)據(jù)作為上市依據(jù)���,首次獲準(zhǔn)上市的藥物���。按照藥物研發(fā)的常規(guī)流程,一款藥物從確定靶點到最后審批上市的整個研發(fā)周期通常耗時十?dāng)?shù)年的時間���。專利保護(hù)期過后���,就會被大量仿制。現(xiàn)代藥物的概念除了我們傳統(tǒng)意義上的小分子化合物(如阿司匹林���、青蒿素)���,還包括多肽、蛋白質(zhì)和抗體���、(寡)核苷酸���、小分子—抗體復(fù)合物,還有疫苗���。下面以傳統(tǒng)的小分子化合物藥為例���,就新藥研發(fā)從無到有���,到最后上市的基本流程做一個概述���。
新藥的發(fā)現(xiàn)(DrugDiscovery)
1. 藥物作用靶點(target)以及生物標(biāo)記(biomarker)的選擇與確認(rèn)
藥物在臨床上失敗的主要原因有兩個:第一是它們不起作用���,第二是它們不安全。因此���,開發(fā)新藥最重要的步驟之一就是靶點的選擇和確認(rèn)���。
靶點是一個寬泛的術(shù)語,它可以適用于一系列生物體���,比如蛋白質(zhì)���、基因和RNA。一個好的靶點需要是有效的���、安全的���、臨床可行且有商業(yè)價值的���,最重要的是,要具有“可藥性(druggable)”���。所有的藥物分子都是通過與靶點結(jié)合來引起生物反應(yīng)的���,某些靶點可能更容易結(jié)合小分子藥物,例如G蛋白偶聯(lián)受體(GPCRs)���,而抗體靶點則擅長阻斷蛋白質(zhì)-蛋白質(zhì)的相互作用���。
尋找并確認(rèn)靶點的方法目前主要應(yīng)用的有兩種:一是利用基因重組技術(shù)建立轉(zhuǎn)基因動物模型,或進(jìn)行基因敲除來驗證;二是利用反義寡核苷酸技術(shù)(Antisense oligonucleotides���, ASOs)���,通過抑制翻譯特定蛋白質(zhì)的信使 RNA來驗證。
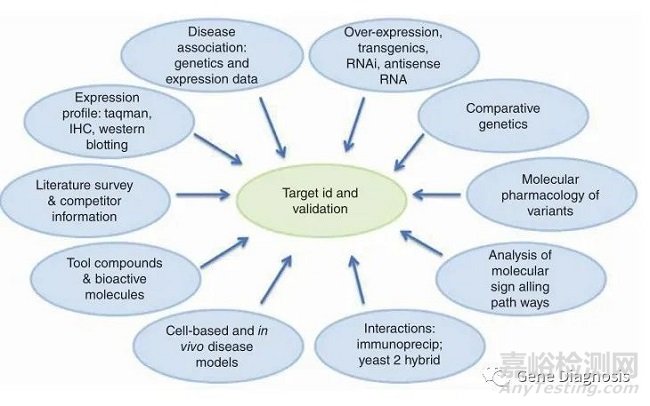
現(xiàn)代生物醫(yī)學(xué)的研究進(jìn)展���,以及人類基因圖譜的建立���,讓人類對疾病的機(jī)理了解更加準(zhǔn)確���,為新藥開發(fā)提供了明確的方向、具體的靶標(biāo)���。
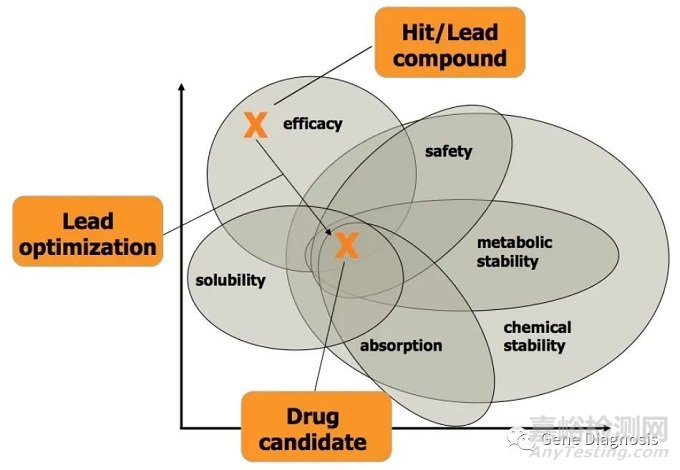
2. 先導(dǎo)化合物(leadcompound)的確定
一旦選定了藥物作用的靶標(biāo),藥物化學(xué)家(medicinalchemist)首先要找到一個對該靶標(biāo)有作用的化合物���。這個化合物可以來自天然產(chǎn)物(動物���、植物、海洋生物);也可以是根據(jù)靶標(biāo)的空間結(jié)構(gòu)���,計算機(jī)模擬設(shè)計���、合成的化合物;還可以根據(jù)文獻(xiàn)報道或以前其它項目的研究發(fā)現(xiàn)。比如���,某一類化合物具有作用于該靶標(biāo)的藥理活性或副反應(yīng)等等���。治療勃起障礙的藥物Viagra就是由其副作用開發(fā)而成。目前我們常用的方法是跟蹤國外研發(fā)機(jī)構(gòu)對某一靶標(biāo)的藥物開發(fā)���,以他們的化合物作為先導(dǎo)���,希望設(shè)計出更優(yōu)秀的化合物���。
3. 構(gòu)效關(guān)系的研究與活性化合物的篩選
圍繞先導(dǎo)化合物,設(shè)計并合成大量新化合物���,通過對所合成化合物活性數(shù)據(jù)與化合物結(jié)構(gòu)的構(gòu)效關(guān)系分析���,進(jìn)一步有效的指導(dǎo)后續(xù)的化合物結(jié)構(gòu)優(yōu)化和修飾,以期得到活性更好的化合物���。這一階段要對化合物進(jìn)行更詳細(xì)的ADME特性分析���、細(xì)胞毒性測試等,還必須考慮該化合物大規(guī)模合成的可行性���,以及其GMP制造工藝���。
4. 候選藥物(candidate)的選定
通過構(gòu)效關(guān)系研究,幾輪優(yōu)化所有篩選出來的滿足基本生物活性的最優(yōu)化合物,一般就選作為候選藥物���,進(jìn)入開發(fā)���。此時,從事新藥發(fā)現(xiàn)的藥物化學(xué)家工作暫告結(jié)束���。
臨床前研究
一旦確定了候選藥物���,新藥研發(fā)就進(jìn)入開發(fā)階段(development)���,制藥公司就會向藥監(jiān)部門提交“實驗用新藥”(investigational new drug, IND )申請���,進(jìn)行臨床前安全性、藥代動力學(xué)���、藥效學(xué)和藥劑學(xué)等相關(guān)研究���,以觀察化合物針對目標(biāo)疾病的生物活性,同時對化合物進(jìn)行安全性評估���,以支持臨床試驗的啟動���。不同國家和地區(qū)啟動臨床試驗所需的具體臨床前研究存在一些差異���,目前國內(nèi)主要包括以下幾個方面:
1. 化學(xué)、制造和控制(Chemical Manufacture and Control, CMC)
新藥開發(fā)工作的第一步是原料藥合成工藝研發(fā)(Process R&D)���,這是一個不斷改進(jìn)���、完善的過程。第一批提供的原料藥主要用于毒理研究(100—1000g)���,要求是越快越好���,成本不是主要考慮因素。因此���,只要藥化路線能夠?qū)崿F(xiàn)毒理批合成���,工藝研發(fā)部門就會采用。但隨著項目的推進(jìn)���,工藝部門會根據(jù)需要設(shè)計全新合成路線���,開發(fā)合理生產(chǎn)工藝來滿足從I—III期臨床用藥與商業(yè)化的需求;同理���,制劑部門首先也會以最簡單的形式給藥,完成毒理研究���,然后不斷完成處方工藝研究���,開發(fā)出商業(yè)化的制劑工藝。
2. 藥代動力學(xué)(Pharmacokinetics, PK)
了解藥物在動物體內(nèi)的吸收���、分布、代謝���、排泄(ADME)���,這些數(shù)據(jù)可以指導(dǎo)臨床研究以何種形式給藥(口服、吸入���、針劑)���,給藥頻率與劑量���。
3. 安全性藥理(Safety Pharmacology)
證明該化合物針對特定目標(biāo)疾病具有生物活性,同時評估藥物對療效以外的作用���,比如可能的副作用���,尤其是對心血管、呼吸���、中樞神經(jīng)系統(tǒng)的影響���。
4. 毒理研究(Toxicology)
毒理研究種類較多,包括急性毒性���、亞急性毒性���、慢性毒性、生殖毒性���、致癌性���、致突變性等���。為了加速新藥能及早驗證是否有療效,尤其是對一些抗癌藥���,有些耗時費錢的毒理實驗(如致癌性���、生殖毒性)是可容許在臨床試驗階段再進(jìn)行。
5. 制劑開發(fā)
制劑開發(fā)是藥物研發(fā)的一個重要環(huán)節(jié)���。早期制劑研究并不需要完整的處方開發(fā)���,所有研究圍繞毒理學(xué)研究和一期臨床時方便給藥即可,目的是將候選藥物盡快推向臨床���。隨著項目推進(jìn),給藥方式和處方研究就越來越全面���。比如���,有的藥胃腸吸收很差���,就需要開發(fā)為注射劑。有的藥在胃酸里面會失去活性���,就需要開發(fā)為腸溶制劑���。有的化合物溶解性不好,也可以通過制劑來部分解決這個問題���。
前面這些內(nèi)容都統(tǒng)稱為臨床前研究���,是藥物開發(fā)的第一階段。臨床前各個實驗的步驟可不是嚴(yán)格按照上述這個順序展開���,而是一個相互包容���、相互協(xié)調(diào)的關(guān)系。因此���,項目推進(jìn)是否順利���,就看各專業(yè)間的協(xié)調(diào)與配合是否密切了���。
臨床研究
當(dāng)一個化合物通過了臨床前試驗后,需要向藥監(jiān)部門提交新藥臨床研究申請(IND)���,以便可以將該化合物應(yīng)用于人體試驗���。新藥臨床研究申請需要提供先前試驗的材料;以及計劃將在什么地方,由誰以及如何進(jìn)行臨床試驗的說明;新化合物的結(jié)構(gòu);給藥方式;動物試驗中發(fā)現(xiàn)的所有毒性情況;該化合物的制造生產(chǎn)情況���。所有臨床方案必須經(jīng)過倫理審評委員會(Institutional Review Board���,IRB)的審查和通過,每年還必須向FDA和IRB 匯報一次臨床試驗的進(jìn)程和結(jié)果���。在美國���,如果在提交申請后30天內(nèi)FDA沒有駁回申請,那么該新藥臨床研究申請即被視為有效���,可以進(jìn)行人體試驗���。在中國則需要獲得NMPA正式批準(zhǔn),方可進(jìn)入臨床���。
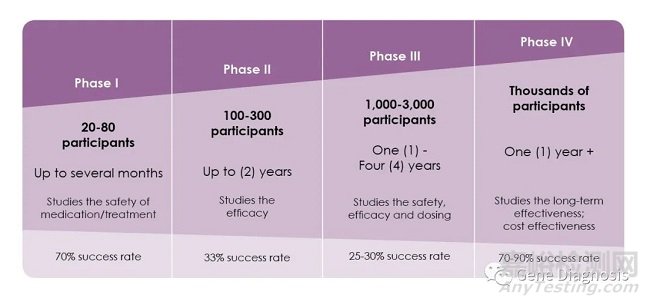
4. Ⅰ期臨床試驗
在新藥開發(fā)過程中���,將新藥第一次用于人體以研究新藥的性質(zhì)的試驗,稱之為Ⅰ期臨床試驗���。這一階段的臨床試驗一般需要征集20-100名正常和健康的志愿者(對腫瘤藥物而言通常為腫瘤病人���,但人數(shù)更少),在嚴(yán)格控制的條件下���,給不同劑量(隨著對新藥的安全性了解的增加���,給藥的劑量也逐漸提高,并可以多劑量給藥)的藥物試驗于健康志愿者���,住院以進(jìn)行24小時的密切監(jiān)護(hù)���,仔細(xì)監(jiān)測藥物的血液濃度、排泄性質(zhì)和任何有益反應(yīng)或不良作用,以評價藥物在人體內(nèi)的性質(zhì)���。同時也要通過這一階段的臨床試驗獲得其吸收���、分布、代謝和排泄以及藥效持續(xù)時間的數(shù)據(jù)和資料;以及藥物最高和最低劑量的信息���,以便確定將來在病人身上使用的合適劑量���。可見���,Ⅰ期臨床試驗是初步的臨床藥理學(xué)及人體安全性評價試驗���,目的在于觀測人體對新藥的耐受程度和藥代動力學(xué),為制定給藥方案和安全劑量提供依據(jù)���。
5. Ⅱ期臨床試驗
為了證實藥品的治療作用的���,就必須在真正的病人身上進(jìn)行臨床研究,即Ⅱ期臨床試驗���。Ⅱ期的臨床試驗通常需要征集100-500名相關(guān)病人進(jìn)行試驗���。其主要目的是獲得藥物治療有效性資料。
將試驗新藥給一定數(shù)量的病人志愿者���,評價藥物的藥代動力學(xué)和排泄情況���。這是因為藥物在患病狀態(tài)的人體內(nèi)的作用方式與健康志愿者是不同的,對那些影響腸���、胃���、肝、和腎的藥物尤其如此���。Ⅱ期臨床試驗一般通過隨機(jī)盲法對照試驗(根據(jù)具體目的也可以采取其他設(shè)計形式)���,對新藥的有效性和安全性作出初步評價,并為設(shè)計Ⅲ期臨床試驗和確定給藥劑量方案提供依據(jù)���。
6. Ⅲ期臨床試驗
當(dāng)一個新藥推進(jìn)到三期臨床���,原料藥和制劑工藝研究也推進(jìn)到了相應(yīng)的階段���。三期臨床用藥以商業(yè)化生產(chǎn)工藝提供臨床用藥。一般來講���,商業(yè)化生產(chǎn)的原料藥生產(chǎn)工藝應(yīng)該考慮以下因素:產(chǎn)品質(zhì)量���,生產(chǎn)安全性,生產(chǎn)成本���,環(huán)境影響���,生產(chǎn)的穩(wěn)定性和可持續(xù)性。
Ⅲ期的臨床試驗通常需 1000-5000名臨床和住院病人���,其目標(biāo)是評估藥物在長期治療期間(6個月到1年以上)的安全性���。Ⅲ期臨床可以說是治療作用的確證階段。在大多數(shù)情況下���,必須完成至少兩個設(shè)計良好的隨機(jī)Ⅲ期臨床試驗���,才能向FDA提交新藥申請���。這一階段會進(jìn)一步獲得該藥物的有效性資料和鑒定副作用,以及與其他藥物的相互作用關(guān)系���。該階段試驗一般將對試驗藥物和安慰劑(不含活性物質(zhì))或已上市藥品的有關(guān)參數(shù)進(jìn)行對照和雙盲法試驗(醫(yī)生和病人都不知道自己吃的是新藥、老藥或安慰劑)���,在更大范圍的病人志愿者身上���,進(jìn)行擴(kuò)大的多中心臨床試驗。最后���,根據(jù)嚴(yán)格統(tǒng)計學(xué)數(shù)據(jù)分析���,進(jìn)一步評價藥物的有效性和耐受性(或安全性),決定新藥是否優(yōu)于(superior)或不差于(notinferior)市場現(xiàn)有的“老藥”���。
在某些情況下���,Ⅱ期臨床和Ⅲ期臨床會合并為一個試驗���。這些聯(lián)合試驗分幾個階段進(jìn)行:在早期階段,確定該化合物是否有足夠的研究前景���;在后期階段���,將研究藥物與對照組進(jìn)行比較。在適當(dāng)條件下采用Ⅱ/Ⅲ期綜合設(shè)計具有樣本量小���、節(jié)省時間和資源���、研究持續(xù)時間短等優(yōu)點。
在Ⅰ期臨床停止開發(fā)的原因通常是由于缺乏具體意義���,而在Ⅱ或Ⅲ期終止的原因通常與缺乏療效有關(guān)���。
7. 新藥申請(NDA)
完成所有三個階段的臨床試驗并分析所有資料及數(shù)據(jù),藥物的安全性和有效性得到了證明���,新藥持有人則可以向藥監(jiān)部門提交新藥申請���。新藥申請需要提供所有收集到的科學(xué)資料���。通常一份新藥申請材料可多達(dá)100000 頁,甚至更多!按照法規(guī)���,F(xiàn)DA應(yīng)在6個月內(nèi)審評完新藥申請���。但是由于大部分申請材料過多,而且有許多不規(guī)范���,因此往往不能在這么短的時間內(nèi)完成���。中國藥監(jiān)局也在努力改進(jìn)工作���,期望縮短審批時間���。
8. 批準(zhǔn)上市
新藥申請一旦獲得藥監(jiān)部門批準(zhǔn),該新藥即可正式上市銷售���,供醫(yī)生和病人選擇���。但是新藥持有人還必須定期向藥監(jiān)部門呈交有關(guān)資料���,包括該藥物的副作用情況和質(zhì)量管理記錄。對于有些藥物藥監(jiān)部門還會要求做第四期臨床試驗���,以觀測其長期副作用情況���。
如果能夠走到這一步,那么暫時可以說是大功告成了���。從最開始的備選化合物走到這一步的藥物寥寥無幾���。但是批準(zhǔn)上市了并不代表這個藥物就高枕無憂了。因為還有后面一步���。
9. IV期臨床研究(藥物上市后監(jiān)測)
藥物在大范圍人群應(yīng)用后���,需要對其療效和不良反應(yīng)繼續(xù)進(jìn)行監(jiān)測。藥監(jiān)部門要求根據(jù)這一階段的監(jiān)測結(jié)果來修訂藥物使用說明書���。這一階段研究還會涉及到的一些內(nèi)容有���,藥物配伍使用的研究���,藥物使用禁忌。如果批準(zhǔn)上市的藥物在這一階段被發(fā)現(xiàn)之前研究中沒有發(fā)現(xiàn)的嚴(yán)重不良反應(yīng)���,比如顯著增加服藥人群心血管疾病發(fā)生率之類的���,藥物還會被監(jiān)管部門強(qiáng)制要求加注警告說明,甚至下架���。如Merck的抗關(guān)節(jié)炎藥物Vioxx 因增加心血管疾病風(fēng)險于2004 年“主動”撤離市場���。總之���,新藥研發(fā)是一個高風(fēng)險,高投入���,當(dāng)然也是高回報的行業(yè)���。研發(fā)周期長,涉及多學(xué)科���、多專業(yè)的密切配合與協(xié)調(diào)���。