藥品在生產(chǎn)合成和貯運過程中可能引入對人體有害的雜質(zhì)�����,其中一部分具有遺傳毒性風(fēng)險的稱為遺傳毒性雜質(zhì)�����。后者在很低濃度下即可誘導(dǎo)基因突變和染色體損傷�����,甚至導(dǎo)致癌癥并危及生命�����。
遺傳毒性雜質(zhì)本質(zhì)上是藥物生產(chǎn)或保存過程中難以避免�����,甚至不可避免的產(chǎn)物�����。制藥企業(yè)在藥物研發(fā)過程中�����,通常需花費大量時間和財力來驗證合成過程中不存在有遺傳毒性風(fēng)險的產(chǎn)物�����。遺傳毒性雜質(zhì)的出現(xiàn)也對監(jiān)管機構(gòu)提出了新的要求和挑戰(zhàn)�����。
然而�����,遺傳毒性雜質(zhì)的監(jiān)管起步較晚�����,自 2000年以后才陸續(xù)受到各國的重視�����。
近年來�����,歐盟、美國藥品監(jiān)管機構(gòu)相繼發(fā)布了遺傳毒性和致癌性雜質(zhì)的指導(dǎo)原則�����。
如EMA人用藥委員會安全工作組(Committees for Human Medicinal Products�����, CHMP)于2004年發(fā)布《遺傳毒性雜質(zhì)限度指南》并首次提出毒理學(xué)相關(guān)閾值(Threshold of Toxicological Concern�����,TTC)限度的概念�����;
美國食品藥品監(jiān)督管理局(Food and Drug Administration�����, FDA)于2006年發(fā)布《原料藥和成品藥中遺傳毒性和致癌性雜質(zhì)推薦方法》并提出使用決策樹 (Decision Tree)法對雜質(zhì)風(fēng)險進行評估�����;
人用藥品注冊技術(shù)要求國際協(xié)調(diào)會(International Council for Harmonization of Technical Requirement for Pharmaceuticals for Human Use�����,ICH)在2017 年發(fā)布的ICH M7指導(dǎo)原則中為遺傳毒性雜質(zhì)的確認�����、研究和控制方法提供了指導(dǎo)性的建議和技術(shù)要求�����。
ICH M7的頒布具有里程碑式的意義�����,它將取代EMA遺傳毒性雜質(zhì)限度指南和美國FDA遺傳毒性雜質(zhì)指南草案�����,成為今后國際上廣泛通行的遺傳毒性雜質(zhì)控制指導(dǎo)性文件�����。
原國家食品藥品監(jiān)督管理局于2017年成為ICH正式成員�����,我國相關(guān)標準和指導(dǎo)原則已與國際接軌。
《中華人民共和國藥典》 (以下簡稱《中國藥典》)2015年版四部中已收載了《藥品雜質(zhì)分析指導(dǎo)原則》�����,國家藥典委員會于 2019年及時發(fā)布了《遺傳毒性雜質(zhì)控制指導(dǎo)原則》 (征求意見稿)�����,當前�����,國家藥品監(jiān)督管理局正在推進ICH M7在我國的落地與轉(zhuǎn)化�����。
一系列指南性文件的出臺�����,彌補了我國與先進國家和組織之間的貿(mào)易與技術(shù)壁壘�����。
2 遺傳毒性雜質(zhì)控制策略
致癌性風(fēng)險在藥物研發(fā)階段即受到高度重視�����,通常會在研發(fā)早期開展基因突變遺傳毒性標準組合試驗對其致癌風(fēng)險進行評估�����,而有潛在風(fēng)險的化合物則及早停止研發(fā)�����。
雜質(zhì)因其特性有可能無法從藥物中去除�����,故根據(jù)人體暴露情況設(shè)置定量限成為可行的監(jiān)管方略�����。
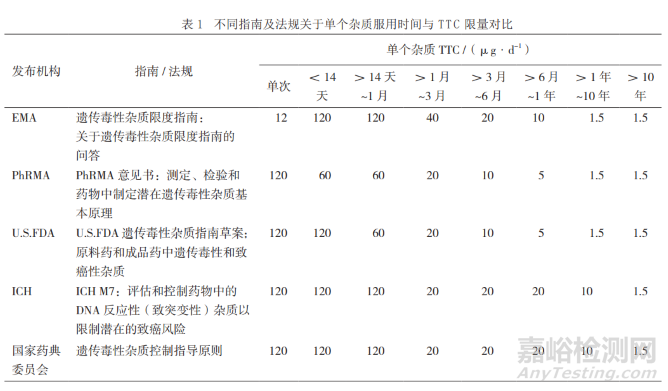
EMA于2006年首先在遺傳毒性雜質(zhì)監(jiān)管中引入化學(xué)物質(zhì)慢性毒性研究的毒理學(xué)相關(guān)閾值概念�����,在700余種致癌物分析基礎(chǔ)上,提出以1.5μg·d-1為有潛在遺傳毒性風(fēng)險的化合物的TTC�����。該暴露水平下�����,人體終生服用該物質(zhì)的患癌可能性為十萬分之一�����。
美國藥品研究和制造商協(xié)會(The Pharmaceutical Research and Manufacturers of America�����,PhRMA)進一步對建立暴露時間與 TTC之間的關(guān)聯(lián),建立“分期TTC”�����。
此外, PhRMA 率先提出了雜質(zhì)遺傳毒性五分類的概念�����,并以構(gòu)效關(guān)系(Structure-activity Relationship�����, SAR)為分類依據(jù)�����,根據(jù)警示結(jié)構(gòu)預(yù)測其誘導(dǎo)人體腫瘤的風(fēng)險�����。從而將化合物結(jié)構(gòu)作為堿基插入導(dǎo)致的突變和腫瘤形成的重要決策基礎(chǔ)�����,而評估堿基突變風(fēng)險的試驗方法也在分類中有重要權(quán)重。
“分期TTC”和五分類決策樹的概念對全球藥品雜質(zhì)監(jiān)管影響深遠�����,美國FDA的《遺傳毒性雜質(zhì)指南草案:原料藥和成品藥中遺傳毒性和致癌性雜質(zhì)》�����、 ICH M7及我國的《遺傳毒性雜質(zhì)控制指導(dǎo)原則》 相繼沿襲�����,是當前雜質(zhì)監(jiān)管領(lǐng)域的主要思路。
值得注意的是�����,“分期TCC”的具體限量在不同指南及法規(guī)中有所不同�����,如表1所示�����,我國則以ICH M7為制定監(jiān)管標準的重要依據(jù)。
本文以ICH M7為藍本就雜質(zhì)監(jiān)管要求作簡要介紹�����。
ICH M7主要適用于DNA 反應(yīng)活性雜質(zhì)�����,即在含量很低時便存在致堿基突變及誘發(fā)人體腫瘤的風(fēng)險。遺傳毒性雜質(zhì)毒性的確認及定量構(gòu)效關(guān)系(Quantitative Structure-activity Relationship�����, QSAR)數(shù)據(jù)庫的構(gòu)建均以毒性研究數(shù)據(jù)為基礎(chǔ)�����。
根據(jù)致突變和致癌風(fēng)險危害程度,ICH M7將所有雜質(zhì)歸為5類并提出相關(guān)控制策略�����。
1類雜質(zhì):已知具有致突變性的致癌物�����。
對于該類雜質(zhì)�����,首先考慮去除雜質(zhì),如果無法去除�����,則應(yīng)建立基于未觀察到作用水平(No Observed Effect Level�����, NOEL)致癌性數(shù)據(jù)的限度數(shù)值�����。
2類雜質(zhì):致癌性未知的已知致突變物。
如存在閾值相關(guān)機制�����, 以每日允許暴露量(Permitted Daily Exposure�����, PDE)求限度值�����;如無閾值相關(guān)機制的證據(jù),根據(jù)TTC確立限度�����。
3類雜質(zhì):含警示結(jié)構(gòu)�����、與原料藥結(jié)構(gòu)無關(guān)且無致突變性數(shù)據(jù)的物質(zhì)�����。
根據(jù)TTC確定限度值�����,或根據(jù)致突變性試驗評價結(jié)果歸為2類 雜質(zhì)或5類雜質(zhì)并作相應(yīng)控制�����。
4類雜質(zhì):含警示結(jié)構(gòu)、與原料藥或原料藥相關(guān)物質(zhì)的警示結(jié)構(gòu)相同�����,且經(jīng)測試認為無致突變性的物質(zhì)�����;按5類雜質(zhì) (普通雜質(zhì))控制�����。
5類雜質(zhì):無警示結(jié)構(gòu)�����,或有充分的數(shù)據(jù)證明警示結(jié)構(gòu)無致突變性或致癌性的物質(zhì)。
按普通雜質(zhì)控制�����。
判斷某個雜質(zhì)是否屬于遺傳毒性雜質(zhì)時�����,首先應(yīng)收集其相關(guān)細菌回復(fù)突變試驗�����、動物和人體致癌性數(shù)據(jù)�����。部分公開致癌性數(shù)據(jù)庫如表2所示�����。

2.1 已有致癌性或致突變性試驗數(shù)據(jù)的雜質(zhì)控制
雜質(zhì)具有已知致突變性或致癌性數(shù)據(jù)歸為1類致癌物,根據(jù)半數(shù)致癌劑量(MedianToxic Dose�����, TD50)線性外推法對其進行控制�����,即以誘導(dǎo)50%腫瘤發(fā)生率的劑量的五萬分之一為攝入量�����,可將腫瘤的發(fā)生風(fēng)險控制于十萬分之一�����。
致癌性強度數(shù)據(jù)庫 (Carcinogenicity Potency Database�����,CPDB)中已明確列出1547種致癌物的TD50值供公開查詢�����。在測定 TD50時�����,應(yīng)以單一動物種屬和單一性別特定器官的最低TD50為準�����。
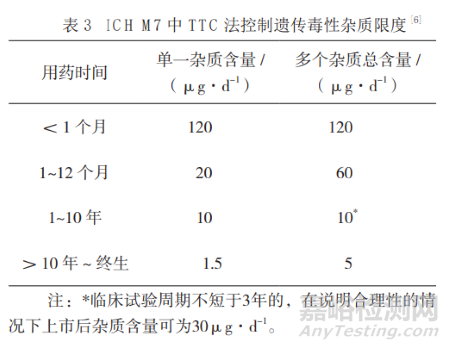
無致癌性試驗數(shù)據(jù)的物質(zhì)�����,歸為第2類或第3類的雜質(zhì)�����,服用時間超過10年的藥物�����,單 一雜質(zhì)的攝入量為1.5 µg·d-1�����,可以應(yīng)用TTC作為大多數(shù)毒性化合物作為可接受攝入量的默認值�����。
如原料藥質(zhì)量標準中存在兩個2類或3類雜質(zhì),應(yīng)制定各自限度值�����;如果含3種或更多的2類或3類雜質(zhì),可按多個雜質(zhì)的總可被接受攝入量(服用時間超過10年的藥物雜質(zhì)5 µg·d-1)計算(如表2)。
值得注意的是�����,1類雜質(zhì)和制劑中形成的降解產(chǎn)物應(yīng)單獨控制,不計入2類和3類雜質(zhì)的總限度值�����。黃曲霉素類物質(zhì)�����、N-亞硝基化合物和偶氮類等強致突變性化合物屬于關(guān)注隊列(Cohort of Concern�����, COC)�����,TTC法對該類化合物不適用�����,其TD50應(yīng)低于1.25 mg·(kg·d)-1�����。
某些DNA反應(yīng)性化合物可能受到某種代謝或調(diào)控通路影響�����,其實際閾值或攝入量與致癌性呈非線性關(guān)系,如乙基甲烷磺酸鹽�����、過氧化氫、苯胺類化合物等�����,可使用NOEL或 PDE[計算公式:(NOEL×體質(zhì)量)/(動物與人用劑量差異系數(shù)×不同人體之間差異×研究時間系數(shù) ×嚴重情況系數(shù)×觀察到反應(yīng)的最低劑量)]確定限量值(如表3所示)�����。
2.2 無已知致突變性及致癌性試驗數(shù)據(jù)的雜質(zhì)控制
絕大多數(shù)雜質(zhì)缺乏充分的遺傳毒性和致癌性研究數(shù)據(jù)�����,往往難以歸類�����。
遺傳毒性的“警示結(jié)構(gòu)”指雜質(zhì)中的某些特殊基團或亞單位可與遺傳物質(zhì)發(fā)生化學(xué)反應(yīng),從而導(dǎo)致基因突變或染色體重排/斷裂�����,具有潛在致癌風(fēng)險�����。而產(chǎn)生遺傳毒性致癌性的化合物�����,從作用機制上分析均具有DNA反應(yīng)活性�����,通過與遺傳物質(zhì)發(fā)生化學(xué)鍵合引起遺傳信息改變產(chǎn)生致癌性�����,而基因突變往往是遺傳毒性致癌性作用的起始環(huán)節(jié)�����。
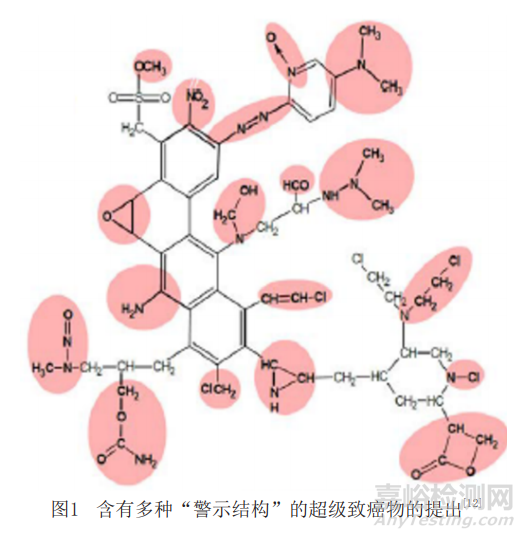
Ashby和Benigni等根據(jù)高 DNA反應(yīng)活性可以認為是堿基突變及腫瘤形成最初階段的原理�����,歸納并提出了18種化學(xué)結(jié)構(gòu)的“警示結(jié)構(gòu)(Alert Structure)”模型�����,包括酰鹵�����、烷基或苯基磺酸酯、烷基或苯基磷酸酯�����、N-羥甲基衍生物、單鹵代烯烴�����、硫芥�����、氮芥等�����,如圖1所示�����。
隨后�����,在國際上提出采用 “警示結(jié)構(gòu)”作為區(qū)分普通雜質(zhì)和遺傳毒性雜質(zhì)的重要依據(jù)的概念�����。這一概念已廣泛應(yīng)用于遺傳毒性和致癌性預(yù)測軟件�����,也成為遺傳毒性警示結(jié)構(gòu)以及QSAR模型的基礎(chǔ)�����。
對于存在“警示結(jié)構(gòu)”的雜質(zhì)進行QSAR預(yù)測和體內(nèi)外相關(guān)研究�����,或?qū)⑵浜靠刂圃谝欢ǚ秶畠?nèi)�����。當前已有多種計算機軟件可對化合物的遺傳毒性進行預(yù)測�����,如基于文獻報道和專家知識的預(yù)測軟件Toxtree(Joint Research Centre of European Chemical Bureau)�����、Derek Nexus(Lhasa Limited)和基于統(tǒng)計學(xué)的預(yù)測軟件如Sarah Nexus(Lhasa Limited)和 CASE Ultra(MultiCase Inc.)等�����。
這些預(yù)測決策樹或根據(jù)既往Ames試驗或微核試驗等遺傳毒性試驗數(shù)據(jù)�����,或根據(jù)警示結(jié)構(gòu)的遺傳毒性陽性可能性來生成判斷結(jié)果�����。
然而�����,現(xiàn)有數(shù)據(jù)庫在預(yù)測效力上存在一定局限性。新藥研發(fā)催生大量新型有效藥物成分(Act ive Pharmaceutical Ingredient�����,API)和新型合成路線的誕生,現(xiàn)有的數(shù)據(jù)庫信息與浩如煙海的雜質(zhì)種類相比乃九牛之一毛�����。
一項針對十余家跨國藥企百余種合成路線產(chǎn)生的雜質(zhì)的研究中共發(fā)現(xiàn)600多種警示結(jié)構(gòu),其中烷化劑�����、芳香胺、酰胺類及芳香硝基衍生物類警示結(jié)構(gòu)占總警示結(jié)構(gòu)的61.3%�����。
值得關(guān)注的是含酰氯衍生物、烷基醛及硼酸類警示 結(jié)構(gòu)的化合物在該研究中占總警示結(jié)構(gòu)的5.8%�����、 4.7%和3.5%,但在已知致癌信息數(shù)據(jù)庫中僅占 0.5%�����、0%和0%�����。故上述警示結(jié)構(gòu)的化合物的致癌性有必要進行試驗研究�����。
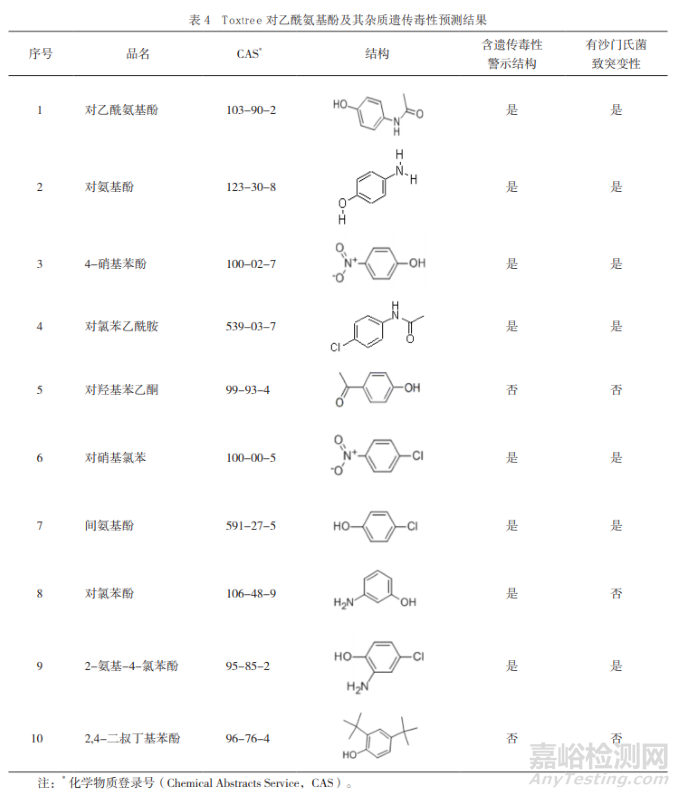
此外�����,含有“警示結(jié)構(gòu)” 的化合物并非一定具有遺傳毒性。以常用解熱鎮(zhèn)痛藥對乙酰氨基酚(4-Acetamidophenol/N-acetylp-aminophenol�����,APAP)為例,2011年國家藥品抽檢的APAP藥品中含有多種苯酚類雜質(zhì)�����,基于決策樹的毒性預(yù)測平臺Toxtree預(yù)測其中絕大多數(shù)含有遺傳毒性致癌性警示結(jié)構(gòu)�����、多數(shù)含Ames致突變性試驗陽性警示結(jié)構(gòu)和體內(nèi)微核試驗陽性警示結(jié)構(gòu)�����, 如表4所示�����。
然而�����,實際臨床及動物長期研究數(shù)據(jù)并不提示APAP存在致癌性�����。再以ICH M7推薦使用 的毒理學(xué)數(shù)據(jù)庫Derek Nexus為例�����,其對截至2005年已有206種化合物的預(yù)測結(jié)果的一致性為86%�����,靈敏性為73%�����;而對2005-2011年間新增的化合物的預(yù)測度的一致性為89%�����,靈敏度降低至50%。
比如�����,Derek Nexus對4-氯乙?����;阴1桨返闹峦?變性預(yù)測結(jié)果為陰性�����,然而在多個實驗室共同開展 Ames試驗聯(lián)合驗證工作中均得到明確陽性結(jié)果。
預(yù)測靈敏度的降低提示存在致突變風(fēng)險的化合物無法通過軟件預(yù)測的方法獲知�����,監(jiān)管工作中僅憑借構(gòu)效分析軟件預(yù)測結(jié)果仍然存在風(fēng)險。此外�����,某些創(chuàng)新藥的化學(xué)結(jié)構(gòu)可能難以通過數(shù)據(jù)庫進行預(yù)測。
無論基于經(jīng)驗或統(tǒng)計學(xué)的數(shù)據(jù)庫的構(gòu)建�����,其預(yù)測結(jié)果的準確度都極大程度上依賴于真實的試驗數(shù)據(jù)�����?����?梢婇_展試驗研究對雜質(zhì)毒性評價具有重要價值。
3 藥物雜質(zhì)致突變性評價方法
由遺傳毒性發(fā)生的機理可知�����,基因突變是腫瘤發(fā)生的分子基礎(chǔ)。
以堿基突變?yōu)樵u價終點的Ames 試驗和體內(nèi)Pig-a基因突變試驗,均作為雜質(zhì)遺傳毒性風(fēng)險評價的首選試驗方法�����,其試驗數(shù)據(jù)已獲得FDA認可�����。評價受試物與DNA作用風(fēng)險的彗星試驗結(jié)果對雜質(zhì)遺傳毒性評價也有一定參考�����。
雜質(zhì)毒性評價的另一大難題�����,是可合成或獲取的雜質(zhì)量難以滿足試驗需要�����,而ICH M7要求盡量使用雜質(zhì)純品開展評價;此外�����,單一化合物可能有10~20余種雜質(zhì)。
受試物需求量少�����、試驗周期短的快速評價方法才能滿足大量雜質(zhì)遺傳毒性評價的迫切需求�����,故有必要優(yōu)化和改進傳統(tǒng)遺傳毒性評價方法。
3.1 Ames試驗
細菌回復(fù)突變試驗( B a c t e r i a l R e v e r s e Mutation Test�����,Ames)�����,1970年由Bruce. N. Ames 使用組氨酸營養(yǎng)缺陷型鼠傷寒沙門氏菌株 (S.Typhimurium)建立�����,故命名為Ames試驗�����。
該試驗利用缺乏合成組氨酸能力的細菌在可誘導(dǎo)堿基突變的化合物的作用下可通過發(fā)生回復(fù)突變,從而自行合成組氨酸來形成大量肉眼可見的菌落的原理�����,通過菌落計數(shù)來評價受試物的堿基突變能力。
該方法是當前所有遺傳毒性評價方法中對致癌物預(yù)測度最高的試驗�����,Ames試驗對大鼠致癌物和恒河猴致癌物的檢出率分別為69.0%和87.5%,也是化合物QSAR構(gòu)效關(guān)系建立的遺傳毒性篩選數(shù)據(jù)庫的重要基礎(chǔ)�����。
隨著分子生物技術(shù)發(fā)展的飛躍�����,Ames作為一項經(jīng)典的致突變性篩選方法經(jīng)歷了一系列改良�����, 比如微孔板、液態(tài)培養(yǎng)法或引入含熒光報告基因等�����。
ICH M7認可基于標準平皿的Ames試驗數(shù)據(jù)。
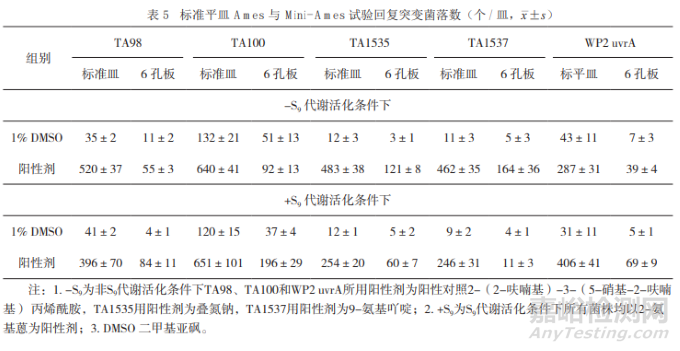
但某些雜質(zhì)合成困難�����,基于微孔板的Ames 試驗,如Mini-Ames(6孔板)或Micro-Ames(24孔 板)在不改動傳統(tǒng)Ames 試驗原理的條件下可減少雜質(zhì)的用量�����,極具應(yīng)用潛力�����。
OECD正在對Ames試驗指導(dǎo)原則進行修訂,并于2018年在國際范圍內(nèi)收集Mini-Ames�����、Micro-Ames和Ames波動試驗的背景數(shù)據(jù)�����,試圖形成標準化的操作流程。然而非標準平皿的Ames試驗各家實驗室操作流程差異很大�����,較難形成統(tǒng)一操作標準,可能對審評工作造成一定難度�����。
開展相關(guān)試驗方法與傳統(tǒng)試驗方法結(jié)果的一致性比較則有助于數(shù)據(jù)互認和評價效率�����。
筆者完成的 Ames與Mini-Ames 試驗中陰性與陽性對照組回復(fù)突變菌落數(shù)比較如表5所示�����。
3.2 Pig-a 基因突變試驗
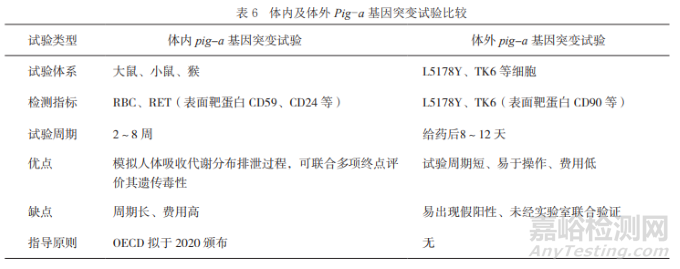
體內(nèi)Pig-a基因突變試驗是近年來在藥物安全性評價領(lǐng)域日益受到重視的一項藥物致突變性評價方法。
Pig-a基因位于X染色體�����,該基因突變可導(dǎo)致糖化磷脂酰肌醇(Glycosylphos-phatidyl Inositol,GPI)合成障礙�����,從而使相關(guān)細胞GPI錨蛋白(如CD48�����、CD55、CD59等)缺失�����。
因GPI錨蛋白在不同物種間的生物合成高度保守�����,且在各類組織細胞及各類成熟紅細胞中均有表達,故試驗可使用正常動物外周血作為試驗系統(tǒng)�����。
Araten等在1999年首次提出Pig-a基因突變試驗可用于藥物基因突變風(fēng)險評價。
Dertinger等進一步將高通量免疫磁性篩選技術(shù)引入Pig-a基因突變試驗�����,有效提高了統(tǒng)計功效�����。
該方法當前已完成多中心聯(lián)合驗證�����,OECD擬于2020年正式發(fā)布相關(guān)指導(dǎo)原則�����。
當Ames試驗結(jié)果不明確時,體內(nèi)Pig-a基因突變試驗可作為后續(xù)選擇的試驗方法�����,其結(jié)果已獲得美國FDA認可。
體內(nèi)Pig-a基因突變試驗的主要優(yōu)勢在于可檢測弱致突變劑體內(nèi)蓄積后的致突變風(fēng)險�����,并獲得受試物對嚙齒類動物致癌風(fēng)險的相關(guān)數(shù)據(jù)�����。
但其缺點也較為突出,即受試物需求量較大�����,試驗周期長,對于合成量較少的雜質(zhì)來說存在一定困難�����,且不適合大量雜質(zhì)毒性篩選�����。
但體內(nèi)Pig-a 基因突變試驗尚未經(jīng)過國內(nèi)聯(lián)合驗證及推廣�����,實際上具有相關(guān)試驗?zāi)芰徒?jīng)驗的國內(nèi)安全性評價中心很少�����。
近年來�����,國內(nèi)外陸續(xù)開展基于TK6�����、MCL-5以及L5178Y等哺乳動物細胞系的體外Pig-a基因突變試驗建立與驗證工作。
體外Pig-a基因突變試驗的優(yōu)點是使用的受試物用量少�����、試驗周期短(一 般受試物處理8天后檢測)�����、不使用動物和適于進行機制研究�����。
但是�����,在安全評價領(lǐng)域正式使用之前�����,在細胞選擇和標準化試驗方法的驗證等方面還需要開展大量工作�����。
體內(nèi)及體外Pig-a基因突變試驗優(yōu)劣對比詳見表6�����。
3.3 彗星試驗
Ostling和Johansson于1984年建立彗星實驗 (Comet Assay)�����,也稱為單細胞凝膠電泳(Single Cell Gel Electrophoresis�����,SCGE)�����,可在單細胞水平上檢測DNA鏈斷裂程度�����,從而評價受試物是否與 DNA相互作用�����。
該方法利用損傷的DNA與完整的 DNA在電泳中遷移速率差異�����,對存在DNA損傷的細胞(形成彗星樣結(jié)構(gòu))進行區(qū)分�����。
因DNA斷裂多在給藥后短期內(nèi)出現(xiàn)�����,該方法可靈敏地檢出短時間內(nèi)出現(xiàn)的DNA損傷�����。
但DNA單鏈斷裂可自行修復(fù),損傷不一定遺傳給子代細胞�����。故彗星試驗的結(jié)果可作為參考�����,用于判斷受試物與DNA堿基作用的可能性�����,其結(jié)果對雜質(zhì)的遺傳毒性有一定預(yù)測作用�����。
國際肝細胞彗星試驗實驗室間聯(lián)合驗證于2015年完成并發(fā)表,OECD于2014年頒布體內(nèi)彗星試驗指導(dǎo)原則�����。
4 小結(jié)
綜上所述�����,隨著大量創(chuàng)新藥及仿制藥的出現(xiàn),迫切需要加強遺傳毒性雜質(zhì)的監(jiān)管�����。
我國已陸續(xù)出臺了一系列與國際接軌的指南性文件以支持雜質(zhì)的毒性評估�����,但實際工作中難點尚存�����。
如傳統(tǒng)方法在雜質(zhì)評價中存在局限性�����,指南性文件對雜質(zhì)的遺傳毒性評價要求不明確�����,缺乏新方法與傳統(tǒng)方法之間的一致性比較�����,藥物合成路線實際產(chǎn)生的大量含警示結(jié)構(gòu)雜質(zhì)無毒理學(xué)研究數(shù)據(jù)支持,基于構(gòu)效分析的毒性預(yù)測軟件的預(yù)測效力不足等�����。
此外�����,通過對國家藥品抽檢數(shù)據(jù)庫與歐洲藥典分析比對�����,我國國抽藥品實際檢出雜質(zhì)與歐洲藥典中所列出的雜質(zhì)類型存在較大差異�����,其原因可能與藥物合成加工方式不同有關(guān)。
我國藥典中對藥品可能存在的雜質(zhì)和具體定量限要求缺乏詳細明確的界定�����,而歐洲藥典中的雜質(zhì)毒性及定量限的信息又難以借鑒�����。
上述因素對監(jiān)管人員在藥物化學(xué)�����、遺傳毒性評價等多領(lǐng)域的知識儲備提出了新的挑戰(zhàn)�����。遺傳毒性雜質(zhì)的監(jiān)管不是紙上談兵�����,應(yīng)充分結(jié)合計算機毒理學(xué)�����、毒性評價方法和制定符合我國國情的監(jiān)管限度值,從三個維度切實做好雜質(zhì)的控制�����,從而提高藥物的安全性�����,保障人民用藥安全。