摘要:藥品上市許可持有人( marketing authorization holder, MAH) 制度以“申請放開���、轉(zhuǎn)讓放開���、委托生產(chǎn)放開”的政策措施���, 達(dá)到促進(jìn)我國藥品研發(fā)創(chuàng)新���, 優(yōu)化行業(yè)資源配置���, 提高監(jiān)管效率的目的。但在委托生產(chǎn)和委托檢驗過程如何保證藥品質(zhì)量是推進(jìn) MAH 制度的關(guān)鍵問題���。本文針對MAH實施中委托生產(chǎn)和委托檢驗的法規(guī)政策和申報流程以及風(fēng)險控制和監(jiān)管策略進(jìn)行了梳理���,明確了委托質(zhì)量協(xié)議的制定流程、要求和內(nèi)容���,進(jìn)而提出提升持有人監(jiān)督有效性���、提升受托企業(yè)質(zhì)量意識、建立信息公示制度 3 項建議���,為全面提升藥品質(zhì)量管理水平���,更好地提升產(chǎn)品的市場競爭力提出建議���。
引言
2019年12月1日 《藥品管理法》 第六條規(guī)定“國家對藥品管理實行藥品上市許可持有人制度”。藥品上市許可持有人依法對藥品研制���、生產(chǎn)���、經(jīng)營、使用全過程中藥品的安全性���、有效性和質(zhì)量可控性負(fù)責(zé)���。持有人企業(yè)應(yīng)加強(qiáng)委托活動的管理,提升委托管理的能力以及履行持有人的主體責(zé)任���。面對嚴(yán)峻的市場形勢���,帶量采購中標(biāo)企業(yè)產(chǎn)能不足,發(fā)達(dá)地區(qū)藥品生產(chǎn)成本較高���,藥品研發(fā)機(jī)構(gòu)不具備生產(chǎn)場地等現(xiàn)狀���,企業(yè)產(chǎn)生了大量的委托生產(chǎn)需求���;針對大型精密儀器項目、中藥材農(nóng)藥殘留以及動物實驗項目等現(xiàn)狀企業(yè)產(chǎn)生了大量的委托檢驗需求���。本文針對MAH實施中委托生產(chǎn)和委托檢驗的風(fēng)險控制和監(jiān)管策略進(jìn)行了梳理,為提升藥品質(zhì)量管理提出建議���。
1���、我國藥品委托生產(chǎn)和委托檢驗的質(zhì)量管理政策
1.1 委托生產(chǎn)的管理規(guī)范要求及申報流程
我國藥品生產(chǎn)企業(yè)委托生產(chǎn)由上市許可和生產(chǎn)許可的捆綁式管理,發(fā)展為MAH制度的上市許可和生產(chǎn)許可分離式管理[1]���。在2019年頒布的《中華人民共和國藥品管理法》中明確規(guī)定藥品管理實行藥品上市許可持有人制度���。對于血液制品、麻醉藥品���、精神藥品���、醫(yī)療用毒性藥品���、藥品類易制毒化學(xué)品、經(jīng)批準(zhǔn)或者通過關(guān)聯(lián)審評的原料藥���、中藥飲片禁止委托生產(chǎn)���。除上述禁止委托生產(chǎn)的范圍,藥品上市許可持有人可委托符合條件的藥品生產(chǎn)企業(yè)生產(chǎn)藥品���。疫苗上市許可持有人應(yīng)當(dāng)具備疫苗生產(chǎn)能力���;超出疫苗生產(chǎn)能力確需委托生產(chǎn)的,應(yīng)當(dāng)經(jīng)國務(wù)院藥品監(jiān)督管理部門批準(zhǔn)[2]���。
委托生產(chǎn)的申報流程主要為(1)受托方同意受托生產(chǎn)���,省局出具同意受托生產(chǎn)和通過GMP符合性檢查的證明文件。(2)持有人辦理《藥品生產(chǎn)許可證》���,增加委托生產(chǎn)范圍和地址���。(3)持有人更新注冊信息���,藥品業(yè)務(wù)應(yīng)用系統(tǒng)“藥品注冊審批與備案”模塊,按變更生產(chǎn)場地備案���。中等���、重大注冊事項發(fā)生關(guān)聯(lián)變更的,應(yīng)提出申請���。(4)受托方辦理《藥品生產(chǎn)許可證》增加受托生產(chǎn)品種信息。
1.2 委托檢驗的管理規(guī)范要求及備案
委托生產(chǎn)的申報流程主要為(1)受托方同意受托生產(chǎn)���,省局出具同意受托生產(chǎn)和通過GMP符合性檢查的證明文件���。(2)持有人辦理《藥品生產(chǎn)許可證》,增加委托生產(chǎn)范圍和地址���。(3)持有人更新注冊信息���,藥品業(yè)務(wù)應(yīng)用系統(tǒng)“藥品注冊審批與備案”模塊,按變更生產(chǎn)場地備案。中等���、重大注冊事項發(fā)生關(guān)聯(lián)變更的���,應(yīng)提出申請。(4)受托方辦理《藥品生產(chǎn)許可證》增加受托生產(chǎn)品種信息���。
委托檢驗涉及到的管理規(guī)范文件主要有《藥品生產(chǎn)質(zhì)量管理規(guī)范》第十一章 委托生產(chǎn)與委托檢驗���;《藥品GMP指南》質(zhì)量控制實驗室 第八章 委托檢驗的管理。2020年06月30日 上海市藥品監(jiān)督管理局發(fā)布關(guān)于實施新修訂《藥品生產(chǎn)監(jiān)督管理辦法》有關(guān)事項的通知中附件3中提出了關(guān)于委托檢驗的規(guī)范化要求:因使用頻次較少���、不具備特殊檢驗項目實驗條件等原因確需委托檢驗的���,持有人應(yīng)對擬受托檢驗單位進(jìn)行資質(zhì)審查和檢驗?zāi)芰υu估,符合要求的簽訂委托檢驗協(xié)議���、明確委托項目���、委托周期、雙方責(zé)任與義務(wù)及相關(guān)技術(shù)事項���。變更(增加)受托檢驗單位的���,持有人應(yīng)在簽署委托檢驗協(xié)議后的30個工作日內(nèi)將委托檢驗信息報告我局���。委托檢驗期間,持有人應(yīng)當(dāng)加強(qiáng)對受托檢驗單位的審計監(jiān)督���,受托檢驗單位不得再次委托第三方檢驗���。
委托檢驗的備案在行政許可申請網(wǎng)上申報系統(tǒng)中進(jìn)行,應(yīng)提交的重點資料包括委托檢驗清單���,(列出委托檢驗品種及生產(chǎn)的成品名稱���、委托檢驗的項目���、所用的檢驗儀器名稱和型號及主要配件(檢測器)���、檢驗的質(zhì)量標(biāo)準(zhǔn)、委托檢驗理由���、委托檢驗時限)���、委托檢驗合同���、受托方檢驗的資質(zhì)證明文件和檢測能力范圍證書。
2���、上市許可持有人委托生產(chǎn)和委托檢驗的風(fēng)險分析
2.1 上市許可持有人委托生產(chǎn)和委托檢驗的監(jiān)管缺陷
由于委托生產(chǎn)導(dǎo)致了質(zhì)量事件屢見不鮮���,如廣東怡康制藥委托韶關(guān)市居民制藥生產(chǎn)抗骨增生片,由于受委托企業(yè)存在中西藥生產(chǎn)交替共線���,清場不徹底等問題���,導(dǎo)致抗骨增生片與氯芬黃敏片發(fā)生了交叉污染,兩家企業(yè)都被收回了GMP證書���。美國新基生物醫(yī)藥委托美國當(dāng)?shù)匾患夜旧a(chǎn)注射用紫杉醇���,國家局在境外委托生產(chǎn)現(xiàn)場檢查發(fā)現(xiàn)部分關(guān)鍵生產(chǎn)設(shè)施不符合中國GMP,存在生產(chǎn)過程無菌控制措施不到位等問題���,遭到產(chǎn)品暫停出口���、銷售���、使用,市場被國內(nèi)企業(yè)占領(lǐng)���,失去原本擁有的市場絕對主導(dǎo)權(quán)���。委托生產(chǎn)藥監(jiān)部門檢查中發(fā)生的缺陷如表2所示。
委托檢驗單位主要為藥品生產(chǎn)企業(yè)���、第三方檢驗機(jī)構(gòu)和官方藥監(jiān)所���。目前存在的問題為委托檢驗簽訂的合同或協(xié)議未包括雙方質(zhì)量職責(zé)、對第三方檢驗機(jī)構(gòu)的審計執(zhí)行不到位���、委托檢驗的管理規(guī)程未包括委托檢驗的清單(產(chǎn)品���、項目���、單位等)[3-4]���。
2.2 上市許可持有人對委托企業(yè)質(zhì)量監(jiān)督風(fēng)險
研發(fā)機(jī)構(gòu)和科研人員為主的MAH可能存在生產(chǎn)監(jiān)管能力不足���。研發(fā)機(jī)構(gòu)類型的持有人對自身應(yīng)承擔(dān)的藥品全生命周期責(zé)任的認(rèn)識不足,對藥品管控的能力可能仍停留在研發(fā)階段���。持有人對產(chǎn)品生產(chǎn)工藝的認(rèn)識和理解限于研發(fā)規(guī)模���,因此缺乏監(jiān)督受托生產(chǎn)企業(yè)履行生產(chǎn)責(zé)任的能力,也缺乏自身履行產(chǎn)品上市放行責(zé)任的能力���。2.2 上市許可持有人對委托企業(yè)質(zhì)量監(jiān)督風(fēng)險
生產(chǎn)企業(yè)類MAH有效行使生產(chǎn)質(zhì)量監(jiān)管可能存在困難���。如委托生產(chǎn)經(jīng)驗少,在生產(chǎn)變更���、協(xié)調(diào)溝通���、技術(shù)交流和責(zé)任義務(wù)約定方面不具備相關(guān)經(jīng)驗,穩(wěn)定的合作關(guān)系也需要一定時間磨合���。
2.3 受托企業(yè)質(zhì)量意識風(fēng)險
受托企業(yè)可能會忽視對委托產(chǎn)品的生產(chǎn)質(zhì)量管控���,不能很好履行對產(chǎn)品的生產(chǎn)責(zé)任和義務(wù)���。受托生產(chǎn)企業(yè)引入的委托生產(chǎn)品種與原有生產(chǎn)產(chǎn)品的共線風(fēng)險評估不充分,缺少采取有效防控措施的動力或能力���,造成產(chǎn)品質(zhì)量潛在風(fēng)險���。
2.4 藥監(jiān)部門異地監(jiān)管風(fēng)險
持有人與受托生產(chǎn)企業(yè)為兩個不同的主體,并且往往分屬兩地���。90%的企業(yè)認(rèn)為跨省區(qū)委托的監(jiān)管和各地政策銜接存在問題���。目前未建立國家層面的藥品監(jiān)管信息系統(tǒng)���,無法全面掌握持有人的基本信息、生產(chǎn)品種的注冊核查和 GMP檢查等監(jiān)管信息���。
2.5 委托檢驗監(jiān)管風(fēng)險
主要存在檢驗機(jī)構(gòu)多樣化���、送檢樣品不可控、協(xié)議內(nèi)容有待細(xì)化���。企業(yè)簽訂的委托檢驗協(xié)議普遍比較寬泛和簡單���,對協(xié)議雙方的權(quán)利和責(zé)任缺乏明確的界定。個別中藥生產(chǎn)企業(yè)將挑選后的藥材送至受托方進(jìn)行檢驗����,得到合格的檢驗報告書,但在組織生產(chǎn)時使用的卻是未經(jīng)挑選�、摻雜摻偽的中藥材。
3���、上市許可持有人委托生產(chǎn)和委托檢驗的監(jiān)管策略
3.1提升上市許可持有人監(jiān)督的有效性
藥品上市許可持有人( Marketing Authorization Holder, MAH) 制度擴(kuò)大了藥品持有人主體范圍�,基于此制度下的委托生產(chǎn)也將更為普遍�。除研發(fā)機(jī)構(gòu)本身的體系外,其所委托的第三方機(jī)構(gòu)同樣需要監(jiān)控[5]�。MAH在尋找委托生產(chǎn)的合作企業(yè)之初,就應(yīng)對受托企業(yè)的生產(chǎn)條件�、技術(shù)水平、員工素質(zhì)����、質(zhì)量管理情況等做詳細(xì)的考察���,確定受托企業(yè)具有相應(yīng)藥品的生產(chǎn)條件和能力。對生產(chǎn)企業(yè)的考察可包括設(shè)施設(shè)備�、培訓(xùn)、人員管理���、質(zhì)量控制與質(zhì)量保證����、風(fēng)險管理計劃�、文件系統(tǒng)、投訴����、產(chǎn)品召回等一整套體系。對受托生產(chǎn)企業(yè)應(yīng)進(jìn)行審計���、持續(xù)評估���、風(fēng)險評估、關(guān)鍵控制點考察等全方位動態(tài)管理方式來監(jiān)測和審核其表現(xiàn)�,識別生產(chǎn)企業(yè)存在的不足之處并實施所需的改進(jìn)措施����,以便為將來長遠(yuǎn)合作打下堅實基礎(chǔ)[6]����。
3.1.1委托合作方的選擇
委托合作方的選擇依賴于質(zhì)量審計和評估����,通過問卷調(diào)研選擇潛在受托方,通過實地審計選擇意向受托方�,最后做好評估報告確定受托方[7]。質(zhì)量審計與評估的內(nèi)容如表3所示�。
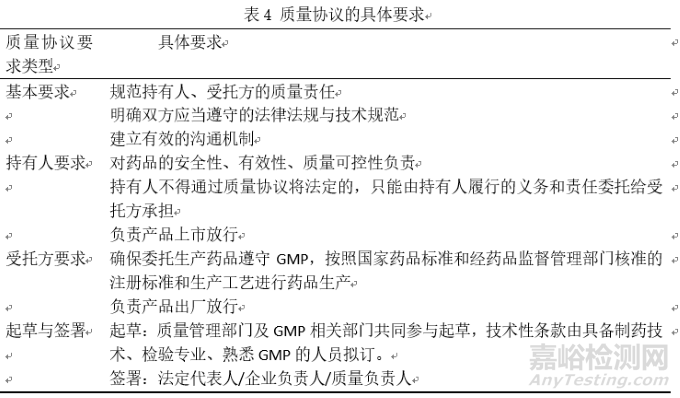
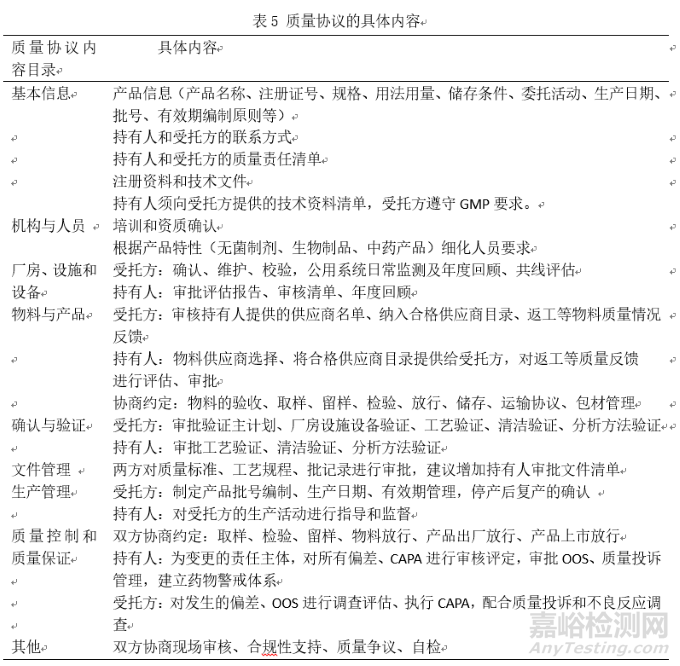
3.1.2委托質(zhì)量協(xié)議的制定要求和內(nèi)容
質(zhì)量協(xié)議是實施 MAH 制度中的重要組成部分。協(xié)議指南通過劃分委托雙方的責(zé)任與權(quán)力���, 對委托生產(chǎn)中可能影響到藥品質(zhì)量的每個環(huán)節(jié)都做出了相關(guān)原則性規(guī)定���, 以指導(dǎo)委托雙方從硬件和軟件方面協(xié)商對質(zhì)量的監(jiān)控。簽訂質(zhì)量協(xié)議賦予了持有人監(jiān)督的權(quán)力和如何監(jiān)督的說明����, 使 MAH 主體能對受托生產(chǎn)企業(yè)有效監(jiān)督[8]。對委托質(zhì)量協(xié)議的制定要求和內(nèi)容梳理如下:表4 質(zhì)量協(xié)議的具體要求���,表5為質(zhì)量協(xié)議的具體內(nèi)容����。
質(zhì)量協(xié)議的具體內(nèi)容梳理如表5所示,質(zhì)量協(xié)議的內(nèi)容應(yīng)該進(jìn)行文件標(biāo)準(zhǔn)化���,并對雙方相關(guān)人員進(jìn)行培訓(xùn)����,委托方與受托方應(yīng)建立良好的溝通�,以書面形式記錄質(zhì)量溝通結(jié)果,并由雙方審核簽字���。
3.2提升受托企業(yè)和機(jī)構(gòu)的質(zhì)量意識
轉(zhuǎn)變質(zhì)量觀念�。委托生產(chǎn)從國際經(jīng)驗看�, 持有人傾向選擇口碑較好、經(jīng)驗較多的 CMO 企業(yè)���。這是因為企業(yè)更好的質(zhì)量能在無形之中幫助企業(yè)獲取他人信任����, 不僅能增強(qiáng)競爭力�, 也能增加自身能力���。一味追求市場利益即使能在短時期獲得高額回報, 但最終會帶來巨額罰款和市場淘汰����。
建立交流機(jī)制。受托企業(yè)從一線的生產(chǎn)人員���, 到企業(yè)內(nèi)部質(zhì)量控制部門���、藥企管理層����、持有人、政府監(jiān)管機(jī)構(gòu)等等����, 都應(yīng)當(dāng)樹立質(zhì)量第一的意識, 在企業(yè)內(nèi)部�、企業(yè)之間、企業(yè)與政府�、委托方之間定期開展質(zhì)量交流, 討論在委托生產(chǎn)中常見的風(fēng)險隱患和解決辦法����。將質(zhì)量風(fēng)險視為改進(jìn)的契機(jī)而不是影響企業(yè)業(yè)績的累贅���。
提高質(zhì)量意識。受托企業(yè)應(yīng)重點關(guān)注企業(yè)自身是否具備與擬生產(chǎn)藥品相適應(yīng)的藥品質(zhì)量管理體系及相應(yīng)人員配備���,是否具備與產(chǎn)品相適應(yīng)的生產(chǎn)廠房���、設(shè)備設(shè)施及質(zhì)量檢驗設(shè)施等。MAH 受托生產(chǎn)的藥品生產(chǎn)許可證檢查的重點包括 :①生產(chǎn)線產(chǎn)能與擬定的上市批量的匹配情況 ���;②如引入受托品種與原有品種為共線生產(chǎn)���,對共線生產(chǎn)的可行性評估情況 ;③對受托品種工藝的理解和控制情況等����。受托企業(yè)的監(jiān)督檢查的重點包括 :① GMP規(guī)范的執(zhí)行情況,如涉及共線生產(chǎn)需重點關(guān)注企業(yè)在生產(chǎn)過程中采取的防止污染及交叉污染的措施 ���;②藥品注冊工藝的執(zhí)行情況 �;③與持有人簽訂的《質(zhì)量協(xié)議》的執(zhí)行情況 ����;④與持有人的溝通情況����,對受托生產(chǎn)品種的變更控制�、偏差、超標(biāo)結(jié)果等是否按約定及時報告持有人等[9]�。
3.3建立電子信息公示制度
兩地或區(qū)域省級藥品監(jiān)管機(jī)構(gòu)之間應(yīng)建立聯(lián)合監(jiān)管的工作機(jī)制,統(tǒng)一協(xié)調(diào)跨省監(jiān)管及延伸檢查工作 �;建立可操作的跨省委托監(jiān)督管理規(guī)定和延伸監(jiān)管檢查辦法,確定以品種為主線開展監(jiān)管檢查的原則�,落實屬地監(jiān)管責(zé)任,保證監(jiān)管無縫銜接 ����;建立可兩地或區(qū)域共享的藥品檢查信息數(shù)據(jù)庫����,為兩地藥品監(jiān)管部門提供參考。建立全國性的信息公示系統(tǒng)�, 能方便各主體間
信息流通。通過該數(shù)據(jù)庫����, 藥監(jiān)部門應(yīng)當(dāng)對將檢查的藥品資料有一個清晰的認(rèn)識���, 對需要檢查的內(nèi)容也能有的放矢。該數(shù)據(jù)庫也使藥品持有人可以隨時跟進(jìn)委托藥品的生產(chǎn)和相關(guān)檢查情況�。此外, 為了避免各地藥監(jiān)部門對委托藥品消極檢查的情況���, 建議設(shè)立相應(yīng)的協(xié)調(diào)部門或?qū)I(yè)負(fù)責(zé)各地監(jiān)管政策溝通部門����, 確保各地監(jiān)管政策能有序銜接����, 信息公示系統(tǒng)的相關(guān)模塊與內(nèi)容見表6。
3.4提升委托檢驗規(guī)范性
規(guī)范檢測市場秩序���。為規(guī)避檢驗機(jī)構(gòu)的多樣化帶來的一系列風(fēng)險���,藥品監(jiān)管部門應(yīng)對各檢測機(jī)構(gòu)進(jìn)行統(tǒng)一監(jiān)管、指導(dǎo)和溝通�,完善相關(guān)的規(guī)章制度和技術(shù)規(guī)范,保證委托檢驗結(jié)果的可靠性����。
確保樣品的代表性�、真實性和穩(wěn)定性���。檢驗機(jī)構(gòu)應(yīng)做好樣品的核查和接收���,按照合同上載明的樣品狀態(tài)、數(shù)量���、封存狀態(tài)等內(nèi)容進(jìn)行核查����,確定樣品包裝完好����,并做好接受記錄。
嚴(yán)格簽訂并履行委托檢驗協(xié)議����。藥品生產(chǎn)企業(yè)和檢驗機(jī)構(gòu)應(yīng)參照委托檢驗規(guī)范的要求���,結(jié)合實際情況����,細(xì)化協(xié)議內(nèi)容,有效規(guī)避風(fēng)險����。
4. 總結(jié)與展望
MAH是制藥行業(yè)廣受歡迎的制度,其實施必然會在未來讓國內(nèi)制藥行業(yè)普遍受益���。 MAH 制度給制藥行業(yè)和藥品監(jiān)管帶來了前所未有的機(jī)遇����,同時也帶來了挑戰(zhàn)����。落實持有人、受托生產(chǎn)企業(yè)的義務(wù)與法律責(zé)任����,建立跨省委托生產(chǎn)的延伸監(jiān)管方式與聯(lián)合監(jiān)管機(jī)制,有利于 MAH 制度的順利推進(jìn)���,保證藥品質(zhì)量安全����,促進(jìn)創(chuàng)新藥和高品質(zhì)藥品的研發(fā),全面提升藥品質(zhì)量管理水平�,更好地提升產(chǎn)品的市場競爭力。
參考文獻(xiàn)
[1]黃志成�,高敏,貝雷���,陳旭.藥品上市許可持有人制度對藥品監(jiān)管工作的影響和思考[J]. 中國藥事����,2019,33(5):493-498
[2]《藥品上市許可持有人制度試點方案》政策解讀[J].中國制藥信息�, 2016(9): 10-11
[3]畢秀玲,李珠華�,李莎菁,趙迎春.我國藥品委托檢驗的現(xiàn)狀與風(fēng)險控制[J].中國藥房,2014,24(33):3076-3077
[4] 李俐�,孫建民.檢測機(jī)構(gòu)委托檢驗的細(xì)節(jié)風(fēng)險控制[J].現(xiàn)代測量與實驗室管理,2011����,19(4):53
[5] 潘梟穎,茅寧瑩.藥品上市許可持有人委托生產(chǎn)的質(zhì)量風(fēng)險辨析及對策研究—基于利益相關(guān)者視角 [J] .中國新藥雜志�, 2019,28( 24) : 2926-2932
[6] 李濱����,王寶藝.藥品上市許可持有人制度下生產(chǎn)企業(yè)的管理對策探討[J].中國醫(yī)藥工業(yè)雜志, 2020�,51( 8) : 1085 - 1090.
[7]阿蓉娜,梁毅.上市許可持有人制度下非生產(chǎn)企業(yè)的藥品委托生產(chǎn)質(zhì)量管理探析[J].中國藥事,2019,33(2):177-181
[8] 《藥品上市許可持有人與受托藥品生產(chǎn)企業(yè)質(zhì)量協(xié)議撰寫指南》[2019-05-15].http: / /www.spbia.cn /Article /201712 /201712110001.shtml
[9] 湯涵,魏靖,哲蔣蓉.歐盟藥品上市許可持有人制度下藥品共用生產(chǎn)設(shè)施風(fēng)險管理研究及對我國的借鑒[J].中國醫(yī)藥工業(yè)雜志,2019,50(2):233-236