一�、如何開展同品種臨床評價?
①需要申報產(chǎn)品與同品種器械在適用范圍���、技術(shù)特征和生物學(xué)特性等方面基本等同���,基本等同境內(nèi)已獲準(zhǔn)注冊上市的產(chǎn)品;
②申報產(chǎn)品與同品種器械差異點不對產(chǎn)品的安全�����、有效產(chǎn)生不利影響�。
1.2等同性論證
需明確申報產(chǎn)品和同品種器械的適用范圍相同和技術(shù)特征/生物學(xué)特性�����,詳述二者的相同性和差異性�,需列表詳述�����,證明申報產(chǎn)品和同品種器械性能等同�����。具體產(chǎn)品的對比信息應(yīng)根據(jù)具體產(chǎn)品信息(如根據(jù)產(chǎn)品說明書���、產(chǎn)品技術(shù)要求�、軟件文檔等)進行相應(yīng)的增加或調(diào)整�����,可根據(jù)產(chǎn)品特點有側(cè)重點的論證等同性。
1.3與同品種產(chǎn)品差異性部分進行安全有效性論證
對當(dāng)申報產(chǎn)品與同品種產(chǎn)品存在差異時���,需要提交充分的證據(jù)�,證明二者具有相同的安全有效性�,從而論證其等同性,可以通過以下幾種方式進行論證:
①可以增加具有可比性的同品種產(chǎn)品�,提供相應(yīng)的臨床數(shù)據(jù);
②提供申報產(chǎn)品的非臨床研究(比如性能研究���、動物實驗);
③提供申報產(chǎn)品的臨床證據(jù)�����。
在等同性論證階段�,建議申請人詳細如實說明與對比產(chǎn)品的相同性和差異性。對差異性進行逐條分析�,合理采用非臨床證據(jù)、臨床文獻資料���、臨床經(jīng)驗數(shù)據(jù)�、臨床試驗等證據(jù)驗證產(chǎn)品的安全有效性�����。需注意此時針對差異性論證提供的數(shù)據(jù)應(yīng)屬于申報產(chǎn)品。
1.4對比器械臨床數(shù)據(jù)獲?。?/span>
1.4.1 臨床數(shù)據(jù)及獲取方式
臨床評價中使用的申報產(chǎn)品或同品種醫(yī)療器械的臨床數(shù)據(jù)可能由注冊申請人或第三方持有�,或者可從科學(xué)文獻中獲取。
1.4.2 臨床數(shù)據(jù)來源
同品種器械臨床數(shù)據(jù)的收集:
1.臨床文獻數(shù)據(jù):指非注冊申請人持有�、可論證產(chǎn)品安全性、臨床性能和/或有效性的已發(fā)表臨床數(shù)據(jù)�,構(gòu)成臨床證據(jù)的一部分。臨床文獻數(shù)據(jù)的收集應(yīng)保證全面���、精準(zhǔn)���、具有可重復(fù)性,中國境內(nèi)和/或境外公開發(fā)表的科學(xué)文獻和合法獲得的相應(yīng)數(shù)據(jù)都應(yīng)進行收集�。
2. 臨床經(jīng)驗數(shù)據(jù):除臨床試驗外的臨床使用,與申報產(chǎn)品或同品種醫(yī)療器械相關(guān)�,包括但不限于上市后的監(jiān)測報告、登記數(shù)據(jù)�、病歷數(shù)據(jù)、不良事件數(shù)據(jù)庫(如國家藥品監(jiān)督管理總局發(fā)布的《醫(yī)療器械不良事件信息通報》���、《醫(yī)療器械警戒快訊》�����,美國食品藥品監(jiān)督管理局生產(chǎn)企業(yè)與用戶機構(gòu)設(shè)備使用數(shù)據(jù)庫(MAUDE)�����,英國醫(yī)療器械警報(MDA)�,澳大利亞TGA召回數(shù)據(jù)庫等)以及糾正措施信息(如召回、公告�、警告等)。
3. 臨床試驗數(shù)據(jù):包括申報產(chǎn)品/同品種器械臨床試驗數(shù)據(jù)�����、境外臨床試驗數(shù)據(jù)�����、境內(nèi)臨床試驗數(shù)據(jù)�。通常對于采用同品種對比路徑的醫(yī)療器械�,臨床試驗數(shù)據(jù)主要來自:
①同一家公司產(chǎn)品更新?lián)Q代,使用前代產(chǎn)品的臨床試驗數(shù)據(jù)�����;
②擁有同品種器械公司的授權(quán),使用同品種器械的臨床試驗數(shù)據(jù)�����;
③進口產(chǎn)品國產(chǎn)化���,使用境外臨床試驗數(shù)據(jù)�;
④針對申報產(chǎn)品與同品種器械的差異�,開展申報產(chǎn)品的臨床試驗。
1.5如何進行臨床數(shù)據(jù)的評估�?
進行臨床數(shù)據(jù)評估,旨在了解數(shù)據(jù)的優(yōu)點和局限性�,確定其對產(chǎn)品待解決問題的適宜性以及其對證明產(chǎn)品安全性、臨床性能和/或有效性的貢獻(包括關(guān)于安全性���、臨床性能和/或有效性的特定宣稱)���。需對數(shù)據(jù)的質(zhì)量以及其與申報產(chǎn)品的相關(guān)性(即數(shù)據(jù)應(yīng)來自申報產(chǎn)品或者同品種器械)進行評估。根據(jù)《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》(2021年第73號)[3]�����,目前對于臨床數(shù)據(jù)的評估大多數(shù)采用下表對臨床數(shù)據(jù)進行適應(yīng)性評估和數(shù)據(jù)貢獻評估�。
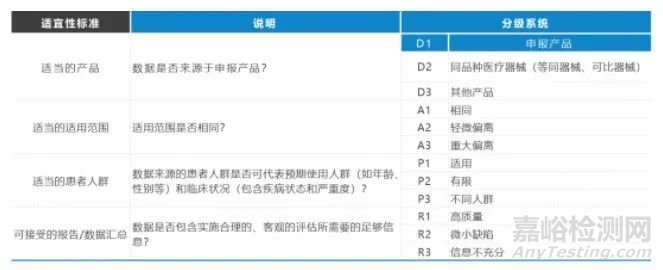

1.6如何進行臨床數(shù)據(jù)的分析評價���?
臨床數(shù)據(jù)的分析方法包括定量分析和定性分析。鑒于目前多數(shù)產(chǎn)品為漸進性設(shè)計變更�����,對臨床試驗的需求有限���,其臨床評價大量使用臨床文獻數(shù)據(jù)和臨床經(jīng)驗數(shù)據(jù)�,可能使用定性分析方法(如描述性方法)�����。作為臨床評價人員需考慮�,臨床證據(jù)與其他設(shè)計驗證和確認文件、器械描述�、說明書和標(biāo)簽、風(fēng)險分析以及生產(chǎn)信息進行綜合分析時�����,能夠確證:
產(chǎn)品達到預(yù)期性能�����;
產(chǎn)品未對患者或者使用者產(chǎn)生不適當(dāng)?shù)陌踩詥栴}�����;
與患者受益相比�,器械使用有關(guān)的風(fēng)險可接受;
符合安全和性能基本原則���;
是否需要開展上市后研究�。




