今日頭條
碩佰雙通路肺部疾病新藥報(bào)IND����。碩佰醫(yī)藥1類化藥DBM-1152A吸入溶液的臨床試驗(yàn)申請(qǐng)獲CDE受理���。DBM-1152A同時(shí)具有M受體拮抗和β受體激動(dòng)兩種功能(MABA)�����,已在臨床前研究中顯示出具有協(xié)同擴(kuò)張氣管和抗炎的作用。該新藥擬開發(fā)用于哮喘和慢性阻塞性肺疾病��,包括慢性支氣管炎、肺氣腫引起的支氣管痙攣的緩解(急救)和維持治療����。
國(guó)內(nèi)藥訊
1.合源CD19靶向CAR-T擬納入優(yōu)先審評(píng)�����。合源生物靶向CD19的CAR-T產(chǎn)品赫基侖賽注射液(擬定)的上市申請(qǐng)獲CDE擬納入優(yōu)先審評(píng),用于治療成人復(fù)發(fā)或難治性B細(xì)胞型急性淋巴細(xì)胞白血病(r/r B-ALL)患者��。公布于ASH2022年會(huì)上的臨床數(shù)據(jù)顯示���,赫基侖賽注射液的總體緩解率(ORR)達(dá)到82.1%�����,且安全性良好。此前��,該新藥已獲得CDE納入突破性治療藥物,并被FDA授予孤兒藥資格��。
2.先為達(dá)GLP-1R激動(dòng)劑啟動(dòng)糖尿?��、笃谂R床。先為達(dá)生物長(zhǎng)效GLP-1類似物XW003登記啟動(dòng)一項(xiàng)Ⅲ期臨床��,評(píng)估每周一次皮下注射XW003與度拉糖肽相比����,用于二甲雙胍治療后血糖控制不佳的成年2型糖尿病(T2DM)患者的有效性與安全性。該項(xiàng)試驗(yàn)?zāi)繕?biāo)入組600人���,主要研究者由復(fù)旦大學(xué)附屬中山醫(yī)院李小英教授擔(dān)任。在為期20周的II期臨床中�����,XW003 1.2 mg組患者達(dá)到HbA1c≤7.0%的比例顯著高于安慰劑組(88%vs21%)�。
3.思安雙靶點(diǎn)CAR-T早期臨床積極��。武漢思安公司自主研發(fā)的首個(gè)創(chuàng)新雙靶點(diǎn)CS1-BCMA CAR-T細(xì)胞療法在ASH2022年會(huì)上公布用于治療難治或復(fù)發(fā)多發(fā)性骨髓瘤的I期臨床(NCT04662099)積極結(jié)果�����。CS1-BCMA CAR-T在16例患者中達(dá)到81%的客觀緩解率,其中6例嚴(yán)格意義的完全緩解(sCR)��、3例非常好的部分緩解(VGPR),4例部分緩解(PR)�����。6例患者經(jīng)歷細(xì)胞因子釋放綜合征(CRS)����,1例屬3級(jí)CRS 。沒(méi)有觀察到神經(jīng)毒性���。
4.宜明昂科CD47/PD-L1雙抗獲批臨床��。宜明昂科自主研發(fā)的���、CD47/PD-L1雙抗-受體重組蛋白藥物IMM2520獲FDA臨床許可。IMM2520具有功能性IgG1 Fc���,通過(guò)靶向腫瘤細(xì)胞上的CD47和PD-L1�����,可同時(shí)激活巨噬細(xì)胞及T細(xì)胞����,具有協(xié)同作用并誘導(dǎo)持久的腫瘤特異性免疫反應(yīng)。IMM2520已在臨床前研究中過(guò)表達(dá)CD47和PD-L1 CT26小鼠腫瘤模型中顯示出抗腫瘤活性�����。今年11月����,IMM2520已在國(guó)內(nèi)獲批臨床���。
5.博奧信達(dá)成新型ADC研發(fā)合作�。博奧信宣布與ADC藥物公司ImmunoGen合作開發(fā)用于治療癌癥的新型抗體偶聯(lián)藥物(ADC)���。博奧信將利用其專有的SynTracer高通量抗體內(nèi)吞篩選平臺(tái)針對(duì)雙方互選的藥物靶點(diǎn)發(fā)現(xiàn)高內(nèi)吞抗體�����,ImmunoGen公司將提供其專有的“連接子-毒素”技術(shù)���,進(jìn)一步構(gòu)建創(chuàng)新ADC候選藥物。SynTracer技術(shù)平臺(tái)能快速識(shí)別抗體的內(nèi)吞效率�����,為ADC藥物開發(fā)提供候選分子����;還能識(shí)別抗體分子用于其他偶聯(lián)藥物。
國(guó)際藥訊
1.第一三共HER2-ADC在日本報(bào)sBLA���。第一三共制藥HER2-ADC新藥Enhertu(Trastuzumab deruxtecan)已向日本厚生勞動(dòng)省提交新適應(yīng)癥上市申請(qǐng)����,用于治療HER2突變的無(wú)法切除或復(fù)發(fā)性非小細(xì)胞肺癌經(jīng)治患者����。在一項(xiàng)II期臨床DESTINY-Lung02研究中�����,5.4mg/kg和6.4mg/kg劑量組的ORR分別達(dá)到53.8%和42.9%����,DCR分別為90.4%和92.9%�����。Enhertu也是首款HER2-ADC獲FDA批準(zhǔn)用于治療NSCLC患者�。
2.羅氟司特乳膏第二項(xiàng)III期研究成功。Arcutis公司羅氟司特(0.15%)乳膏治療特應(yīng)性皮炎(AD)的第二項(xiàng)III期INTEGUMENT-2研究達(dá)到主要終點(diǎn)和所有次要終點(diǎn)�。與安慰劑相比,羅氟司特(0.15%)乳膏治療組第四周達(dá)到研究者總體評(píng)估(IGA)得分為“清除”或“幾乎清除”且相較基線改善2級(jí)以上的患者比例更高(28.9%vs12.0%�,P<0.0001);兩組患者達(dá)到EASI-75的比例分別為42.0%和19.7%��。藥物的耐受性良好��。Arcutis預(yù)計(jì)明年下半年向FDA遞交新藥補(bǔ)充申請(qǐng)��。
3.維布妥昔單抗早期cHL的II期臨床積極���。Seagen公司在ASH2022會(huì)議上公布CD30-ADC藥物維布妥昔單抗(brentuximab vedotin��,Adcetris)聯(lián)用納武利尤單抗�����、多柔比星和達(dá)卡巴嗪一線治療12歲及以上經(jīng)典霍奇金淋巴瘤(cHL)患者的II期SGN35-027研究B部分和C部分結(jié)果���。結(jié)果顯示�,在晚期cHL患者(B部分)中的完全緩解(CR)率為88%���,客觀緩解率(ORR)為93%,12個(gè)月無(wú)進(jìn)展生存(PFS)率為95%�;在早期患者中(C部分)的CR率為92%,ORR為95%��,PFS尚在評(píng)估中�����。Adcetris耐受性良好�����。
4.Moderna/默沙東癌癥疫苗IIb期臨床積極�����。Moderna與默沙東聯(lián)合開發(fā)的癌癥疫苗mRNA-4157/V940與Keytruda(帕博利珠單抗)聯(lián)用輔助治療高危黑色素瘤患者的IIb期KEYNOTE-942研究達(dá)到主要終點(diǎn)。與Keytruda相比�����,聯(lián)合輔助治療第9個(gè)月時(shí)患者的無(wú)復(fù)發(fā)生存期(RFS)顯著改善�,使復(fù)發(fā)或死亡的風(fēng)險(xiǎn)降低44%(HR=0.56 [95% CI,0.31-1.08]�;單側(cè)p值=0.0266)。聯(lián)合治療的安全性與Keytruda單藥相似�,并且優(yōu)于既往聯(lián)合使用的免疫刺激劑。
5.GSK布局寡核苷酸療法開發(fā)�����。葛蘭素史克與Wave Life Sciences達(dá)成共同開發(fā)寡核苷酸療法的戰(zhàn)略性合作�,利用后者PRISM平臺(tái)并結(jié)合GSK在遺傳學(xué)與基因組學(xué)的專業(yè),以推進(jìn)葛蘭素史克最多8個(gè)以及Wave最多3個(gè)項(xiàng)目�����。此外���,葛蘭素史克還將獲得Wave針對(duì)α1-抗胰蛋白酶缺乏癥(AATD)的臨床前寡核苷酸療法WVE-006的全球獨(dú)家權(quán)利���。根據(jù)協(xié)議��,Wave將獲得1.7億美元的預(yù)付款�,以及WVE-006的開發(fā)與里程碑潛在付款��,總款項(xiàng)最多高達(dá)33億美元�。
6.武田購(gòu)進(jìn)“best-in-class”TYK2抑制劑。武田宣布與Nimbus Therapeutics簽署一項(xiàng)最終協(xié)議�,將收購(gòu)Nimbus的全資子公司Nimbus Lakshmi及其擬用于治療多種自身免疫性疾病的酪氨酸激酶2(TYK2)抑制劑NDI-034858。NDI-034858已在治療中重度斑塊狀銀屑病的Ⅱb期臨床NDI-034858中達(dá)到PASI-75主要終點(diǎn)����。此外��,NDI-034858還在Ⅱb期試驗(yàn)中用于治療活動(dòng)性銀屑病關(guān)節(jié)炎����。根據(jù)協(xié)議��,Nimbus將獲得40億美元的預(yù)付款,以及高達(dá)20億美元的商業(yè)里程碑付款����。
醫(yī)藥熱點(diǎn)
1.浙大一院全面推行志愿者陪診服務(wù)���。2022年12月起�,浙江大學(xué)醫(yī)學(xué)院附屬第一醫(yī)院全面推行以“陪送患者進(jìn)病房”為主線��,以“院區(qū)實(shí)景路線視頻指引�����、開通愛(ài)心接駁車、發(fā)放院區(qū)平面導(dǎo)引圖及院區(qū)間交通路線圖”為輔線的系列服務(wù)實(shí)踐�����。老年患者關(guān)注“浙壹匯”公眾號(hào)��,選擇患者服務(wù)-“陪同就診”欄目即可預(yù)約。陪同就診服務(wù)覆蓋門診����、病房一條龍�����,全程免費(fèi)�����。
2.中國(guó)疾控針對(duì)“地獄犬”網(wǎng)絡(luò)傳聞發(fā)文�。12月13日��,中國(guó)疾控中心官微發(fā)布一篇題為《關(guān)于BQ.1,你需要知道的幾件事》的文章指出:新冠變異毒株BQ.1致重癥和死亡比例明顯低于早期變異株�;我國(guó)現(xiàn)階段流行的毒株仍以BA.5的亞分支BA.5.2和BF.7為主。呼吁民眾不要相信未經(jīng)證實(shí)的網(wǎng)絡(luò)傳聞�。此前網(wǎng)絡(luò)熱傳�,一種名為BQ.1.1的新冠變異毒株已出現(xiàn)���,又被稱作“地獄犬”����,該變異毒株的傳染性和致死率都很高����,且已在日本“殺瘋了”�����。
3.新冠疫苗第二劑次加強(qiáng)免疫啟動(dòng)�����。12月14日�����,國(guó)家衛(wèi)健委官網(wǎng)發(fā)布《新冠病毒疫苗第二劑次加強(qiáng)免疫接種實(shí)施方案》�。其中提到�����,現(xiàn)階段����,可在第一劑次加強(qiáng)免疫接種基礎(chǔ)上,在感染高風(fēng)險(xiǎn)人群����、60歲以上老年人群、具有較嚴(yán)重基礎(chǔ)性疾病人群和免疫力低下人群中開展第二劑次加強(qiáng)免疫接種��。第二劑次加強(qiáng)免疫與第一劑次加強(qiáng)免疫時(shí)間間隔為6個(gè)月以上����。
評(píng)審動(dòng)態(tài)
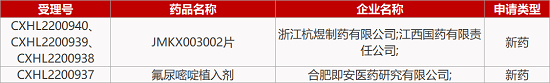
1. CDE新藥受理情況(12月14日)
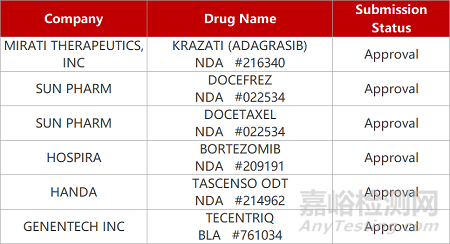
2. FDA新藥獲批情況(北美12月12日)