摘要
含鎂生物材料具有良好的可降解性和生物相容性���,作為骨科醫(yī)療器械在骨折及骨缺損修復(fù)方面具有很好的市場應(yīng)用前景���,但傳統(tǒng)制造工藝不能滿足其對復(fù)雜外形醫(yī)療器械的加工制造要求。3D打印技術(shù)是一項(xiàng)新型數(shù)字化增材制造技術(shù)�,通過“分層制造���、逐層疊加”的方式可以把金屬�、陶瓷、高分子聚合物等材料快速構(gòu)建成任意復(fù)雜物理結(jié)構(gòu)的3D模型���。3D打印含鎂生物醫(yī)用材料結(jié)合了先進(jìn)的材料制造技術(shù)和鎂優(yōu)良的生物學(xué)性能�,在骨科醫(yī)療器械領(lǐng)域具有很大的發(fā)展?jié)摿?��。本文就各?D打印含鎂生物醫(yī)用材料體系及其生物學(xué)性能的研究進(jìn)展進(jìn)行綜述�。
鎂(Mg���,1.74 g/cm3)是一種與人體骨密度(1.75 g/cm3)基本相當(dāng)?shù)妮p質(zhì)金屬。由于其彈性模量和抗壓屈服強(qiáng)度比其他金屬植入材料更接近人體骨�,鎂是與骨具有最好生物力學(xué)相容性的金屬材料。鎂作為人體必需的營養(yǎng)元素�����,在人體中主要分布于骨骼(53%)���、肌肉(27%)�����、軟組織(19.2%)�����、紅細(xì)胞(0.5%)和血清(0.3%)中���,其含量僅次于鈣,鉀�,鈉,排第四位���。在人體中�����,鎂降解釋放的鎂離子通過多個(gè)信號(hào)通路影響新陳代謝�。
鎂影響的生理功能主要包括以下幾個(gè)方面:①作為酶的輔助因子影響能量相關(guān)代謝;②作為鈣的阻抗劑抑制細(xì)胞內(nèi)鈣的堆積���;③調(diào)節(jié)骨代謝活動(dòng),誘導(dǎo)新骨生成���。
然而���,純鎂或普通鎂合金作為骨科植入材料也存在很多問題:首先,降解速率過快無法維持到傷后充分愈合�,其降解時(shí)間只能維持骨折愈合時(shí)間的 1/3~1/4;其次���,需要處理由于腐蝕而產(chǎn)生氣體積聚的問題�����。進(jìn)入 21世紀(jì)后���,隨著材料生產(chǎn)工藝的不斷提高,在生物安全性未受影響的前提下�����,將鎂進(jìn)行合金化和多樣化處理后���,其機(jī)械性能���、抗腐蝕性能�、骨誘導(dǎo)性能等得到大幅提高�。因而,含鎂植入性骨科醫(yī)療器械正越來越成為骨科領(lǐng)域研究熱點(diǎn)材料之一�。含鎂生物材料主要包含鎂及鎂合金、生物陶瓷�����、生物玻璃和聚合物復(fù)合材料�����,并且在加速骨生成和骨缺損修復(fù)方面展現(xiàn)出獨(dú)特的優(yōu)勢(圖 1A)�����。如含鎂生物陶瓷�、生物玻璃可以調(diào)節(jié)自身降解速度來匹配新骨生成速度,顯示出其作為可降解骨植入醫(yī)療器械的潛力���。含鎂聚合物復(fù)合材料通過復(fù)合鎂和聚合物制備復(fù)合材料���,不僅可以中和聚合物的酸性降解產(chǎn)物�����,還可以提高聚合物的成骨性能。然而�,由于內(nèi)部孔隙結(jié)構(gòu)不可控、外形與宿主骨缺損不完全匹配�����,傳統(tǒng)加工工藝制備的 3D 多孔支架很難滿足臨床實(shí)際需求�����。3D打印技術(shù)可以利用計(jì)算機(jī)輔助�,以支架的計(jì)算機(jī)輔助設(shè)計(jì)模型或CT掃描等數(shù)據(jù)為基礎(chǔ),通過“分層制造���、逐層疊加”的方式快速構(gòu)造出任意復(fù)雜物理結(jié)構(gòu)的3D支架�,打印過程見圖1B���。利用3D打印技術(shù)可以構(gòu)建與缺損骨組織相匹配的復(fù)雜外形的3D多孔支架�����,還可以精確調(diào)控支架內(nèi)部的孔隙結(jié)構(gòu)�。配制 3D打印墨水時(shí)還可以調(diào)整材料組分控制支架降解速率與骨再生速率相匹配�,或加入生物活性成分促進(jìn)細(xì)胞的成骨分化,從而獲得理想的骨修復(fù)效果(圖1C)�。本文就不同3D打印含鎂生物醫(yī)用材料體系及其生物學(xué)性能的研究進(jìn)展進(jìn)行綜述。
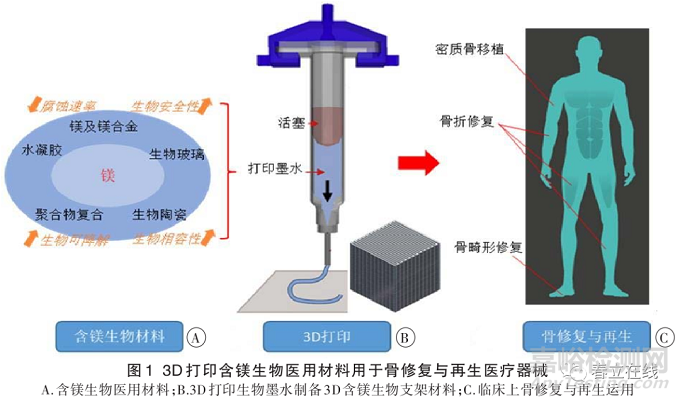
3D打印含鎂生物醫(yī)用材料體系
1.1 �����、3D打印鎂基金屬材料體系
金屬鎂具有與天然骨相似的機(jī)械性能�,其植入體內(nèi)可以釋放鎂離子,促進(jìn)成骨反應(yīng)�,同時(shí)也可以完全降解成無毒物質(zhì)排出體外,并已被證明是一種有潛力的骨替代材料���。當(dāng)前鎂金屬的研究側(cè)重于制備鎂合金材料或構(gòu)建其他保護(hù)涂層以增強(qiáng)鎂金屬的抗腐蝕性能���。鎂合金主要通過添加不同含量的鈣�、鋁�、鍶、鋅等元素進(jìn)行冶煉而得到�,可以通過調(diào)節(jié)鎂合金的相分布、晶粒尺寸和微觀結(jié)構(gòu)���,在短期內(nèi)保持良好的力學(xué)性能���,而且在一定程度上可以控制生物降解,提高了鎂合金的抗腐蝕���、力學(xué)性能和生物相容性。目前主要的商業(yè)鎂合金可分為 WE 系列(Mg-RE-Zr)�����、ZK 系列(Mg-Zn-Zr)���、EZ 系列(Mg-RE-Zn)�、AM系列(Mg-Al-Mn)�、AE 系列(Mg-Al-RE)和 AZ 系列(Mg-Al-Zn)。Wang 等研究發(fā)現(xiàn) Mg-Zn-Sr 骨釘表現(xiàn)出優(yōu)異的機(jī)械性能�,最大扭矩明顯優(yōu)于高純鎂���,這種材料可以提供足夠的機(jī)械強(qiáng)度,在整個(gè)愈合過程中起到固定作用�,并有效減輕周圍的骨丟失,結(jié)果顯示這種鎂合金骨釘在兔膝關(guān)節(jié)前交叉韌帶重建術(shù)后16周內(nèi)顯著增加了骨髓腔周圍骨量���。
激光金屬熔融 3D 打印技術(shù)可以用來制備 3D 鎂及鎂合金支架材料���,然而由于制備過程中需要特定的高溫條件,因而很難同步細(xì)胞混合打印和涂層生物活性因子���。Yu 等采用激光打印技術(shù)制備多孔鎂合金支架�����,并構(gòu)建氟化鎂涂層以提高支架的抗腐蝕性能�,通過與骨髓間充質(zhì)干細(xì)胞(bone marrow stromalcells, BMSCs)共培養(yǎng)以探討支架的細(xì)胞相容性�����,結(jié)果表明氟化鎂涂層多孔鎂合金支架具有良好的生物相容性�,并能促進(jìn)BMSCs的增殖活性。最近也有研究人員利用擠出式 3D 打印技術(shù)制備 3D 支架模具�,通過鎂及鎂合金金屬熔融填充支架空隙�,最后移除模具材料得到3D多孔鎂及其合金金屬支架�����。Kleger等首先配制了鹽���、表面活性劑和石蠟的打印墨水�����,利用擠出式3D 技術(shù)制備了 3D 支架模具���,之后燒結(jié)制備鹽模具支架通過鎂金屬高溫熔融填充支架孔隙,最后利用鹽浸出的方法制備了孔隙可調(diào)的3D多孔鎂金屬支架�。
1.2 �、3D打印含鎂復(fù)合材料體系
3D 打印含鎂復(fù)合材料體系通常將含鎂材料與高分子聚合物材料進(jìn)行復(fù)合。含鎂材料通過釋放鎂離子一方面降低了炎癥細(xì)胞因子(白細(xì)胞介素-6���、白細(xì)胞介素-1β�、白細(xì)胞介素-10)表達(dá)���,減低巨噬細(xì)胞活性�,抑制了免疫反應(yīng);另一方面鎂離子可以促進(jìn)骨膜干細(xì)胞���、BMSCs和成骨細(xì)胞進(jìn)行成骨分化達(dá)到新骨生成的作用(圖2)���。由天然或合成聚合物組成的生物聚合物已被廣泛開發(fā)用于生物醫(yī)學(xué)應(yīng)用。在 3D打印含鎂復(fù)合材料體系中加入高分子聚合物材料�,如聚乳酸(poly lactic acid, PLA)、聚乳酸-羥基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]���,通常作為含鎂材料的粘結(jié)劑和基體材料���。通過 3D打印的方法將含鎂粉末材料制備成 3D 支架形狀,有利于作為醫(yī)療器械材料進(jìn)行骨缺損修復(fù)���。同時(shí)�,復(fù)合高分子材料可以提高含鎂材料的機(jī)械強(qiáng)度和抗腐蝕性能�,也可以控制降解速率達(dá)到對鎂離子的可控釋放。大量研究表明���,聚合物的酸性降解產(chǎn)物可能造成局部炎癥和感染�,最終可能導(dǎo)致植入失敗�,而且大多數(shù)高分子聚合物具有機(jī)械性能不強(qiáng)�����、親水性較弱�、生物相容性不高等特點(diǎn)���,限制了其在骨修復(fù)中的應(yīng)用���。通過與含鎂材料的復(fù)合,降解產(chǎn)生的氫氧根離子會(huì)導(dǎo)致微環(huán)境中的 pH值升高�����,因而聚合物的酸性降解可以被含鎂材料的堿性降解產(chǎn)物中和���,減低了局部炎癥和感染的風(fēng)險(xiǎn)���。
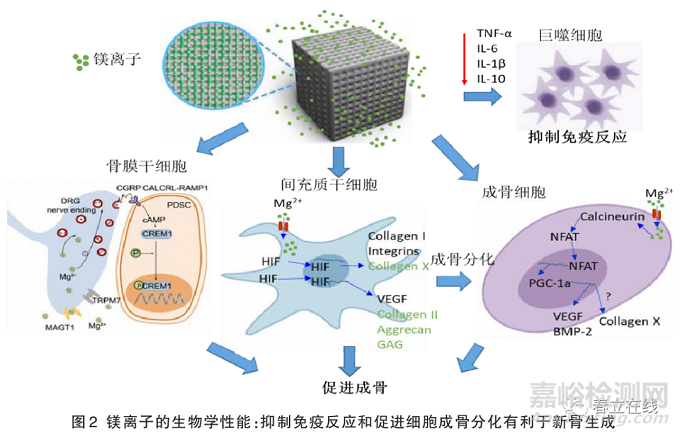
3D 打印含鎂復(fù)合材料體系中含鎂材料主要包括鎂金屬顆粒�、鎂二元化合物、含鎂生物活性陶瓷和生物活性玻璃���。鎂二元化合物主要包含氧化鎂���、過氧化鎂�����、硼化鎂���、硅化鎂等化合物,此類含鎂復(fù)合材料體系因其具備多功能性成為3D骨修復(fù)復(fù)合材料體系的研究熱點(diǎn)�。Lai等通過將PLGA與鎂粉、磷酸鈣混合�����,通過3D打印方式制備出具有合適機(jī)械性能的可降解骨修復(fù)支架(PTM支架)�,并在兔骨壞死模型中評(píng)估了PTM支架的成骨和血管生成特性和植入后的生物安全性。結(jié)果表明�,添加鎂可以緩沖PLGA降解導(dǎo)致的酸性pH,PTM支架同時(shí)具有成骨和血管生成能力�,在促進(jìn)新骨生成和增強(qiáng)骨壞死新生骨的質(zhì)量方面具有協(xié)同作用。因此�,PTM支架是一種很有前途的骨修復(fù)材料,可用于難治愈性骨缺損修復(fù)���,目前該產(chǎn)品已經(jīng)獲批發(fā)明專利作為骨科醫(yī)療器械進(jìn)入臨床轉(zhuǎn)化實(shí)驗(yàn)研究�����。
自首次報(bào)道磷酸鎂基生物陶瓷(magnesium phos?phate cement, MPC)的生物醫(yī)學(xué)應(yīng)用以來���,含鎂生物陶瓷自 20世紀(jì) 90年代以來一直是熱點(diǎn)研究領(lǐng)域���。含鎂生物陶瓷主要包含磷酸鎂、磷酸鈣鎂和硅酸鎂化合物�。與傳統(tǒng)的磷酸鈣生物陶瓷相比,MPC 具有更短的自凝時(shí)間和更高的初始抗壓強(qiáng)度�����,在初始階段提供了關(guān)鍵的機(jī)械支撐�。此外,體外和體內(nèi)實(shí)驗(yàn)表明MPC具有良好的生物相容性和更快降解性�����,同時(shí)用鎂摻雜磷酸鈣可顯著增強(qiáng)成骨細(xì)胞的附著和生長�����。Golafshan 等制備了磷酸鍶鎂生物活性陶瓷(Mg-P-Sr)�,通過擠出式3D打印方法制備3D Mg-P-Sr/PCL多孔復(fù)合支架,研究表明該支架釋放鎂和鍶離子協(xié)同促進(jìn) BMSCs 成骨分化為成熟的成骨細(xì)胞和誘導(dǎo)羥基磷灰石的沉積���,并在馬臀部骨缺損模型中發(fā)現(xiàn)復(fù)合支架可以促進(jìn)新骨的生成�����,同時(shí)不會(huì)引起炎癥反應(yīng)���。
1.3、孔隙率和機(jī)械性能
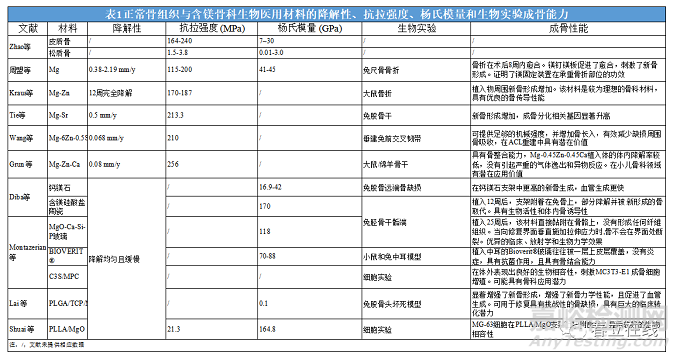
松質(zhì)骨具有互相連通的多孔性結(jié)構(gòu)���,其孔隙率為30%~95%�。眾所周知�����,支架多孔化設(shè)計(jì)可以增加與骨結(jié)構(gòu)的相似性�����,有利于新組織的長入�����,但同時(shí)減低了支架機(jī)械強(qiáng)度。3D含鎂生物醫(yī)用材料作為骨科醫(yī)療器械不僅需要足夠的機(jī)械強(qiáng)度來承受生理重量���,同時(shí)其機(jī)械強(qiáng)度需要與相鄰骨組織匹配�����,避免應(yīng)力屏蔽導(dǎo)致骨吸收和種植體松動(dòng)�。改變支架孔大小���、形狀���、分布和孔隙率可以影響支架機(jī)械性能,如增加孔隙率會(huì)降低抗壓模量���、屈服強(qiáng)度和楊氏模量�。Wen等制備了3D鎂支架材料驗(yàn)證其機(jī)械性能與孔徑和孔隙率的相關(guān)性���,結(jié)果發(fā)現(xiàn)當(dāng)孔隙率為 35%�����、孔徑為250μm時(shí)�,其峰值楊氏模量和應(yīng)力分別為1.8GPa和17 MPa;而當(dāng)孔徑為73μm�、孔隙率為45%時(shí)�����,其峰值楊氏模量和應(yīng)力變?yōu)?.3GPa和16 MPa�����??紤]到松質(zhì)骨的抗壓強(qiáng)度和楊氏模量在0.2~80 MPa和0.01~2 GPa,3D鎂多孔支架正好符合松質(zhì)骨的機(jī)械要求(表1)�,使得鎂適合作為骨科醫(yī)療器械材料。
1.4���、生物腐蝕性能
將純鎂暴露在空氣中會(huì)氧化形成一層灰色的氫氧化鎂薄膜�����。研究表明���,在生理環(huán)境中通過氧化還原反應(yīng)���,鎂會(huì)發(fā)生降解形成氫氧化鎂和釋放氫氣,具體反應(yīng)過程如下所示:
氧化反應(yīng):Mg→Mg2++2e-
還原反應(yīng):2H2O+2e-→H2↑+2OH-
氧化還原反應(yīng):Mg2++2OH-→Mg(OH)2
氫氧化鎂很難溶于水�����,氫氧化鎂與體液或模擬體液的氯離子之間發(fā)生反應(yīng)產(chǎn)生水溶性的氯化鎂���。與生物高分子聚合物(如 PLA)相比�,由于生物腐蝕作用鎂植入材料釋放的鎂離子提高了種植體周圍的 pH值和有利于生物礦化的沉積�����,表明鎂骨科醫(yī)療器械具有一定的骨傳導(dǎo)和生物活性���。通過制備含鎂生物陶瓷和鎂聚合物復(fù)合支架�,一方面發(fā)生生物礦化形成磷酸鈣或磷酸鈣鎂�����,促進(jìn)成骨細(xì)胞生長���,提供骨傳導(dǎo)能力�����;另外一方面由于生物陶瓷和聚合物的加入降低了鎂的腐蝕速率�����。
1.5、生物相容性
鎂為人體必需的營養(yǎng)元素�,同時(shí)也存在于人體骨組織中。鎂雖然具有良好生物相容性�����,但是含鎂植入物釋放的鎂離子可能會(huì)影響周圍的細(xì)胞和組織�����,如釋放過量鎂離子甚至?xí)?dǎo)致全身中毒���。與此同時(shí)�����,鎂合金里含有的其他元素(如鍶和鋁元素)很難排出體外�����,將會(huì)在體內(nèi)沉積會(huì)導(dǎo)致潛在的健康威脅�����,特別是鋁元素需要進(jìn)一步驗(yàn)證其在體內(nèi)的生物安全性���,因?yàn)殇X離子有致阿爾茨海默病的潛在風(fēng)險(xiǎn)���。評(píng)價(jià)含鎂生物醫(yī)用材料的生物相容性有必要研究其細(xì)胞相容性、組織相容性和血液相容性���。細(xì)胞毒性測試可以給鎂離子提供最簡單的生物相容性指標(biāo)���。與國際標(biāo)準(zhǔn)組織(international organization forstandardization,ISO)制訂的細(xì)胞毒性標(biāo)準(zhǔn)測試的體外環(huán)境相比�����,含鎂醫(yī)療器械釋放的鎂離子會(huì)被周圍體液稀釋并迅速擴(kuò)散到循環(huán)系統(tǒng)中�,因此在體外細(xì)胞毒性測試中建議稀釋含鎂植入物的浸體液來模擬體內(nèi)降解產(chǎn)物濃度���。有實(shí)驗(yàn)表明,當(dāng)鎂離子濃度在10 mM 時(shí)對細(xì)胞無任何損傷���,濃度達(dá)到 15 mM時(shí)也考慮是無毒性的(>75% 的細(xì)胞活性)�����。大多數(shù)含鎂生物材料與各種細(xì)胞系具有良好的細(xì)胞相容性���,包括BMSCs�����、骨源性細(xì)胞�、成纖維細(xì)胞、骨肉瘤細(xì)胞���、巨噬細(xì)胞和成骨細(xì)胞���。同時(shí)在各種骨植入模型(豚鼠、大鼠和兔股骨�����、脛骨和尺骨)中表現(xiàn)出良好的細(xì)胞、組織相容性和正常異物反應(yīng)���,同時(shí)鎂離子可以刺激血管內(nèi)皮生長因子�����、血管生成素和其他重要因子的分泌來促進(jìn)血管生成���。
1.6、成骨活性和骨整合性
成人體內(nèi)平均含有1000 mmol 或約24 g鎂�����,其中一半以上的鎂離子儲(chǔ)存在骨組織中���,鎂的推薦膳食攝入量為成年女性320 mg/d�����,成年男性 420 mg/d�。人體缺乏鎂元素可能會(huì)導(dǎo)致很多健康問題,同時(shí)鎂含量不足與低骨量�����、骨生長減少、骨質(zhì)疏松癥和骨骼脆性增加有關(guān)���。Wu等研究了不同鎂離子濃度對成骨細(xì)胞和破骨細(xì)胞的影響,體外研究結(jié)果表明一倍和兩倍稀釋的鎂合金浸體液可以促進(jìn)成骨細(xì)胞的增殖分化和抑制破骨細(xì)胞分化�。在另一項(xiàng)鎂離子補(bǔ)充培養(yǎng)基中培養(yǎng)人骨髓間充質(zhì)細(xì)胞的體外實(shí)驗(yàn)中表明,當(dāng)MgSO4溶液在10 mmol 時(shí)���,細(xì)胞外基質(zhì)的礦化明顯增加,X型膠原蛋白和血管內(nèi)皮生長因子表達(dá)顯著增加(圖2)�����。在體內(nèi)成骨實(shí)驗(yàn)中(表1)�,將多孔鎂合金AZ91D支架植入兔子體內(nèi)骨缺損模型中,3個(gè)月后支架大部分完全降解,同時(shí)未出現(xiàn)骨溶解現(xiàn)象�����,在支架降解周圍檢測到纖維囊形成�����,伴隨著新血管生成���,以及降解部位被新骨生成代替并向內(nèi)生長�。通過組織染色發(fā)現(xiàn)促進(jìn)了種植體附近的新骨生成和骨吸收���,有利于增加骨含量和形成成熟骨組織�����,表現(xiàn)出更優(yōu)異的機(jī)械性能和骨整合能力���。Lai等將3D打印制備的 PLGA/TCP/Mg多孔支架植入兔股骨頭壞死骨缺損中,與對照組PLGA/TCP 支架相比�����,8周后PLGA/TCP/Mg多孔支架組具有更好的促進(jìn)成骨能力。多孔鎂支架表現(xiàn)出良好的生物相容性���、抑制炎癥反應(yīng)���,以及優(yōu)異的成骨活性和骨整合性,這使多孔3D含鎂生物醫(yī)用材料成為骨組織工程中理想的生物材料���。
3D打印含鎂生物醫(yī)用材料的臨床應(yīng)用進(jìn)展
部分含鎂骨科植入式醫(yī)療器械已經(jīng)在德國和韓國獲得轉(zhuǎn)化和臨床應(yīng)用�。目前只有鎂合金螺釘在臨床上得到了應(yīng)用���,3D打印含鎂生物醫(yī)用材料大部分還處于實(shí)驗(yàn)室研究或臨床研究階段���。2013年,Magmaris加壓鎂合金螺釘(Syntellix 公司�,德國,Mg-Y-RE-Zr合金)成為第一個(gè)獲得歐盟CE認(rèn)證的鎂合金骨內(nèi)植入物�。2015年,KMET螺釘(U&I公司���,韓國,Mg-Ca合金)也獲得了韓國食品藥物監(jiān)督管理局的批準(zhǔn)應(yīng)用于手部骨折內(nèi)固定手術(shù)中�����。在國內(nèi),含鎂植入器械的審批與注冊相關(guān)政策已經(jīng)發(fā)布���,但是可降解含鎂器械的耐腐蝕性能�、降解速率可控性和體內(nèi)鎂降解風(fēng)險(xiǎn)評(píng)估標(biāo)準(zhǔn)都是引起關(guān)注的問題�,尚無含鎂植入骨科醫(yī)療器械獲得國家藥品監(jiān)督管理局的批準(zhǔn),其中走在前列的有東莞宜安科技公司的鎂合金金屬螺釘���、上海交通大學(xué)與滬創(chuàng)醫(yī)療科技(上海)有限公司合作的 JDBM 鎂合金骨板和螺釘�,以及由中國科學(xué)院深圳先進(jìn)技術(shù)研究院和中科精誠醫(yī)學(xué)科技有限公司聯(lián)合孵化的3D打印產(chǎn)品含鎂高分子可降解骨修復(fù)材料���,該產(chǎn)品榮獲國家藥品監(jiān)督管理局的創(chuàng)新醫(yī)療器械特別審批認(rèn)定�����,并已完成臨床前注冊檢驗(yàn)�,正處于多中心臨床試驗(yàn)階段�����。
小結(jié)
鎂具有良好的可降解性和生物相容性���,含鎂生物材料(包括鎂及其合金�����、生物陶瓷和聚合物復(fù)合材料)已經(jīng)廣泛研究其作為骨科醫(yī)療器械的潛力�。每一類含鎂材料都有其獨(dú)特的物理化學(xué)特性,同時(shí)展現(xiàn)出相似的生物學(xué)和骨缺損修復(fù)與再生的能力�����。大量基礎(chǔ)研究已驗(yàn)證了鎂離子在體外促進(jìn)細(xì)胞增殖分化���、體內(nèi)促進(jìn)骨再生的重要作用���。盡管大部分含鎂生物材料的抗腐蝕性能和機(jī)械性能都還有待提高,并且限定在非承重骨中的運(yùn)用�����,但新型制備方法和醫(yī)療器械制備技術(shù)為克服上述缺點(diǎn)提供了新的解決途徑�����。3D打印含鎂生物復(fù)合支架不僅提高了其抗腐蝕性能�,還極大提高了其機(jī)械性能,拓展了含鎂生物材料在骨科醫(yī)療器械方面的臨床運(yùn)用�����。大量研究也在拓展鎂的多功能性���,如鎂離子的抗菌性能和鎂納米顆粒的光熱效應(yīng)�����。含鎂復(fù)合材料作為骨替代品�,不僅可以促進(jìn)骨再生�����,還可以預(yù)防骨植入物感染�,因?yàn)榻到猱a(chǎn)生的鎂離子具有殺菌作用。與純聚合物相比�����,負(fù)載有鎂微粒的 PLA復(fù)合材料具有更好的抗菌活性���,改善炎癥反應(yīng)���。鎂顆粒還有優(yōu)異的光熱效應(yīng)���,通過光熱作用可以拓展其潛在的骨腫瘤治療功能。3D打印制備含鎂生物醫(yī)用材料因其具有可控的降解速率�����、材料的安全性�����、合適的機(jī)械性能和多功能特性�,相信在骨科醫(yī)療器械領(lǐng)域能得到更加廣泛的應(yīng)用。




