摘要 目的:討論環(huán)境分離菌在藥品微生物檢驗(yàn)中的應(yīng)用�。方法:通過(guò)對(duì)各國(guó)藥典�、法規(guī)、指導(dǎo)原則���、行業(yè)標(biāo)準(zhǔn)和行業(yè)指南等文件的梳理和分析���,列出了環(huán)境分離菌在藥品微生物檢驗(yàn)中的應(yīng)用建議和要求,并結(jié)合實(shí)例�,進(jìn)一步介紹了環(huán)境分離菌的應(yīng)用范圍����。結(jié)果:各國(guó)藥典和行業(yè)指南均要求或建議在消毒劑效能驗(yàn)證、抑菌效力檢查�、培養(yǎng)基方法適用性(培養(yǎng)基促生長(zhǎng)試驗(yàn))����、檢驗(yàn)方法的適用性���、快速微生物檢驗(yàn)方法和微生物檢驗(yàn)替代方法驗(yàn)證等檢驗(yàn)項(xiàng)目中增加使用環(huán)境分離菌(包括生產(chǎn)檢驗(yàn)過(guò)程中人員�、環(huán)境以及樣品中分離菌)���。結(jié)論:與標(biāo)準(zhǔn)菌株相比,環(huán)境分離菌更能夠反映樣品或環(huán)境實(shí)際存在微生物的情況���,因此�,在藥品微生物檢驗(yàn)中應(yīng)用環(huán)境分離菌能夠使檢驗(yàn)結(jié)果對(duì)產(chǎn)品質(zhì)量或環(huán)境做出更客觀和科學(xué)的評(píng)價(jià)���。可根據(jù)檢驗(yàn)項(xiàng)目、藥品的生產(chǎn)工藝和產(chǎn)品本身的特點(diǎn)�,在風(fēng)險(xiǎn)評(píng)估的基礎(chǔ)上選擇適當(dāng)?shù)沫h(huán)境分離菌應(yīng)用于檢驗(yàn)過(guò)程中����。
藥品微生物的檢驗(yàn)結(jié)果受多種因素影響���,因此���,在藥品微生物檢驗(yàn)中�,為保證檢驗(yàn)結(jié)果的可靠性,必須使用經(jīng)驗(yàn)證的檢測(cè)方法并嚴(yán)格按照藥品微生物實(shí)驗(yàn)室質(zhì)量管理指導(dǎo)原則要求進(jìn)行檢驗(yàn)[1]�。一方面,在對(duì)檢測(cè)方法進(jìn)行驗(yàn)證或確認(rèn)時(shí)�,需要使用菌株來(lái)進(jìn)行相應(yīng)的判斷。例如���,藥品的無(wú)菌檢查、微生物限度檢查���、原輔料的生物負(fù)載檢測(cè)等試驗(yàn)過(guò)程的方法適用性�、培養(yǎng)基適用性試驗(yàn)均需要使用菌株。具體步驟大致為:制備菌液后接種至供試液或培養(yǎng)基�,根據(jù)生長(zhǎng)情況來(lái)對(duì)方法進(jìn)行確認(rèn)�,一些定量方法要求回收率達(dá)到50%~200%,一些定性方法要求判斷生長(zhǎng)情況,一些培養(yǎng)基適用性中需要判斷微生物在培養(yǎng)基上的菌落大小�、形態(tài)特征、指示劑反應(yīng)等情況[1]����。另外一方面���,部分檢驗(yàn)方法的目的是測(cè)定高負(fù)載微生物下降的水平�,評(píng)價(jià)對(duì)微生物的抑制或殺滅作用����,例如抑菌效力檢查�、消毒劑消毒效能驗(yàn)證等�,這些檢驗(yàn)項(xiàng)目亦需要使用菌株[1-2]�。
包括《中華人民共和國(guó)藥典》(以下簡(jiǎn)稱《中國(guó)藥典》)在內(nèi)的各國(guó)藥典中���,一般都規(guī)定使用標(biāo)準(zhǔn)菌種進(jìn)行上述試驗(yàn)[1-4]����。雖然這些標(biāo)準(zhǔn)菌株的應(yīng)用可以使各個(gè)實(shí)驗(yàn)室的結(jié)果在一定程度上具有可比性并且便于在實(shí)驗(yàn)室之間進(jìn)行方法轉(zhuǎn)移確認(rèn),但是又存在另一問(wèn)題�,就是標(biāo)準(zhǔn)菌株無(wú)法代表環(huán)境和樣品中實(shí)際污染的微生物���。因此,各國(guó)藥典指導(dǎo)原則和行業(yè)指南中均提出在進(jìn)行藥品微生物檢驗(yàn)時(shí)應(yīng)增加環(huán)境分離菌的使用����,從而使檢驗(yàn)方法的針對(duì)性更強(qiáng)����。
從本質(zhì)上來(lái)講�,檢驗(yàn)的目的是希望能夠檢出樣品或環(huán)境中可能存在的微生物�,盡可能反映樣品或環(huán)境污染微生物的真實(shí)情況,從而為產(chǎn)品質(zhì)量或環(huán)境的評(píng)估做出客觀科學(xué)的評(píng)價(jià)���。“未檢出”中的假陰性結(jié)果可能會(huì)導(dǎo)致實(shí)際存在污染微生物甚至超標(biāo)的產(chǎn)品放行到市場(chǎng)上威脅人們的健康����,也會(huì)導(dǎo)致不良的生產(chǎn)或檢驗(yàn)環(huán)境未被發(fā)現(xiàn),從而影響產(chǎn)品的質(zhì)量控制����。因此���,環(huán)境分離菌在藥品微生物檢驗(yàn)中的應(yīng)用會(huì)在一定程度上避免假陰性結(jié)果的出現(xiàn)����,使檢驗(yàn)結(jié)果更具針對(duì)性���,更能反映真實(shí)情況�。本文就環(huán)境分離菌在不同檢驗(yàn)項(xiàng)目、檢驗(yàn)過(guò)程中不同環(huán)節(jié)中的應(yīng)用進(jìn)行討論和分析���,并給出環(huán)境分離菌選擇和使用的建議���,希望能夠引起相關(guān)從業(yè)者對(duì)藥品研發(fā)、質(zhì)量控制和監(jiān)管的思考�,在日常工作中酌情考慮環(huán)境分離菌的應(yīng)用,進(jìn)一步保障藥品微生物的檢驗(yàn)方法更具針對(duì)性����,使檢驗(yàn)結(jié)果準(zhǔn)確、可靠�。
一、消毒劑效能驗(yàn)證
消毒劑廣泛應(yīng)用于藥品生產(chǎn)和檢驗(yàn)環(huán)境����,其主要目的是作用于環(huán)境,降低環(huán)境的生物負(fù)載量���。因其主要作用于環(huán)境中的微生物�,各國(guó)藥典���、法規(guī)和指南均要求使用環(huán)境分離菌來(lái)進(jìn)行消毒劑效果的確認(rèn)�,并且都要求根據(jù)消毒劑類型選擇合適的微生物進(jìn)行考察[5]。
美國(guó)藥典第43版的《1072消毒劑和防腐劑》[2]章節(jié)中明確:因?yàn)楦鞣N菌對(duì)不同消毒劑的耐受性都有實(shí)際差異�,因此,在消毒劑管理程序中���,應(yīng)定期使用懸液法����,將環(huán)境監(jiān)控中最常見(jiàn)的分離微生物用于確認(rèn)其敏感性����。為了證明消毒劑對(duì)制藥環(huán)境的效能,應(yīng)進(jìn)行如下試驗(yàn):(1)使用懸液法(篩查不同濃度消毒劑在不同的接觸時(shí)間條件下對(duì)于標(biāo)準(zhǔn)菌株和典型環(huán)境分離菌的消毒效能)�;(2)載體法(將消毒劑置于載體表面作用于一定濃度標(biāo)準(zhǔn)菌株或環(huán)境分離菌一定的時(shí)間���,測(cè)定微生物的lg下降值)�;(3)在新的消毒劑使用前后����,采用統(tǒng)計(jì)學(xué)的方法對(duì)比分離微生物的數(shù)量以及種類出現(xiàn)頻率的變化。
日本藥典第17版《消毒劑和除菌方法》[4]章節(jié)包括了消毒劑效果驗(yàn)證���,其中載體試驗(yàn)的試驗(yàn)菌的選擇要求為:為了評(píng)估消毒劑效果�,除了選擇所列出的標(biāo)準(zhǔn)菌株,應(yīng)選擇1~2株常見(jiàn)的環(huán)境監(jiān)控分離菌����。
美國(guó)食品藥品管理局 (FDA)在2004年發(fā)布的《行業(yè)指南-使用無(wú)菌生產(chǎn)工藝生產(chǎn)的無(wú)菌藥品的現(xiàn)行生產(chǎn)質(zhì)量管理規(guī)范(cGMP)》[6](以下簡(jiǎn)稱FDA2004年無(wú)菌生產(chǎn)工藝指南)在環(huán)境的消毒程序部分也明確要求應(yīng)重視消毒劑對(duì)環(huán)境菌的作用,即日常使用的消毒劑應(yīng)當(dāng)對(duì)從廠房分離的常見(jiàn)微生物有效�。必要時(shí),可以調(diào)查評(píng)估從潔凈區(qū)域中分離的與不良趨勢(shì)相關(guān)的微生物對(duì)該潔凈區(qū)域中所使用的消毒劑的敏感性���。
美國(guó)注射劑協(xié)會(huì)(Parenteral Drug Association����,PDA)第13號(hào)技術(shù)報(bào)告《環(huán)境監(jiān)控計(jì)劃基礎(chǔ)》[7]在清潔消毒程序中明確要求���,應(yīng)使用微生物降低的挑戰(zhàn)試驗(yàn)來(lái)證明消毒程序����。推薦使用來(lái)自環(huán)境監(jiān)控程序所分離的常見(jiàn)微生物對(duì)所選的消毒劑進(jìn)行挑戰(zhàn)試驗(yàn)���,來(lái)證明消毒劑的實(shí)際有效性���。
美國(guó)材料協(xié)會(huì)的《潔凈室消毒劑的評(píng)估標(biāo)準(zhǔn)指南》[8]專門(mén)對(duì)環(huán)境分離菌在消毒劑效果確認(rèn)試驗(yàn)中的使用進(jìn)行了論述,該指南首先指出法規(guī)和監(jiān)管部門(mén)已經(jīng)明確,應(yīng)將環(huán)境分離菌應(yīng)用于消毒劑效果確認(rèn)中�,并引用了FDA2004年無(wú)菌生產(chǎn)工藝指南���。該指南還指出�,沒(méi)有必要包括所有的分離菌,但是有必要在選擇試驗(yàn)菌時(shí)建立有效的基本原則����。其基本原則是使消毒劑的消毒效果能夠達(dá)到控制潛在污染微生物風(fēng)險(xiǎn)的目的�。
二�、 抑菌效力試驗(yàn)
為了防止藥物制劑在正常貯藏或使用過(guò)程中���,因微生物的污染和繁殖使藥物變質(zhì)而對(duì)使用者造成危害,如果制劑本身沒(méi)有充分的抗菌效力�,應(yīng)根據(jù)制劑特性添加適宜的抑菌劑����,尤其是多劑量包裝的制劑����。在添加抑菌劑的同時(shí),應(yīng)考慮到抑菌劑的毒性�,保證用藥安全�。因此���,成品制劑中的抑菌劑有效濃度應(yīng)低于對(duì)人體有害的濃度�,從而達(dá)到“最低”“有效”的目的[1]����。因此,需要在制劑研發(fā)和穩(wěn)定性試驗(yàn)中進(jìn)行抑菌效力檢查�,測(cè)定無(wú)菌及非無(wú)菌制劑的抑菌活性����。抑菌效力檢查方法的基本原理都需要在藥物制劑中加入菌液���,放置一定時(shí)間后再進(jìn)行活菌數(shù)測(cè)定����,根據(jù)菌數(shù)對(duì)數(shù)值的下降來(lái)判斷其抑菌效力�。
《中國(guó)藥典》四部通則《1121抑菌效力檢查法》[1]中明確要求,若需要�,制劑中常見(jiàn)的污染微生物也可作為試驗(yàn)菌株,例如含高濃度糖的口服制劑還應(yīng)該選用魯氏接合酵母為試驗(yàn)菌株����。美國(guó)藥典、歐洲藥典和日本藥典的抑菌效力檢查方法中也有類似的描述���。
洋蔥伯克霍爾德菌�,并將該菌作為挑戰(zhàn)菌應(yīng)用到不同濃度的苯扎氯銨防腐體系中的抑菌效力評(píng)價(jià)���,這表明在特定環(huán)境下的野生菌株對(duì)抑菌劑的耐受性有可能會(huì)高于實(shí)驗(yàn)室培養(yǎng)基菌株���,在進(jìn)行防腐劑或抑菌劑效力評(píng)價(jià)時(shí),應(yīng)考慮加入環(huán)境或樣品中的常見(jiàn)分離菌作為挑戰(zhàn)菌[9]���。
三����、 培養(yǎng)基適用性(促生長(zhǎng)試驗(yàn))
各國(guó)藥典都要求對(duì)微生物檢驗(yàn)用培養(yǎng)基進(jìn)行適用性試驗(yàn)(或稱為促生長(zhǎng)試驗(yàn))���,其目的是確認(rèn)培養(yǎng)基能夠使目標(biāo)微生物生長(zhǎng)���,從而保證在檢驗(yàn)時(shí)能夠檢出實(shí)際可能污染的微生物�。各國(guó)藥典的檢查法中一般都只要求使用標(biāo)準(zhǔn)菌株進(jìn)行培養(yǎng)基促生長(zhǎng)試驗(yàn)�,但是在藥典指導(dǎo)原則和行業(yè)指南中都提出了可以加入環(huán)境分離菌。此處的環(huán)境分離菌可解釋為檢驗(yàn)對(duì)象及環(huán)境可能存在的微生物���,例如基于歷史數(shù)據(jù)的環(huán)境菌庫(kù)中的常見(jiàn)菌���、樣品常見(jiàn)污染菌等。
美國(guó)FDA于1993年發(fā)布《藥品質(zhì)量控制微生物實(shí)驗(yàn)室檢查指南》[10]����,用于指導(dǎo)檢查員對(duì)微生物分析實(shí)驗(yàn)室的檢查。指南中提出���,應(yīng)定期用低水平的微生物對(duì)所制備的培養(yǎng)基進(jìn)行挑戰(zhàn)���,包括使用美國(guó)藥典規(guī)定的指示微生物以及日常環(huán)境菌。
我國(guó)國(guó)家藥品監(jiān)督管理局發(fā)布的《無(wú)菌工藝模擬試驗(yàn)指南(無(wú)菌制劑)》[11]�、FDA2004年無(wú)菌生產(chǎn)工藝指南[6]、PDA第22號(hào)技術(shù)報(bào)告[12]均要求����,在無(wú)菌工藝模擬試驗(yàn)(培養(yǎng)基模擬灌裝)的培養(yǎng)基促生長(zhǎng)試驗(yàn)中���,使用藥典規(guī)定的標(biāo)準(zhǔn)菌株的同時(shí)���,也應(yīng)考慮使用環(huán)境監(jiān)控和無(wú)菌檢查中分離的污染菌����。
美國(guó)藥典43版《1116無(wú)菌生產(chǎn)環(huán)境的微生物控制和監(jiān)控》[2]中提出���,在進(jìn)行環(huán)境監(jiān)控用培養(yǎng)基的促生長(zhǎng)試驗(yàn)時(shí)���,所使用的菌株應(yīng)包括環(huán)境監(jiān)控分離菌。
《中國(guó)藥典》2020年版四部通則《9203藥品微生物實(shí)驗(yàn)室質(zhì)量管理指導(dǎo)原則》[1]和美國(guó)藥典43版《1117微生物實(shí)驗(yàn)室良好操作規(guī)范》[2]對(duì)培養(yǎng)基具有質(zhì)量控制的要求���,在選擇藥典規(guī)定的菌株同時(shí)也可以增加環(huán)境分離菌和產(chǎn)品中常見(jiàn)的污染菌株���。
國(guó)際藥品檢查組織(Pharmaceutical InspectionConvention and Pharmaceutical Inspection Cooperation Scheme,PIC/S)2011年發(fā)布的《無(wú)菌工藝驗(yàn)證的建議》[13]對(duì)培養(yǎng)基的要求中提出�,選擇的培養(yǎng)基應(yīng)能夠支持廣泛的微生物生長(zhǎng),這些微生物可能會(huì)存在于生產(chǎn)環(huán)境中���,應(yīng)基于企業(yè)的環(huán)境菌庫(kù)(例如來(lái)自環(huán)境監(jiān)控的微生物)來(lái)選擇����。
本研究團(tuán)隊(duì)曾經(jīng)在胰酪大豆胨瓊脂培養(yǎng)基(Trypticase Soy Agar,TSA)的質(zhì)控過(guò)程中使用人參土芽孢桿菌[14]���。在日常微生物檢測(cè)過(guò)程中發(fā)現(xiàn)不同廠家的TSA對(duì)某藥用輔料污染微生物的檢出能力經(jīng)常出現(xiàn)較大的差異���,通過(guò)對(duì)污染微生物進(jìn)行分離和鑒定,確定該微生物為人參土芽孢桿菌����。進(jìn)一步研究發(fā)現(xiàn),該菌的生長(zhǎng)受TSA的影響顯著����。與藥典規(guī)定的標(biāo)準(zhǔn)菌株相比,該菌具有更好的篩分能力���,在培養(yǎng)基適用性試驗(yàn)中增加使用人參土芽孢桿菌����,可以提高現(xiàn)行培養(yǎng)基適用性試驗(yàn)結(jié)果的可靠性�。
四、 檢驗(yàn)方法的適用性
目前,各國(guó)藥典在微生物檢驗(yàn)的方法適用性中均未要求使用環(huán)境或樣品分離菌���。但是���,樣品本身的污染菌在檢驗(yàn)條件下能否生長(zhǎng)受到多種因素影響,本研究團(tuán)隊(duì)曾經(jīng)研究屎腸球菌對(duì)復(fù)方胰酶散微生物計(jì)數(shù)方法適用性試驗(yàn)中試驗(yàn)菌生長(zhǎng)的影響����,結(jié)果表明���,使用傾注法時(shí)試驗(yàn)細(xì)菌的回收率偏低�,其原因是樣品本身所含屎腸球菌的生長(zhǎng)導(dǎo)致瓊脂培養(yǎng)基pH值下降�,從而抑制了加入的試驗(yàn)細(xì)菌的生長(zhǎng)[15]。本研究團(tuán)隊(duì)在某中藥顆粒劑的微生物限度檢驗(yàn)時(shí)發(fā)現(xiàn)���,使用平皿法(1mL·皿-1)按照《中國(guó)藥典》規(guī)定的幾株標(biāo)準(zhǔn)菌株進(jìn)行方法適用性均能夠達(dá)到對(duì)回收率(50%~200%)的要求�,但是樣品污染菌的檢出情況各稀釋級(jí)間不能達(dá)到10倍數(shù)量關(guān)系�,懷疑該方法不能有效檢出污染菌,進(jìn)一步使用薄膜過(guò)濾法(1mL·膜-1���,100mL·次-1���,沖洗2次)才能使檢驗(yàn)結(jié)果更能反映樣品的污染情況����。最終選擇使用薄膜過(guò)濾法對(duì)該中藥顆粒劑進(jìn)行微生物限度檢查�。因此,在檢驗(yàn)方法的適用性試驗(yàn)和方法轉(zhuǎn)移確認(rèn)時(shí)����,應(yīng)注意檢驗(yàn)方法對(duì)實(shí)際污染微生物的檢出能力和回收率。
在檢驗(yàn)方法的適用性試驗(yàn)方面�,可以根據(jù)樣品本身特點(diǎn)和容易污染菌的種類,考慮增加環(huán)境分離菌作為方法適用性研究的試驗(yàn)菌����。例如某重組生物制品原液,企業(yè)在原液生物負(fù)載檢驗(yàn)方法的適用性試驗(yàn)中�,除了使用藥典規(guī)定的標(biāo)準(zhǔn)菌株外,還增加了環(huán)境菌株���,包括表皮葡萄球菌(人員分離菌)�,皮氏羅爾斯通氏菌(水系統(tǒng)分離菌)和蘇云金芽孢桿菌(環(huán)境分離菌)���,這樣建立的方法更有利于實(shí)際污染菌的檢出����。
五、快速微生物檢驗(yàn)方法和微生物檢驗(yàn)替代方法驗(yàn)證
FDA2008年發(fā)布的《細(xì)胞和基因治療產(chǎn)品基于快速微生物方法的無(wú)菌檢查方法驗(yàn)證指南》[16]中對(duì)快速微生物檢驗(yàn)方法(Rapid MicrobiologicalMethod�,RMM)驗(yàn)證用菌株進(jìn)行明確要求:應(yīng)根據(jù)RMM在產(chǎn)品和工藝中的性能表現(xiàn)建立一組微生物,應(yīng)包括革蘭氏陰性菌�、革蘭氏陽(yáng)性菌、需氧菌���、厭氧菌���、酵母、霉菌�、原輔料分離微生物����、中間產(chǎn)品分離微生物、環(huán)境監(jiān)控分離微生物���、生產(chǎn)區(qū)域分離代表低營(yíng)養(yǎng)高應(yīng)激環(huán)境的微生物����、生長(zhǎng)緩慢微生物(例如痤瘡丙酸桿菌)����、對(duì)于RMM需要復(fù)雜營(yíng)養(yǎng)的微生物和文獻(xiàn)報(bào)道特定產(chǎn)品類型中常見(jiàn)分離菌等����。
PDA技術(shù)報(bào)告第33號(hào)《新的微生物檢驗(yàn)方法的評(píng)估���、驗(yàn)證和實(shí)施》[17]提到�,應(yīng)根據(jù)每一種驗(yàn)證參數(shù)的評(píng)估選擇有代表性的菌株進(jìn)行試驗(yàn)�。用戶應(yīng)考慮使用應(yīng)激狀態(tài)的微生物。應(yīng)激狀態(tài)的微生物可以根據(jù)實(shí)際情況���,將菌株的培養(yǎng)物暴露于一定環(huán)境條件(例如紫外線����、熱���、冷���、高滲等條件)、抑菌作用(消毒劑����、藥物作用)或亞致死滅菌條件下得到���。在專屬性試驗(yàn)中應(yīng)使用實(shí)驗(yàn)室的標(biāo)準(zhǔn)菌株以及環(huán)境分離菌株,中間產(chǎn)品和無(wú)菌檢查陽(yáng)性分離菌株���,以及生長(zhǎng)緩慢�、苛養(yǎng)���、厭氧和臨床分離菌株���。在將替代方法或快速微生物檢測(cè)方法應(yīng)用到本地實(shí)驗(yàn)室時(shí),在性能確認(rèn)(PQ)環(huán)節(jié)應(yīng)注意使用本實(shí)驗(yàn)室或本企業(yè)的有代表性的環(huán)境分離菌����。
《中國(guó)藥典》2020年版四部通則《9201藥品微生物檢驗(yàn)替代方法驗(yàn)證指導(dǎo)原則》[1]中提到,在微生物定性檢驗(yàn)方法的專屬性試驗(yàn)中����,當(dāng)進(jìn)行控制菌的檢驗(yàn)時(shí)���,還應(yīng)選擇與控制菌有類似特性的菌株作為驗(yàn)證對(duì)象����。美國(guó)藥典43版1223《微生物替代檢驗(yàn)方法的驗(yàn)證》[2]中也提到,在專屬性試驗(yàn)時(shí)����,使用包括一定數(shù)量的能夠代表患者或產(chǎn)品風(fēng)險(xiǎn)的微生物,包括生產(chǎn)環(huán)境分離微生物���、產(chǎn)品污染微生物����。
六�、環(huán)境分離菌的選擇和使用原則
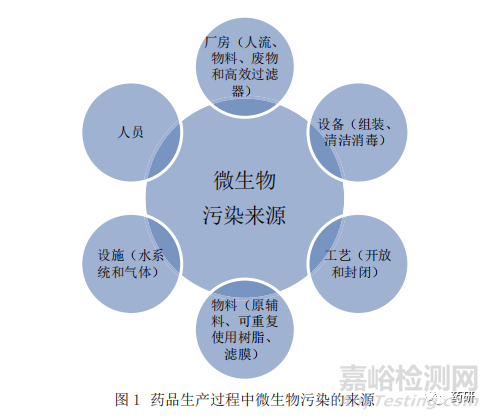
做好環(huán)境菌在藥品微生物檢驗(yàn)中的應(yīng)用,一是應(yīng)建立科學(xué)合理的環(huán)境菌收集����、鑒定和保存方法規(guī)程,建立有代表性的環(huán)境菌數(shù)據(jù)庫(kù)�,并且定期做好數(shù)據(jù)分析和回顧工作。藥品生產(chǎn)過(guò)程中的污染微生物可能來(lái)源于從原輔料到終產(chǎn)品的整個(gè)過(guò)程����,環(huán)境分離菌的選擇應(yīng)充分理解藥品生產(chǎn)工藝以及相關(guān)因素,藥品生產(chǎn)過(guò)程中可能污染微生物的來(lái)源分析見(jiàn)圖1[18]����。本研究團(tuán)隊(duì)在之前發(fā)表過(guò)若干研究論文�,包括環(huán)境菌庫(kù)在制藥行業(yè)的應(yīng)用[19]���、無(wú)菌藥品生產(chǎn)企業(yè)的環(huán)境菌分離和鑒定情況[20]����、制藥環(huán)境用消毒劑對(duì)環(huán)境分離菌殺滅效應(yīng)的比較研究[21]等內(nèi)容���。PDA第13號(hào)技術(shù)報(bào)告[7]詳述了環(huán)境監(jiān)控策略和環(huán)境菌的收集鑒定和分析策略���。當(dāng)然,此處的“環(huán)境菌”并不只是生產(chǎn)環(huán)境分離菌����,還包括原輔料、中間產(chǎn)品���、終產(chǎn)品的生物負(fù)載監(jiān)控或微生物檢驗(yàn)分離的微生物����、終產(chǎn)品無(wú)菌檢查陽(yáng)性和培養(yǎng)基模擬灌裝陽(yáng)性分離微生物等����。
二是應(yīng)根據(jù)檢驗(yàn)項(xiàng)目、藥品的生產(chǎn)工藝和產(chǎn)品本身的特點(diǎn)�,在風(fēng)險(xiǎn)評(píng)估的基礎(chǔ)上選擇適當(dāng)?shù)沫h(huán)境分離菌應(yīng)用于適當(dāng)?shù)臋z驗(yàn)過(guò)程中[18]。有的檢驗(yàn)項(xiàng)目用于分析高負(fù)載條件下微生物數(shù)量下降的情況���,例如抑菌效力試驗(yàn)����、消毒劑效能驗(yàn)證試驗(yàn)等���;有的檢驗(yàn)項(xiàng)目是分析低負(fù)載水平條件下的微生物的數(shù)量����,例如生物負(fù)載監(jiān)測(cè)�、環(huán)境監(jiān)控、微生物限度檢查等����。在藥品生產(chǎn)工藝和質(zhì)量控制的不同環(huán)節(jié),對(duì)分離微生物有不同的應(yīng)用�。例如,某企業(yè)在環(huán)境菌年度分析中發(fā)現(xiàn)���,在每年的春夏季在潔凈區(qū)的環(huán)境監(jiān)控之中會(huì)出現(xiàn)霉菌的檢出���,而在別的季節(jié)則沒(méi)有發(fā)現(xiàn)霉菌���。那么,在對(duì)分離的霉菌進(jìn)行分離和鑒定之后���,可以將霉菌應(yīng)用于目前使用的消毒劑的效能驗(yàn)證����,以研究目前的消毒劑使用和清潔消毒規(guī)程是否對(duì)這種霉菌仍然有效�。當(dāng)然,該霉菌亦可用于環(huán)境監(jiān)控的培養(yǎng)基的促生長(zhǎng)試驗(yàn)�,以證明目前的環(huán)境監(jiān)控方法能夠在低負(fù)載水平情況下檢出這種霉菌。
三是根據(jù)微生物數(shù)據(jù)偏差(Microbial DateDeviation����,MDD)調(diào)查結(jié)果,將分離微生物應(yīng)用于相應(yīng)的檢驗(yàn)之中[18]����。例如,某非無(wú)菌藥品的終產(chǎn)品微生物限度檢出過(guò)程中分離出一株不可接受微生物陰溝腸桿菌���。如果經(jīng)過(guò)調(diào)查該株微生物是來(lái)源于某輔料���,則應(yīng)將該菌應(yīng)用于輔料檢驗(yàn)的培養(yǎng)基適用性試驗(yàn)之中。如果經(jīng)過(guò)調(diào)查發(fā)現(xiàn)該株微生物室來(lái)源于生產(chǎn)過(guò)程中的人員����,則應(yīng)將該菌應(yīng)用于人員的表面微生物監(jiān)控培養(yǎng)基的適用性試驗(yàn)之中。
七�、 結(jié)論
一般來(lái)說(shuō),各國(guó)藥典要求在藥品微生物檢驗(yàn)中使用標(biāo)準(zhǔn)菌株來(lái)進(jìn)行方法驗(yàn)證或結(jié)果判斷����。但是,藥典指導(dǎo)原則和行業(yè)指南中又要求或建議在微生物檢驗(yàn)中增加使用環(huán)境分離菌(包括生產(chǎn)檢驗(yàn)過(guò)程中人員�、環(huán)境以及樣品中分離菌)。與標(biāo)準(zhǔn)菌株相比����,環(huán)境分離菌更能夠反映樣品或環(huán)境實(shí)際存在微生物的情況,使檢驗(yàn)結(jié)果能夠?qū)Ξa(chǎn)品質(zhì)量或環(huán)境做出更客觀和科學(xué)的評(píng)價(jià)���。本文就環(huán)境菌在消毒劑效能驗(yàn)證����、抑菌效力檢查、培養(yǎng)基方法適用性(培養(yǎng)基促生長(zhǎng)試驗(yàn))�、檢驗(yàn)方法的適用性、快速微生物檢驗(yàn)方法和微生物檢驗(yàn)替代方法驗(yàn)證等方面的應(yīng)用進(jìn)行了各國(guó)藥典和指南的綜述�,并提出了環(huán)境分離菌的選擇和使用原則。希望本文能夠引起藥品研發(fā)���、檢驗(yàn)���、監(jiān)管和質(zhì)量控制人員的對(duì)環(huán)境分離菌作用和應(yīng)用的思考,在風(fēng)險(xiǎn)評(píng)估的基礎(chǔ)上考慮環(huán)境分離菌的應(yīng)用�,使藥品微生物檢驗(yàn)結(jié)果更具針對(duì)性、能夠反映實(shí)際污染情況����、能夠反映生物負(fù)載的實(shí)際下降情況,使藥品微生物檢驗(yàn)更好的服務(wù)于藥品的質(zhì)量控制�。