摘 要 / Abstract
本文通過對蘇合香的基原���、產(chǎn)地加工���、代用品以及標準相關問題進行整理和研究�,對蘇合香的標準提出制修訂建議���;同時對進口藥材的質(zhì)量、標準以及監(jiān)管問題進行梳理���,結(jié)合進口藥材的管理與應用現(xiàn)狀,探討進口藥材的質(zhì)量管控措施及監(jiān)管建議����,為我國進口藥材的發(fā)展提供參考���。
Based on research of the origin,production and processing,substitutes and quality standards of styrax,this paper puts forward suggestions for the formulation and revision of styrax standards.At the same time,research is conducted on the quality,standards and regulatory issues of imported medicinal materials.Based on the current situation of management and application of imported medicinal materials,the authors provide suggestions for quality control and supervision of imported medicinal materials,hoping to promote development of imported medicinal materials in China.
關 鍵 詞 / Key words
蘇合香����;基原����;質(zhì)量標準�;進口藥材���;監(jiān)管
styrax; origin; quality standards; imported medicinal materials; supervision
蘇合香作為重要的樹脂類藥材����,自古就是非常有名的進口香藥,進入中國已有兩千多年����,為金縷梅科植物蘇合香樹Liquidambar orientalis Mill.的樹干滲出的香樹脂經(jīng)加工精制而成�,為半流動性的濃稠液體[1]����。蘇合香作為重要的進口藥材����,主產(chǎn)于土耳其南部���、敘利亞等地區(qū),現(xiàn)我國廣西����、云南亦有引種[2]���。《本草綱目》中闡釋:“蘇合香氣香竄���,能通諸竅臟腑���,故其功能辟一切不正之氣[3]�。”時至今日�,蘇合香大多用于配伍開竅止痛之中成藥�,如蘇合香丸����、冠心蘇合丸�、麝香保心丸�、十香返生丸����、心舒膠囊等���。
目前,我國進口藥材品種約110種[4]�,作為中藥材資源的重要組成部分�,同時也是中醫(yī)臨床用藥調(diào)劑和制劑不可缺少的重要部分[5]���,隨著中藥產(chǎn)業(yè)及中藥制劑工業(yè)的飛速發(fā)展,人民群眾消費水平的提高和保健理念的增強���,其進口貿(mào)易體量增速迅猛,其中進口金額較多的品種有龍眼肉����、甘草����、人參�、乳香�、沒藥及血竭等[6-7]���。隨著進口藥材貿(mào)易體量的增加,其市場供應一方面受國際環(huán)境影響���,一些藥材通過非正規(guī)途徑進入我國,擾亂了市場供應秩序����,如乳香���、沒藥、血竭等����;另一方面�,由于進口渠道的改變以及市場的惡性競爭���,生產(chǎn)加工過程不清���,摻偽摻假時有發(fā)生���,現(xiàn)有的進口藥材標準體系可能無法對質(zhì)量下降或不合格藥材進行有效檢驗與監(jiān)管�。
為加強對進口藥材的監(jiān)督管理�,解決進口藥材亂象���,保障進口藥材質(zhì)量���,新修訂的《進口藥材管理辦法》(以下簡稱《辦法》)自2020年1月1日起開始實施����,全面落實“放�、管���、服”的改革要求,對進口藥材的申請�、審批����、備案���、口岸檢驗及監(jiān)管等各方面提出了新的要求���。一方面�,鼓勵藥材進口����,將審批下沉����,簡化程序?��!掇k法》取消了“允許藥材進口的邊境口岸,只能進口該口岸周邊國家或者地區(qū)所產(chǎn)藥材”的限定����,促進了優(yōu)質(zhì)藥材貿(mào)易便利化�,更便捷地惠及廣大制藥企業(yè)和人民群眾����;對進口藥材實施“首次進口”和“非首次進口”分類管理����,公布的最新版《非首次進口藥材品種目錄》中收錄了93 種非首次進口藥材品種[8]���。對非首次進口藥材進口管理進行簡化���,無需審批,只需備案即可�;將首次進口藥材的審批和檢驗權(quán)限下放至申請人所在地省級藥品監(jiān)督管理部門和省級藥品檢驗機構(gòu)����。《辦法》實施后�,預計首次進口藥材的審批時間將會縮短至20個工作日�,在省級藥品監(jiān)督管理部門即可辦理,極大刺激了中藥材的進口貿(mào)易�。另一方面����,要嚴格藥材執(zhí)行標準���,加強全過程監(jiān)管和溯源管理。為落實“四個最嚴”要求�,推進進口藥材的管理,保證進口藥材質(zhì)量�,《辦法》要求標準執(zhí)行順序為現(xiàn)行版《中國藥典》標準����、進口藥材標準�、其他國家藥品標準���、省(自治區(qū)�、直轄市)藥材標準���;同時�,針對無法定標準的進口藥材����,取消了“無法定標準的進口藥材����,自擬藥材標準”,應按照首次進口藥材進行注冊申報���。這一系列的措施是響應“一帶一路”號召,體現(xiàn)“互聯(lián)互通”精神����。
1����、蘇合香的相關問題和標準修訂有關建議
1.1 基原���、生產(chǎn)加工問題及代用品研究情況
歷版《中國藥典》規(guī)定“蘇合香”為金縷梅科植物蘇合香樹Liquidambar orientalis Mill.的樹干滲出的香樹脂經(jīng)加工精制而成�,主要產(chǎn)于土耳其西南部等地���。《美國藥典》(United States Pharmacopoeia�,USP)規(guī)定“蘇合香”來源于蘇合香樹Liquidambar orientalis Mill.和同屬植物北美楓香Liquidambar styraciflua L.的樹脂����。其中北美楓香主要產(chǎn)自于中美洲�、北美洲的洪都拉斯和墨西哥等地�。然而由于資源緊缺�,品種瀕危,出于環(huán)境�、健康、文化及國際公約等原因����,2011年土耳其海關出口管理制度中明確規(guī)定禁止出口目前《中國藥典》中規(guī)定的蘇合香Liquidambar orientalis Mill.品種。
《非首次進口藥材品種目錄》中規(guī)定蘇合香的產(chǎn)地為:英國�、土耳其、埃及����、印度尼西亞�?��!斗显u估審查要求及有傳統(tǒng)貿(mào)易的國家或地區(qū)輸華食品目錄》規(guī)定蘇合香的輸華國家和產(chǎn)地為:洪都拉斯����、新加坡���、印度尼西亞和英國���。中國食品藥品檢定研究院中藥民族藥檢定所于2019年對河北省安國市����、安徽省亳州市等國內(nèi)中藥材市場以及國外市場流通的“蘇合香”進行了調(diào)研���、樣品收集和檢測����,發(fā)現(xiàn)目前市場上大多數(shù)“蘇合香”產(chǎn)品為北美楓香在洪都拉斯的加工品,一些進口到我國的“蘇合香”為了符合《中國藥典》蘇合香的來源規(guī)定����,在名稱和產(chǎn)地上人為標識“土耳其產(chǎn)蘇合香”,且據(jù)調(diào)研結(jié)果可知目前洪都拉斯為全球最大的蘇合香生產(chǎn)加工基地�。因此,目前我國市場流通的“蘇合香”實際上大多來源于北美楓香Liquidambar styraciflua L.���。由于本品為植物的樹脂加工品���,同屬植物其樹脂成份相近,且各地有不同的采收和加工工藝����,因此很難通過其樹脂加工品鑒定基原�。
楓香樹屬Liquidambar L.植物歸屬于金縷梅科(Hamamelidaceae)楓香屬亞科(Subfam.Liquidambaroideae Harms)。該屬植物共有5個種及1個變種�,其中我國有2個種及1個變種,分別為楓香樹���、缺萼楓香樹和山楓香樹;小亞細亞的1個種為蘇合香樹���;北美洲及中美洲(如洪都拉斯)均為北美樹種名為北美楓香����。目前���,國內(nèi)外研究較多的楓香樹屬植物為楓香樹���、蘇合香樹以及北美楓香�。國際報道中����,在蘇合香的基原問題上,諸多文獻認為蘇合香樹Liquidambar orientalis Mill.和同屬植物北美楓香Liquidambar styraciflua L.均為蘇合香樹脂的來源�,并對二者的化學成份進行了分析比較[9-13]。在國內(nèi)的報道中���,李蓓等[14]將楓香Liquidambar formosana Hance的系列加工產(chǎn)品(楓香脂生藥、精制楓香脂以及楓香脂揮發(fā)油)作為蘇合香的代用品�,并對其進行了藥效學評價����。通過比較可知,進口蘇合香和代用品均能在一定程度上提高小鼠的心肌耐缺氧能力����,其中精制楓香脂和楓香脂揮發(fā)油的效用最強�;精制楓香脂對體外血栓干重的抑制率的作用強于蘇合香���,并且精制楓香脂及楓香脂揮發(fā)油對提高冠脈流量的作用強度及作用維持時間均優(yōu)于蘇合香。
1.2 蘇合香的標準收載情況
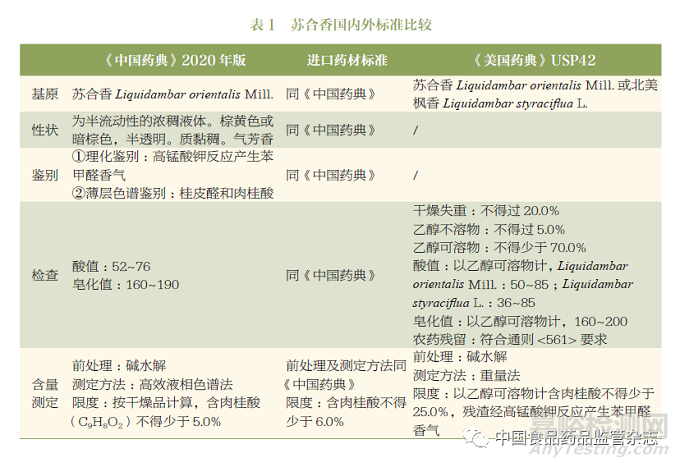
蘇合香現(xiàn)收載于《中國藥典》2020 年版一部及進口藥材標準和《美國藥典》USP42。綜合來看����,主要包括基原�、性狀����、鑒別���、檢查和含量測定。其中�,《中國藥典》及進口藥材標準基本一致;而《美國藥典》較《中國藥典》多增加了北美楓香Liquidambar styraciflua L.這一基原���;三個標準最大的區(qū)別在于含量測定的限度以及測定方法不一致,具體詳細信息見表1���。
1.3 蘇合香標準問題研究及修訂建議
從表1可知����,三個標準主要的問題在于:①基原����;②含量測定指標的專屬性以及限度的合理性����。
首先,考慮到國內(nèi)需求和資源利用問題�,筆者建議在開展相關研究的基礎上�,可增加“北美楓香Liquidambar styraciflua L.”作為蘇合香的第二基原���。
其次,針對標準中含量測定的肉桂酸的限度問題�,按照《中國藥典》2020年版的含量測定方法,對蘇合香樣品進行測定法分析�,結(jié)果發(fā)現(xiàn),堿水解后肉桂酸的含量測定結(jié)果均遠高于5%的限度要求�,因此,目前《中國藥典》2020年版的蘇合香標準中的肉桂酸的含量限度是值得商榷的。
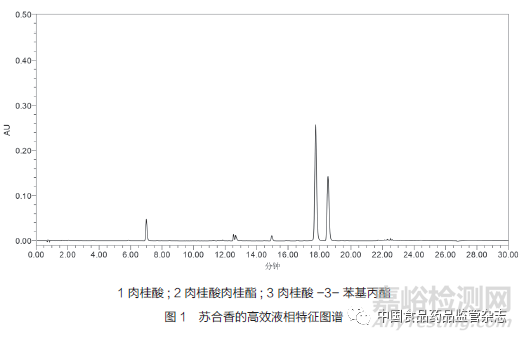
最后���,對于標準中含量測定的指標選擇問題����,上述標準中均采用堿水解的方式測定水解后的總?cè)夤鹚岬暮?���,這種測定轉(zhuǎn)化后的成份而不是選擇測定原型成份的做法無法體現(xiàn)蘇合香的成份類型,且質(zhì)控指標單一且專屬性不強����,可能會出現(xiàn)企業(yè)為滿足《中國藥典》的標準而摻偽摻假。通過對蘇合香成份溶解性的研究以及對其物質(zhì)基礎的了解�,對蘇合香進行了特征圖譜的研究,發(fā)現(xiàn)肉桂酸、肉桂酸肉桂酯及肉桂酸-3-苯基丙酯等成份是蘇合香的代表性化學成份����,詳見圖1�。因此����,建議綜合考慮蘇合香標準中含量測定的指標以及前處理方法,增加測定方法的專屬性�。
2、進口藥材的相關問題
2.1 進口藥材質(zhì)量問題
2.1.1 部分品種基原不清����,同名異種���、同種異地現(xiàn)象突出
因進口藥材產(chǎn)地多為其他國家或地區(qū)�,給基原的確定帶來了困難,尤其是部分進口藥材多未收入原產(chǎn)國(地區(qū))的藥典����,使得基原的確定���,尤其是同名異種的藥材更加無法可依�,無據(jù)可循。如樹脂類藥材乳香����、沒藥均屬于多來源品種。此外,中藥強調(diào)產(chǎn)地對藥材質(zhì)量的影響���,相關進口藥材的批準信息一般只有國家或地區(qū)名稱而無具體的產(chǎn)地信息����。如沉香����,同種異地現(xiàn)象嚴重,沉香產(chǎn)地為印度尼西亞、馬來西亞���、越南,而這三個國家和地區(qū)分布著至少20余種沉香屬植物�,由于生態(tài)環(huán)境的不同,使得不同產(chǎn)地的沉香的有效成份存在差異���,進而導致藥材功效與臨床療效有所區(qū)別[15]����。
2.1.2 生產(chǎn)過程不明����,進口渠道復雜���,質(zhì)量管控困難
中藥材全產(chǎn)業(yè)鏈控制涉及諸多環(huán)節(jié),對于保證中藥產(chǎn)品質(zhì)量至關重要���,其中生產(chǎn)和流通是全產(chǎn)業(yè)鏈的重要環(huán)節(jié)����。目前�,我國進口藥材質(zhì)量總體穩(wěn)定,但個別品種出現(xiàn)了質(zhì)量下降���、不合格率較高等情況。進口藥材的生產(chǎn)加工過程一般是由原產(chǎn)國(地區(qū))或中轉(zhuǎn)國(地區(qū))生產(chǎn)加工完成����。一方面,一些藥材進口國家(地區(qū))生產(chǎn)工藝落后����,相關藥材標準缺乏�,存在對出口產(chǎn)品標準制定不規(guī)范、監(jiān)督不達標等問題����,造成加工產(chǎn)品質(zhì)量良莠不齊����。另一方面����,由于國內(nèi)外標準差異、用途差異����、生產(chǎn)力水平限制等因素����,相關產(chǎn)品生產(chǎn)過程不明�,進口渠道復雜,藥材到達我國口岸未必能保持其原有的質(zhì)量水平,尤其是樹脂類藥材,海關工作人員很難憑借藥材外觀性狀或目前的標準檢測確定其產(chǎn)地���。且我國藥材進口企業(yè)以貿(mào)易型企業(yè)為主���,在境外實施生產(chǎn)過程管控和追溯的難度較大����。
2.2 進口藥材標準問題
藥材標準是藥材質(zhì)量檢驗的重要依據(jù)���。進口藥材質(zhì)量研究一度成為各口岸藥檢所技術(shù)創(chuàng)新的先導和重要工作�,進口藥材標準從無到有�,從簡單到逐步完善�,逐漸形成了涵蓋性狀���、鑒別�、檢查���、含量測定的以《中國藥典》為主的多層次標準體系?��,F(xiàn)行進口藥材標準主要有:①《中國藥典》;②《關于頒布兒茶等43種進口藥材質(zhì)量標準的通知》�;③原衛(wèi)生部頒布的相關暫行標準����;④國外藥典標準�。雖然相關標準已經(jīng)逐步完善,甚至包括了采用有效成份或指標成份量化控制的檢驗項目�,但是���,隨著進口藥材貿(mào)易的蓬勃發(fā)展,相關標準的適宜性、專屬性以及規(guī)范性等受到了極大挑戰(zhàn)。
國內(nèi)外標準差異大,且有些國家和地區(qū)生產(chǎn)工藝不發(fā)達����,相關藥材標準缺乏。部分進口藥材未被收入到原產(chǎn)國(地區(qū))的藥典中�,再加上用途差異,使得藥材進口時無法有效控制其來源和質(zhì)量���。以進口的乳香�、沒藥和蘇合香為例,在一些國家和地區(qū)主要被用作香料使用�,而在我國常用于芳香開竅���、活血止痛的中成藥中�。
進口藥材的標準體系有待更新升級�。受儀器����、技術(shù)條件限制����,傳統(tǒng)進口藥材質(zhì)控標準頒布年代久遠,相對落后���,缺乏有效成份或指標成份的量化控制,已經(jīng)不能有效反映當前進口藥材的質(zhì)量�。如朝鮮紅參目前仍執(zhí)行1988年原衛(wèi)生部標準���;高麗紅參含量測定仍采用氨基柱分離����,蒸發(fā)光檢測�,其操作繁瑣,精密度較差。隨著進口藥材品種和需求的不斷變化����,尤其是供藏醫(yī)和維醫(yī)臨床使用的民族藥逐年增加����,部分進口藥材品種雖已被部頒標準收載����,但標準頒布實施后一直未修訂提高���,已不能適應現(xiàn)代醫(yī)藥發(fā)展的要求。此外����,《非首次進口藥材品種目錄》中近60%的品種依據(jù)2004 年制定的《關于頒布兒茶等43種進口藥材質(zhì)量標準的通知》����,該標準執(zhí)行多年�,是否適用目前的情況���,有待商榷�。如土耳其海關管理規(guī)章制度已明確規(guī)定禁止出口目前《中國藥典》中規(guī)定的蘇合香品種����。因此����,蘇合香的來源問題如何確定值得思考�。
2.3 進口藥材的監(jiān)管問題
目前����,進口藥材的監(jiān)管主要由三個部門協(xié)調(diào)監(jiān)管�,在監(jiān)管中容易出現(xiàn)法規(guī)監(jiān)管不協(xié)調(diào),導致制度障礙等問題。如《符合評估審查要求及有傳統(tǒng)貿(mào)易的國家或地區(qū)輸華食品目錄》(以下簡稱《輸華目錄》)公布了我國檢疫準入的 128 種藥材品種及對應產(chǎn)出國[6]����。國家藥監(jiān)局����、海關總署和市場監(jiān)管總局于2020 年發(fā)布了《非首次進口藥材品種目錄》公布了93個藥材品種及對應產(chǎn)地。然而����,以上兩個目錄對中藥材品種及對應產(chǎn)地的規(guī)定存在不一致���,導致部分藥材因為檢疫準入障礙而無法進口。以《非首次進口藥材品種目錄》中的“猴棗”為例�,《輸華目錄》中未規(guī)定沒有檢疫準入國家或地區(qū),因此�,印度猴棗因未列入《輸華目錄》而無法進口�。進口單位如需進口《輸華目錄》以外國家或地區(qū)的進口藥材����,需要依法向海關總署申請,才能獲得注冊準入����,這一限制障礙了進口藥材品種和進口藥材貨源地的增加����,不利于有價值的傳統(tǒng)藥材新品種的引進����。另外,進口藥材的監(jiān)管面臨基原難以確定���、生產(chǎn)過程監(jiān)管困難�、邊境貿(mào)易散亂、政策不適宜���、監(jiān)管力量薄弱等問題�。這些問題都對我國進口藥材的監(jiān)管提出了挑戰(zhàn)����。
3、進口藥材質(zhì)量管控措施及監(jiān)管建議
3.1 加強源頭和生產(chǎn)控制,發(fā)展原產(chǎn)國(地區(qū))道地藥材基地
中藥源頭的質(zhì)量控制是產(chǎn)業(yè)健康發(fā)展的核心���?��!秶宜幈O(jiān)局關于促進中藥傳承創(chuàng)新發(fā)展的實施意見》強調(diào)引導促進中藥材規(guī)范化種植養(yǎng)殖,鼓勵中藥飲片企業(yè)將質(zhì)量保障體系向種植加工環(huán)節(jié)延伸���,從源頭加強質(zhì)量控制。因此����,基于道地性是優(yōu)質(zhì)藥材質(zhì)量形成的核心因素����,對于進口藥材,在原產(chǎn)國(地區(qū))建立道地藥材基地�,規(guī)范性加工生產(chǎn)是確保質(zhì)量的重要舉措[16]����。
目前����,在現(xiàn)有的貿(mào)易和流通模式下����,一部分進口藥材貨源穩(wěn)定���,但另一部分進口藥材的貨源處于“內(nèi)憂外患”的狀態(tài)。要扭轉(zhuǎn)這種局面,緩解藥材資源的供需矛盾���,在原產(chǎn)國(地區(qū))建立道地藥材基地是解決進口藥材貨源、保障進口藥材質(zhì)量的有效途徑。發(fā)展原產(chǎn)國(地區(qū))道地藥材基地最重要的是保證基原的準確性����,規(guī)范生產(chǎn)加工技術(shù),保證藥材質(zhì)量���,對其全過程進行記錄�,建立質(zhì)量追溯系統(tǒng)���,從而減少藥材基原混亂等情況。通過摸索一套原產(chǎn)國(地區(qū))生產(chǎn)道地藥材的全新模式�,掌握科學規(guī)范的進口藥材生產(chǎn)技術(shù),從而減少質(zhì)量不穩(wěn)定或劣質(zhì)藥材混入的情況���。最終實現(xiàn)降低成本����,緩解供需矛盾�,扭轉(zhuǎn)目前部分進口藥材價格暴漲���、質(zhì)量參差不齊等情況,同時也可以實現(xiàn)中藥資源的可持續(xù)利用和保護生態(tài)環(huán)境的需求[17]����。
目前�,我國已有企業(yè)在其他國家或地區(qū)實現(xiàn)種植茯苓���、養(yǎng)殖海馬等;更有企業(yè)為國內(nèi)相關企業(yè)提供優(yōu)質(zhì)的進口藥材原料�,在其他國家或地區(qū)注冊成立相關公司,在當?shù)剡M行血竭等藥材的生產(chǎn)和加工����,極大地降低了藥材的進口成本保證了藥品質(zhì)量[18]�。
2003年世界衛(wèi)生組織(WHO)提出的《藥用植物種植和采集的生產(chǎn)質(zhì)量管理規(guī)范 (GACP) 指南》指明了藥物植物原材料和最終產(chǎn)品安全性和質(zhì)量的決定因素分為內(nèi)部(基原)和外部(環(huán)境���、采集方法、栽培采收和采收后加工及運輸貯藏過程)兩方面���,只有通過規(guī)范化的種植流程和管理才能提供符合國際市場需要的中藥原料�。
3.2 推進信息化追溯體系建設�,強化溯源管理
藥品信息化追溯體系建設是藥品監(jiān)管的新手段���、新任務,關系著醫(yī)藥行業(yè)的長遠發(fā)展���?!兑呙绻芾矸ā芬?guī)定實行疫苗全程電子追溯制度�,新修訂《藥品管理法》規(guī)定國家建立健全藥品追溯制度����,從法律層面明確了藥品追溯制度的法律地位�,強調(diào)了其必要性以及重要性���。信息化追溯體系對于中藥材及中藥飲片的質(zhì)控和監(jiān)管也具有實際意義�。
自2020年1月1日起施行的《進口藥材管理辦法》在進口藥材管理上���,嚴格落實“四個最嚴”要求���,嚴格藥材執(zhí)行的標準���,加強溯源管理。明確國家藥品監(jiān)督管理局根據(jù)需要�,可以對進口藥材的產(chǎn)地、初加工等生產(chǎn)現(xiàn)場組織實施境外檢查����;同時�,明確藥材進口單位應當協(xié)調(diào)出口商配合檢查�。對于進口藥材,為推進信息化追溯體系建設的順利進行����,必須要打通國內(nèi)外的連接通道以及國內(nèi)各環(huán)節(jié)之間的相互協(xié)調(diào)�。
做好信息化追溯體系的前端是數(shù)據(jù)采集與存儲�。在此階段���,最重要的是打通國內(nèi)負責進口藥材的企業(yè)與境外出口商、種植戶之間的連接通道�。相關企業(yè)應提高意識���,明確目前國家對從非法渠道進貨以及售假的處罰力度�,在進口藥材時對藥材的基原以及生產(chǎn)加工環(huán)節(jié)進行深入調(diào)查���,甚至在原產(chǎn)國(地區(qū))建立種植基地���,同時采集進口藥材基本信息并進行存儲,對其進行賦碼����,以保證進口藥材原產(chǎn)國(地區(qū))證明文件的真實性�。尤其是不同產(chǎn)地的樹脂類藥材���,涉及多基原品種和復雜多變的加工過程,很難憑借藥材外觀性狀或目前的標準確定其產(chǎn)地���。因此,進口企業(yè)對進口藥材賦予追溯碼是保證藥材質(zhì)量的重要環(huán)節(jié)����。
做好信息化追溯體系全流程數(shù)據(jù)對接與協(xié)同����。目前,我國對進口藥材的監(jiān)管涉及多個部門�。有效解決監(jiān)管部門之間的數(shù)據(jù)協(xié)同����,與進口商之間的數(shù)據(jù)傳遞,以及進口商與藥品使用����、生產(chǎn)方之間的數(shù)據(jù)對接���,可以使進口藥材的追溯信息在整個產(chǎn)業(yè)鏈中流動起來,真正實現(xiàn)信息可追溯���。如利用追溯碼,本著“一物一碼����,物碼同追”的原則�,查驗進口藥材經(jīng)口岸檢驗是否合格�,核實檢驗報告書復印件和注明“已抽樣”并加蓋公章的進口藥品通關復印件是否真實等���。
開展智慧監(jiān)管�,對進口藥材進行賦碼、掃碼����,并逐步在藥品生產(chǎn)流通全過程實現(xiàn)可追溯���,同時保證追溯數(shù)據(jù)社會公眾可自主查驗����。最終通過信息平臺公開違法違規(guī)情形�,實現(xiàn)社會共治�,真正實現(xiàn)“來源可追、去向可查����、責任可究”的目標�,切實保障公眾用藥安全[19]。
3.3 加強國產(chǎn)品牌培育和產(chǎn)品營銷�,解決供需矛盾
近年來����,我國野生中藥資源破壞較為嚴重���,一些天然藥物資源尤其是國家重點保護的珍惜資源產(chǎn)量相對不足���,很多品種開始大量進口���,或者在原產(chǎn)國(地區(qū))建設中藥材種植基地以補充國內(nèi)用藥需求[20]���。這種藥材外來輸入的現(xiàn)象不僅使一些基原不清����、加工方法不詳����、療效不明的外來藥材擾亂了中藥材市場����,同時�,由于缺乏大樣本���、可重復數(shù)據(jù)的支撐,也不能確定其是否可在臨床進行替代性應用����。此外����,一些品種的境外貨源����,在價格�、數(shù)量等方面比較占優(yōu)勢����,極大地沖擊了國內(nèi)藥材的市場份額���。我國雖然實現(xiàn)了一些品種的引種�,如西洋參等已形成了東北�、華北和西北三大栽培產(chǎn)區(qū)�,但進口西洋參由于具有較高的口碑效應����,市場認可度高于國產(chǎn)西洋參�,說明我國中藥材在品牌培育及產(chǎn)品營銷方面還有較大的提升空間�。
開發(fā)優(yōu)質(zhì)中藥是中藥現(xiàn)代化���、國際化發(fā)展的前提�。一方面���,成功引種的胖大海、西洋參����、藏紅花等藥材�,解決了我國對于這些藥材只能靠進口的問題[21-22]����。但是�,近 20 年以來���,隨著藥品監(jiān)管體系的完善����,為保證引種藥材的質(zhì)量符合國家標準���,具有較好的臨床療效����,國家規(guī)定引種海外藥用植物必須完成植物學�、植物化學、藥理學和毒理學等一系列完整的研究����,需要多學科配合�、難度大����、周期長[23]���。但是針對當前國內(nèi)市場越來越多短缺藥材靠外來輸入以滿足臨床應用的現(xiàn)狀,隨著科學技術(shù)的發(fā)展���,中藥質(zhì)量控制模式的健全�,以及動植物種群生態(tài)適宜性分析技術(shù)為短缺藥材適宜性產(chǎn)地的選擇提供參考����,國產(chǎn)品牌的培育正走上正軌�。以沉香為例����,近年來���,沉香國際需求急劇增加,針對全世界野生沉香資源瀕危�、沉香形成機制不清�、產(chǎn)業(yè)化結(jié)香技術(shù)缺乏等問題���,魏建和[24]等人提出 “白木香防御反應結(jié)香假說”,且在此基礎上開發(fā)了“通體結(jié)香技術(shù)”[25]����,采用此技術(shù)極大地提高了沉香產(chǎn)量,且結(jié)香6個月的沉香藥材可滿足《中國藥典》的規(guī)定[26]���,結(jié)香20個月的沉香品質(zhì)不低于野生沉香[27]����。
3.4 規(guī)范控制標準定位�,推進標準更新升級
要明確藥典標準�、局(部)頒標準�、進口藥材標準的定位�,按照《進口藥材管理辦法》的規(guī)定,進口藥材應當符合國家藥品標準���。對于標準具有不同來源的品種,其標準執(zhí)行的先后順序為:《中國藥典》現(xiàn)行版���、進口藥材標準、其他的國家藥品標準���、相應的省(自治區(qū)、直轄市)藥材標準(進口少數(shù)民族藥材)�。同時按藥典優(yōu)先、時間優(yōu)先����、基原優(yōu)先等原則���,明確收載藥材的原則、標準修訂周期及制修訂程序等�,及時修訂相關藥材國家標準���,解決同名異種、同種異地等問題����。
建議組織建立完整的�、動態(tài)更新的藥材標準數(shù)據(jù)庫。為此���,相關監(jiān)管部門要積極聯(lián)合科研單位結(jié)合各相關品種的基原、生長環(huán)境����、種植���、生產(chǎn)加工���、流通以及原產(chǎn)國(地區(qū))的標準、法規(guī)�、宗教信仰���、貿(mào)易政策等實際情況,考察檢驗方法的專屬性����,檢驗項目的全面性以及質(zhì)控指標的科學性、合理性�、有效性�,提高相關藥材標準的規(guī)范性及可控性。從而研究制修訂進口藥材相關國家藥品標準���,包括部頒藏藥�、部頒維藥����、部頒蒙藥等進口民族藥材標準����,并建立共享機制���,便于使用和管理,為完善進口藥材國家標準體系奠定基礎�。如2020年版《中國藥典》收載的胡黃連為玄參科植物胡黃連 Picrorhiza scrophulariiflora Pennell的干燥根莖�;而《關于頒布兒茶等43種進口藥材質(zhì)量標準的通知》規(guī)定胡黃連為玄參科植物胡黃連Picrorhiza kurroa Royle ex Benth.或西藏胡黃連Picrorrhiza scrophulariiflora Pennell的干燥根莖,目前���,《非首次進口藥材品種目錄》已將其改為與2020年版《中國藥典》一致。因此�,以最新版《中國藥典》為標準�,加強外來輸入短缺中藥材的質(zhì)量監(jiān)管����,是保障當前進口藥材用藥安全的有效途徑。
3.5 提高監(jiān)管法規(guī)適宜性,強化聯(lián)合監(jiān)管效能
目前���,藥材進口涉及的法規(guī)主要包括三大領域:藥品監(jiān)管相關法規(guī)�、動植物檢疫相關法規(guī)、動植物保護相關法規(guī)���。依據(jù)藥材進口工作的特點,監(jiān)管部門分別將原則性法規(guī)規(guī)定和具體的����、可操作的實施性規(guī)定相結(jié)合�,對進口藥材進行監(jiān)管����。在多方協(xié)調(diào)合作監(jiān)管的過程中�,相關監(jiān)管部門應注意隨著中藥產(chǎn)業(yè)的發(fā)展�、進口藥材資源的變化以及國際形勢的動態(tài)及時完善與更新監(jiān)管法規(guī)。
為及時完善與更新監(jiān)管法規(guī)����,提高監(jiān)管法規(guī)適宜性���,提出以下幾點建議:①要及時將《符合評估審查要求及有傳統(tǒng)貿(mào)易的國家或地區(qū)輸華食品目錄》與《非首次進口藥材品種目錄》進行信息對接���,統(tǒng)一并規(guī)范兩個目錄對中藥材品種及對應產(chǎn)地的規(guī)定,防止部分質(zhì)量優(yōu)良藥材因為檢疫準入等障礙而無法進口����。② 要仔細考察并確定相關進口藥材批準信息中規(guī)定的產(chǎn)地信息����,以保證臨床所需進口藥材為準確基原和產(chǎn)地的品種���,解決因無數(shù)據(jù)、無標準而無法確定其是否可以在臨床進行替代性應用����,影響臨床療效的問題�。
要做好監(jiān)管部門的協(xié)調(diào)聯(lián)動�,強化聯(lián)合監(jiān)管效能����。進口口岸藥品監(jiān)督管理部門對接好進口批件的辦理和進口備案工作�;海關部門做好對首次向中國輸入藥材的國家或地區(qū)的產(chǎn)品風險分析����、監(jiān)管體系評估,對已有貿(mào)易的國家和地區(qū)進行回顧性審查����。同時����,做好進口藥材的現(xiàn)場檢疫工作����。多部門協(xié)調(diào)監(jiān)管應建立工作協(xié)調(diào)機制�,避免出現(xiàn)降低監(jiān)管的標準和效率等情況�。①市場監(jiān)管���、海關等部門緊密聯(lián)合,加強協(xié)作���,形成部門工作合力���,對進出口藥品經(jīng)營進行拉網(wǎng)式監(jiān)管,督促企業(yè)認真履行藥品全生命周期管理責任���。② 加強行刑銜接�,督促藥品監(jiān)管部門和藥品檢驗機構(gòu)切實承擔起藥品監(jiān)管責任���,牢牢守住藥品安全底線�;對進出口藥品經(jīng)營中涉嫌犯罪的案件應移送司法機關���,嚴厲打擊����。③高度重視邊境藥品進出口貿(mào)易發(fā)展����,推動地方各級政府強化屬地管理責任���,扛起藥品安全政治責任,營造良好社會氛圍����,及時回應社會關切�。
隨著新版《進口藥材管理辦法》的實施和中醫(yī)藥傳承創(chuàng)新發(fā)展的推進�,以國內(nèi)需求為主體���、國內(nèi)國際資源相互補充的新發(fā)展格局正加快形成�。目前���,進口藥材的監(jiān)管面臨新形勢����、新機遇�、新挑戰(zhàn)�,伴隨著“一帶一路”倡議為中醫(yī)藥事業(yè)提供的新機遇�,在保障人民用藥安全的前提下���,在我國持續(xù)深入推進“放管服”改革背景下�,亟需打破制度障礙�,提升進口藥材貿(mào)易便利性,保障進口藥材可及性���;推進信息化追溯體系建設,保證全產(chǎn)業(yè)鏈的質(zhì)量追溯���;開展進口藥材監(jiān)管規(guī)則和標準的改革創(chuàng)新,從而推動我國進口藥材監(jiān)管更加及時高效�、系統(tǒng)權(quán)威。