今日頭條
上海標新分子膠降解劑獲批臨床��。上科大孵化企業(yè)標新生物開發(fā)的1類化藥GT919膠囊獲國家藥監(jiān)局臨床試驗?zāi)驹S可���。GT919是標新生物的首個分子膠降解劑產(chǎn)品��,擬開發(fā)用于惡性血液腫瘤的治療�����,旨在解決目前臨床上來那度胺類藥物的耐藥性及安全性問題��。標新生物于2020年成立�,并與上科大簽訂超億元合同金額的專利獨家許可協(xié)議。此次也是上科大成果轉(zhuǎn)化項目獲得的首個中國臨床批件�。
國內(nèi)藥訊
1.大冢「布瑞哌唑」在華報產(chǎn)�。大冢制藥5.1類新藥布瑞哌唑片(brexpiprazole)的上市申請獲CDE受理�����。Brexpiprazole是一款非典型抗精神病藥物�����,由靈北制藥和大冢制藥聯(lián)合開發(fā)����,于2015年7月首次獲FDA批準上市,商品名為Rexulti����,用于治療精神分裂癥和作為抗抑郁藥物的輔助療法治療重度抑郁癥(MDD)。Rexulti目前還在治療阿爾茨海默病患者激越的Ⅲ期臨床中獲得積極結(jié)果����,預(yù)計即將向FDA遞交補充新藥申請(sNDA)。
2.信達CLDN18.2靶向ADC獲批臨床����。信達生物靶向CLDN18.2(claudin18.2)的ADC藥物IBI343獲國家藥監(jiān)局臨床默示許可�,擬用于治療晚期惡性實體瘤�����。IBI343可通過與表達CLDN18.2的腫瘤細胞結(jié)合后��,發(fā)生CLDN18.2依賴性ADC內(nèi)化��,并釋放毒素藥物引起DNA損傷�,導(dǎo)致腫瘤細胞凋亡。此外�����,IBI343也具有旁觀者效應(yīng)��,也可通過質(zhì)膜擴散并殺死相鄰的腫瘤細胞����。這是信達獲批進入臨床階段的首款A(yù)DC。
3.石藥TNFR2單抗在美獲批臨床���。FDA批準石藥集團附屬公司NovaRock Biotherapeutics開發(fā)的抗腫瘤壞死因子2型受體(TNFR2)單抗藥物NBL-020的新藥臨床試驗申請����,擬用于晚期實體瘤的治療。TNFR2屬于腫瘤壞死因子受體(TNFR)超家族����,通過多種信號通路維持腫瘤細胞免疫抑制的微環(huán)境,直接或間接促進腫瘤進展��。臨床前研究顯示�,NBL-020單藥或與PD-1抗體聯(lián)用����,均具有積極的抗腫瘤活性和良好的安全性。
4.德睿智藥GLP-1R激動劑獲批減肥臨床��。德睿智藥宣布��,F(xiàn)DA已批準其專有AI制藥平臺Molecule Pro開發(fā)的新型非競爭性GLP-1R激動劑小分子藥物MDR-001臨床許可��,擬開展用于肥胖適應(yīng)癥的臨床試驗��。在早期的糖尿病合并肥胖猴的藥效模型中��,長期給藥結(jié)果顯示MDR-001能有效降糖和降體重����,還能使糖化血紅蛋白(HbA1C)恢復(fù)到健康猴水平�,并顯示出具有治愈早期糖尿病的潛力��。
5.科倫7個在研ADC項目向默沙東授權(quán)�。科倫藥業(yè)控股子公司科倫博泰與默沙東就前者管線中7種臨床前期ADC候選藥物簽署獨家許可和合作協(xié)議。根據(jù)協(xié)議�,默沙東將獲得7款A(yù)DC候選藥物在全球范圍內(nèi)或在中國大陸、香港和澳門以外地區(qū)進行研究��、開發(fā)��、生產(chǎn)制造與商業(yè)化授權(quán)����;科倫博泰將收到一次性合計1.75億美元不可退還的首付款,預(yù)計不超過93億美元的里程碑潛在付款�,以及產(chǎn)品的銷售分成。
國際藥訊
1.吉利德長效HIV新藥獲FDA批準上市�����。FDA批準吉利德長效HIV衣殼抑制劑Sunlenca(lenacapavir)注射液和片劑上市�����,用于聯(lián)合其他抗逆轉(zhuǎn)錄病毒藥物治療多重耐藥人類免疫缺陷病毒(HIV)感染的成人患者。Sunlenca也是首個可為多重耐藥HIV患者提供一年兩次給藥的HIV衣殼抑制劑�。在Ⅱ/Ⅲ期臨床CAPELLA中,Sunlenca聯(lián)合治療在第52周時��,可使83%的患者達到病毒載量檢測不到的標準(<50 拷貝/毫升)��。
2.羅氏CD20/CD3雙抗獲FDA批準上市��。羅氏旗下基因泰克開發(fā)的CD20/CD3雙特異性抗體Lunsumio獲FDA批準上市�,用于治療至少兩線系統(tǒng)治療后復(fù)發(fā)或難治性濾泡性淋巴瘤(FL)患者。在一項Ⅰ/Ⅱ期臨床GO2978中�����,中位隨訪為18.3個月時���,中位緩解持續(xù)時間為22.8個月,完全緩解率為60%����,客觀緩解率為80%。Lunsumio是全球首個CD20/CD3雙抗��,為這類患者提供一種無化療、現(xiàn)貨型的新免疫治療選擇�。
3.KRAS抑制劑獲突破性療法認定。Mirati公司KRAS G12C抑制劑Krazati(adagrasib)獲FDA授予突破性療法認定�����,與EGFR抑制劑cetuximab聯(lián)用�,治療KRAS G12C突變的晚期結(jié)直腸癌患者。在KRYSTAL-1試驗中��,Krazati聯(lián)合cetuximab達到46%的客觀緩解率(ORR��,95% CI:28-66)�����,其中位緩解持續(xù)時間(DOR)為7.6個月(95% CI:5.7-尚無法評估)��,中位無進展生存期(PFS)為6.9個月(95% CI:5.4-8.1)�����。再鼎醫(yī)藥擁有adagrasib在大中華區(qū)的開發(fā)權(quán)益�。
4.Alnylam糖尿病領(lǐng)域RNAi療法報IND。Alnylam公司靶向酮己糖激酶(KHK)的皮下給藥RNAi療法ALN-KHK����,已向加拿大衛(wèi)生部提交了針對2型糖尿病(T2DM)適應(yīng)癥的I/II期臨床試驗申請����。研究表明KHK介導(dǎo)的果糖代謝有助于肝臟脂肪生成和胰島素抵抗�����。Alnylam計劃于明年初開始對健康超重/肥胖志愿者以及患有2型糖尿病的肥胖患者進行I/II期研究���,并預(yù)計在2023年底報告首個人體數(shù)據(jù)�。
5.AAK1抑制劑治療神經(jīng)痛II期臨床失敗��。Lexicon公司口服小分子銜接子相關(guān)蛋白激酶-1(AAK1)抑制劑LX9211用于減輕帶狀皰疹后神經(jīng)痛的II期概念性驗證研究(RELIEF-PHN-1)未達到主要終點���。數(shù)據(jù)顯示,LX9211(200mg)組患者的ADPS(每日疼痛評分)相比基線降低2.42分�����,而安慰劑組則降低1.62分��,不具備顯著性差異(P=0.12)�。臨床中的不良事件(AE)與既往研究一致。Lexicon表示,研究失敗的原因是劑量選擇不當(dāng)��。
6.德國默克與Mersana聯(lián)合開發(fā)新型ADC���。德國默克子公司與Mersana公司達成合作和許可協(xié)議����,利用后者專有的ADC開發(fā)技術(shù)平臺���,合作開發(fā)最多兩個靶標的新型Immunosynthen ADC候選療法�。Immunosynthen ADC能在腫瘤駐留免疫細胞和抗原表達細胞中局部激活STING(干擾素基因刺激蛋白)信號����,釋放先天免疫刺激的抗腫瘤活性;其激活強度比游離激動劑高約40-100倍�����。今年���,Mersana先后與楊森和GSK達成合作�����,總金額超23.6億美元����。
醫(yī)藥熱點
1.牡丹江醫(yī)學(xué)院將更名為牡丹江醫(yī)科大學(xué)。12月23日�,黑龍江省人民政府辦公廳發(fā)布《黑龍江省“十四五”高等學(xué)校設(shè)置規(guī)劃》。其中提出“十四五”期間����,黑龍江省擬規(guī)劃4個高等學(xué)校設(shè)置項目,其中更名大學(xué)項目2項����,包括牡丹江醫(yī)學(xué)院更名為牡丹江醫(yī)科大學(xué)。更名大學(xué)��,將更有利于增強區(qū)域醫(yī)學(xué)科技創(chuàng)新能力��,提升區(qū)域醫(yī)療衛(wèi)生水平�,推動學(xué)校事業(yè)高質(zhì)量發(fā)展。
2.首個“健康上海行動院士科普基地”成立����。12月23日�,上海市五官科醫(yī)院掛牌首批“健康上海行動院士科普基地”�,上海市耳鼻喉健康促進中心成立�����。該中心由王正敏等院士牽頭,將以構(gòu)建全生命周期五官健康管理及科普教育體系,針對重點人群開展重點五官疾病的預(yù)防監(jiān)測工作�����,大力推進五官疾病高質(zhì)量醫(yī)教研協(xié)同發(fā)展��。
3.衛(wèi)健委不再發(fā)布每日疫情信息����。12月25日���,國家衛(wèi)健委官網(wǎng)發(fā)布消息���,宣布從即日起,不再發(fā)布每日疫情信息�,將由中國疾控中心發(fā)布相關(guān)疫情信息,供參考和研究使用��。對此�����,南方醫(yī)科大學(xué)公共衛(wèi)生學(xué)院生物安全研究中心主任趙衛(wèi)表示,此舉不僅表示疫情信息已經(jīng)失去了每日發(fā)布的必要性�����,同樣也能讓有關(guān)部門將更多精力投入到臨床救治等關(guān)鍵環(huán)節(jié)��。
評審動態(tài)
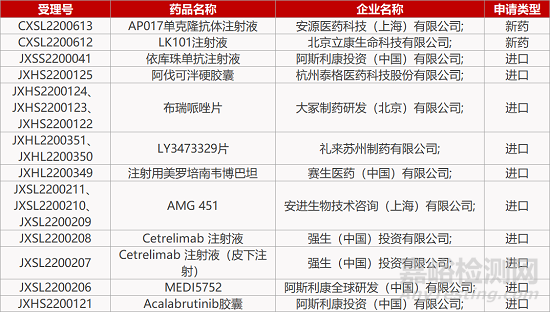
1. CDE新藥受理情況(12月24日)
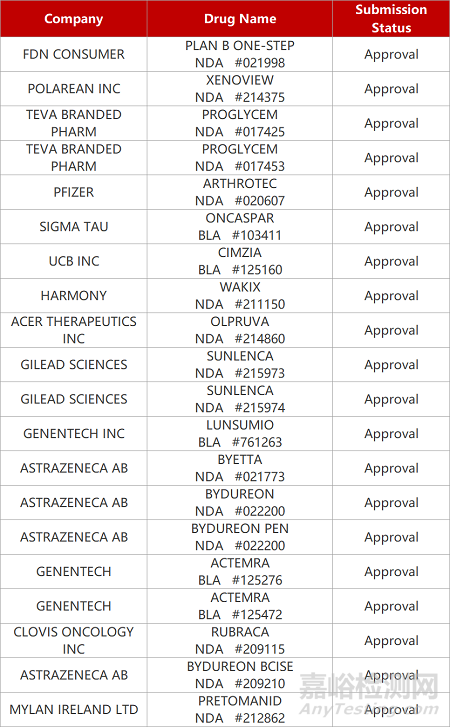
2. FDA新藥獲批情況(北美12月23日)