12月28日���,F(xiàn)DA批準(zhǔn)了TG醫(yī)療公司的Ublituximab(Briumvi),用于復(fù)發(fā)型的多發(fā)性硬化癥(MS)治療�,臨床孤立綜合征、復(fù)發(fā)緩解型疾病和活動(dòng)性繼發(fā)性進(jìn)展性疾病���。這是本年度CDER批準(zhǔn)的第36個(gè)藥物���。
Ublituximab是一種CD20抗體,是一種利妥昔單抗的biobetter�,F(xiàn)DA批準(zhǔn)本品上市是基于兩項(xiàng)針對復(fù)發(fā)性MS患者設(shè)計(jì)的隨機(jī)雙盲試驗(yàn)的研究結(jié)果����。入組試驗(yàn)1的患者分別接受本品(n=274)或特立氟胺(n=275)治療����,兩組分別有88%和92%的患者完成了為期96周的臨床研究。入組試驗(yàn)試驗(yàn)2的患者也分別接受本品(n=272)或特立氟胺(n=273)治療���,兩組分別有93%和88%的患者完成了為期96周的臨床研究�。
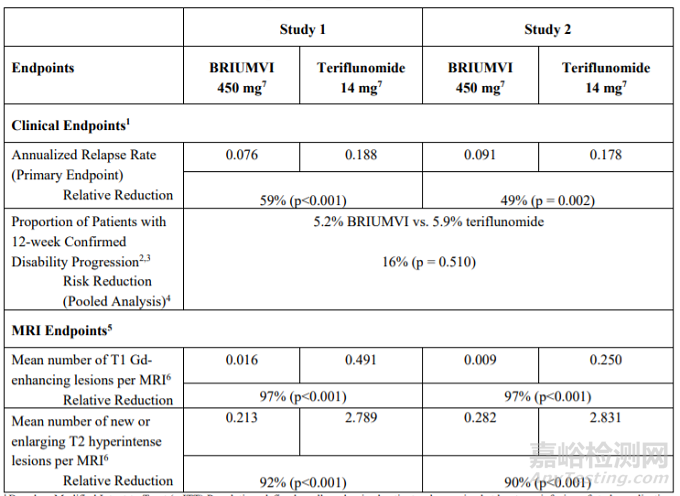
兩項(xiàng)試驗(yàn)的入組患者均在入組前的1年中至少復(fù)發(fā)1次����、前2年中至少復(fù)發(fā)2次、或在前1年中新出現(xiàn)釓(Gd)增強(qiáng)下的可見病灶���,擴(kuò)展的殘疾狀態(tài)量表(EDSS)均處于0-5.5分���。兩項(xiàng)試驗(yàn)的主要終點(diǎn)均為年后復(fù)發(fā)率(ARR)、次要終點(diǎn)為96周時(shí)釓增強(qiáng)核磁顯影下的病灶數(shù)量����、新增或擴(kuò)大的高強(qiáng)度核磁顯影的T2病灶數(shù),以及至少12周內(nèi)疾病進(jìn)展的患者比例。
隨訪結(jié)果顯示���,本品治療組在兩項(xiàng)試驗(yàn)中的ARR分別為0.076和0.091�,而對應(yīng)的特立氟胺治療組分別為0.188和0.176���,本品治療組在兩項(xiàng)試驗(yàn)中的96周平均釓增強(qiáng)核磁顯影下的病灶數(shù)量分別為0.016和0.009���,而對應(yīng)的特立氟胺治療組分別為0.491和0.250,本品治療組在兩項(xiàng)試驗(yàn)中的96周平均新增或擴(kuò)大的高強(qiáng)度T2病灶數(shù)量分別為0.231和0.282����,而對應(yīng)的特立氟胺治療組分別為2.789和2.831,綜合兩項(xiàng)試驗(yàn)的數(shù)據(jù)����,本品和特立氟胺治療組的12周內(nèi)疾病進(jìn)展的患者比例分別為5.2% vs 5.9%。