單克隆抗體藥物在上市批準(zhǔn)之前要經(jīng)過(guò)廣泛的穩(wěn)定性研究,以考察環(huán)境因素(包括溫度�����、濕度����、光照和氧化等)隨時(shí)間變化如何影響產(chǎn)品的質(zhì)量。其中的使用中穩(wěn)定性研究是確保藥物安全性和有效性的重要組成部分[1-2]���。使用中穩(wěn)定性研究是指為保證藥物制劑在一定使用期間內(nèi)的穩(wěn)定而進(jìn)行的試驗(yàn)[3]���。不同的監(jiān)管機(jī)構(gòu)均對(duì)使用中穩(wěn)定性研究作出要求,其中人用藥品注冊(cè)技術(shù)國(guó)際協(xié)調(diào)會(huì)議(International Conference on Harmonization,ICH)Q1A(R2)指出�����,必要時(shí)�����,對(duì)配制或稀釋后使用的制劑應(yīng)進(jìn)行穩(wěn)定性試驗(yàn)�����,可為標(biāo)簽上的配制���、貯藏條件和配制或稀釋后的使用期限提供依據(jù)�。申報(bào)批次應(yīng)在配制和稀釋后的初始和建議的使用期末進(jìn)行穩(wěn)定性試驗(yàn)���,作為正式穩(wěn)定性試驗(yàn)的一部分[4]��。世界衛(wèi)生組織(World Health Organization����,WHO)于2018年更新的《原料藥及藥品的穩(wěn)定性測(cè)試》[5]要求藥物使用中穩(wěn)定性需要盡可能地模擬實(shí)際使用的過(guò)程�����,進(jìn)行藥品使用期間物理、化學(xué)�����、微生物特性等項(xiàng)目的檢測(cè)�;試驗(yàn)至少要2批中試規(guī)模樣品�,并建議其中至少1批在長(zhǎng)期穩(wěn)定性試驗(yàn)的貨架期末進(jìn)行試驗(yàn)?!吨腥A人民共和國(guó)藥典》(以下簡(jiǎn)稱《中國(guó)藥典》)2020年版[6]9402“生物制品穩(wěn)定性試驗(yàn)指導(dǎo)原則”也指出“其他對(duì)于需要復(fù)溶、稀釋的產(chǎn)品�����,應(yīng)根據(jù)具體情況對(duì)使用過(guò)程中涉及的條件設(shè)計(jì)相應(yīng)的穩(wěn)定性試驗(yàn)�����。”
腫瘤免疫靶向治療作為一種新型的治療手段���,改變了晚期惡性腫瘤的臨床治療方式��,也極大地扭轉(zhuǎn)了依賴放療�、化療和手術(shù)等癌癥治療手段的現(xiàn)狀。截至2022年3月�,我國(guó)已批準(zhǔn)上市10余種PD-1/PD-L1抗體藥物,適應(yīng)癥包括黑色素瘤�����、尿路上皮癌�、霍奇金淋巴瘤���、肝細(xì)胞癌�、非小細(xì)胞肺癌等多種腫瘤疾病[7-11]�����。本次研究用的藥品為已上市的其中一種國(guó)產(chǎn)PD-1抗體藥物����,本品首次上市申報(bào)時(shí)采用了代表性時(shí)間點(diǎn)的樣品進(jìn)行使用中穩(wěn)定性試驗(yàn),為了更加全面評(píng)價(jià)本品的使用中穩(wěn)定性開(kāi)展此研究���。
一���、 材料與方法
1.1 樣品
重組人源化抗PD-1單克隆抗體參比品及效期末樣品均為本實(shí)驗(yàn)室留樣�。
1.2 研究方案
參考本品說(shuō)明書(shū)中描述“靜脈輸注時(shí)配制成最終濃度為1 mg·mL-1至3 mg·mL-1的輸注液����;無(wú)菌操作下配制的輸注液,室溫下放置不超過(guò)6小時(shí)���,在2~8 ℃下保存時(shí)間不超過(guò)24小時(shí)”�����,并模擬臨床實(shí)際給藥的情況��,制備低濃度(1.0mg·mL-1)和高濃度(5.0 mg·mL-1)樣品,考察在2~8 ℃和室溫(25 ℃)條件下放置一定時(shí)間��,以及經(jīng)一次性使用無(wú)菌注射器輸注后產(chǎn)品質(zhì)量的變化�����。
1.2.1 低劑量/高劑量使用中穩(wěn)定性樣品的制備
1)從100 mL 0.9%氯化鈉注射液袋中抽取出相應(yīng)體積的0.9%氯化鈉注射液�;將相應(yīng)體積的抗PD-1單克隆抗體注射液注入注射液袋中,輕輕混勻樣品并避免產(chǎn)生氣泡�����,制備低濃度和高濃度樣品,各取樣10 mL作為0 h樣品���。
2)低濃度和高濃度樣品在5 ℃條件下分別放置6���、24 h制備5 ℃-6 h、5 ℃-24 h樣品����,再將5 ℃-24 h樣品放置于室溫(25±2)℃條件下6 h,作為5 ℃-24 h-25 ℃-6 h樣品����。將5 ℃-24 h-25 ℃-6 h條件樣品連接輸液器,重力輸注至結(jié)束并收集流出液�����,混勻后作為5 ℃-24 h-25 ℃-6 h輸注樣品(取樣方案1)��。
3)低濃度和高濃度樣品����,同時(shí)在室溫(25±2)℃光照環(huán)境條件下放置3、6 h作為25 ℃-3 h��、25 ℃-6 h樣品;將25 ℃-6 h條件樣品連接輸液器����,重力輸注至結(jié)束并收集流出液,混勻后作為25 ℃-6 h輸注樣品(取樣方案2)���。
1.2.2 評(píng)價(jià)指標(biāo)
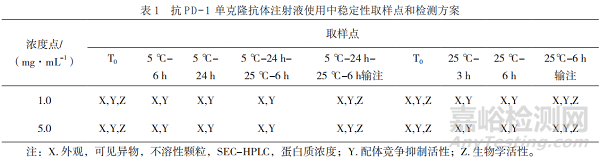
對(duì)模擬臨床使用過(guò)程中不同取樣點(diǎn)的低濃度和高濃度樣品進(jìn)行不溶性微粒和可見(jiàn)異物檢查���,對(duì)蛋白質(zhì)濃度、分子排阻高效液相色譜�、配體競(jìng)爭(zhēng)抑制活性、生物學(xué)活性進(jìn)行檢測(cè)分析(表1)��。
1.3 細(xì)胞
表達(dá)PD-L1的CHO-K1細(xì)胞系(CHO-K1/PDL1)�、轉(zhuǎn)染PD-L1與膜型抗CD3單鏈抗體的CHO細(xì)胞系(CHO/PD-L1-CD3L)���、穩(wěn)定轉(zhuǎn)染PD-1與NFAT反應(yīng)元件控制下的熒光素酶基因的Jurkat 細(xì)胞系(Jurkat/PD-1-NFAT)由中國(guó)食品藥品檢定研究院?jiǎn)慰寺】贵w產(chǎn)品室保存�、傳代�����。
1.4 試劑材料
TSK G3000SWXL 色譜柱(300 mm×7.8 mm�����,5μm)購(gòu)自Tosoh 公司;胰蛋白酶購(gòu)自Gibco公司�;Biotin-PD-L1-Fc、PD-1抗原��、辣根過(guò)氧化物酶標(biāo)記鏈霉親和素為中國(guó)食品藥品檢定研究院?jiǎn)慰寺】贵w產(chǎn)品室留存��。潮霉素B購(gòu)自Roche公司��,遺傳霉素購(gòu)自Gibco公司���;RPMI1640�、F12培養(yǎng)基�、PBS、NEAA均購(gòu)自Gibco公司����;ONE-Glo™熒光素酶檢測(cè)試劑盒購(gòu)自Promega公司;96孔板(白板)�����、96孔板(透明板)購(gòu)自Costar公司�����;十二水合磷酸氫二鈉、二水合磷酸二氫鈉�����、無(wú)水硫酸鈉購(gòu)自國(guó)藥集團(tuán)化學(xué)試劑有限公司�;一次性精密過(guò)濾輸液器(0.2μm�����,PES filter)購(gòu)自山東新華安得醫(yī)療用品有限公司�����,10�����、20 mL一次性使用無(wú)菌注射器購(gòu)自碧迪醫(yī)療器械(上海)有限公司��,0.9%氯化鈉注射液購(gòu)自上海百特醫(yī)療用品有限公司���。
1.5 主要儀器
高效液相色譜儀配有紫外檢測(cè)器及Empower數(shù)據(jù)處理系統(tǒng)(Waters公司)����;SPECTRAM5酶標(biāo)儀(Molecular Device公司)�;紫外分光光度計(jì);CO2培養(yǎng)箱���;生物安全柜�;細(xì)胞計(jì)數(shù)儀���。
1.6 方法
1.6.1 不溶性微粒和可見(jiàn)異物檢查
不溶性微粒采用光阻法分析���,按2020年版《中國(guó)藥典》通則0903檢測(cè)并報(bào)告≥10 μm、≥25 μm的微粒數(shù)��;可見(jiàn)異物按2020年版《中國(guó)藥典》通則0904檢查�。
1.6.2 蛋白質(zhì)濃度
采用紫外-可見(jiàn)分光光度法對(duì)樣品蛋白含量進(jìn)行檢測(cè)��,用樣品稀釋液將供試品稀釋至約0.4mg·mL-1�,檢測(cè)280 nm處吸收度A�,根據(jù)公式計(jì)算蛋白質(zhì)濃度C(mg·mL-1),C=A/ε×DF�����,式中�����,ε為消光系數(shù)(1.42)���,DF為稀釋倍數(shù)。
1.6.3 分子排阻高效液相色譜
用超純水將檢測(cè)樣品稀釋至2.0 mg·mL-1��,采用Waters 2695 HPLC系統(tǒng)�����、2489紫外檢測(cè)器�、TSK G3000SWXL色譜柱進(jìn)行檢測(cè)。流動(dòng)相:50mmol·L-1磷酸鹽緩沖液(NaH2PO4-Na2HPO4)�����,300 mmol·L-1硫酸鈉溶液����,pH 7.0±0.2;流速:0.5 mL·min-1�;上樣量:25μL(2.0 mg·mL-1);柱溫:室溫�;樣品池溫度:4 ℃;檢測(cè)波長(zhǎng):280nm�;檢測(cè)時(shí)間:30 min。利用WATERS 2695 HPLC系統(tǒng)工作站對(duì)實(shí)驗(yàn)結(jié)果進(jìn)行數(shù)據(jù)處理�����,采用面積歸一化法計(jì)算純度�。
1.6.4 配體競(jìng)爭(zhēng)抑制活性
包被PD-1抗原37 ℃孵育1 h�����,洗板3次����;用2%BSA置于37 ℃封閉1 h,洗板3次����;用一定濃度的Biotin-PD-L1-Fc將樣品及參比品以100 μg·mL-1為起始濃度3倍比稀釋11個(gè)梯度,每孔加入100µL��, 37 ℃孵育1 h���;洗板3次�,加入辣根過(guò)氧化物酶標(biāo)記鏈霉親和素置于37 ℃孵育1 h����,洗板6次;TMB 顯色���;450 nm 讀數(shù)����,并以參比品為對(duì)照計(jì)算樣品的相對(duì)活性���。
1.6.5 生物學(xué)活性
用F-12培養(yǎng)基將CHO-PDL1細(xì)胞密度調(diào)整為5×105 cells·mL-1���,每孔100 μL接種于96孔白板中;37 ℃����、5% CO2培養(yǎng)18 h�;將樣品及參比品以120 µg·mL-1為起始濃度3倍比梯度稀釋10個(gè)梯度�,加入去除細(xì)胞上清的CHO-PDL1細(xì)胞板中;再將Jurkat效應(yīng)細(xì)胞密度調(diào)整至2.5×106 cells·mL-1�����,每孔40 µL的細(xì)胞加入細(xì)胞板中�����,37 ℃�、5% CO2培養(yǎng)6 h�;每孔添加100 μL ONE-Glo™熒光素酶,并在SPECTRAM5 酶標(biāo)儀上采用化學(xué)發(fā)光模式進(jìn)行讀數(shù)���,利用四參數(shù)方程進(jìn)行擬合���,對(duì)生物學(xué)活性進(jìn)行分析。
二�、 結(jié)果
2.1 外觀、可見(jiàn)異物和不溶性微粒
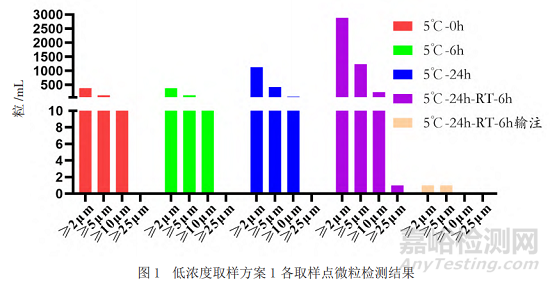
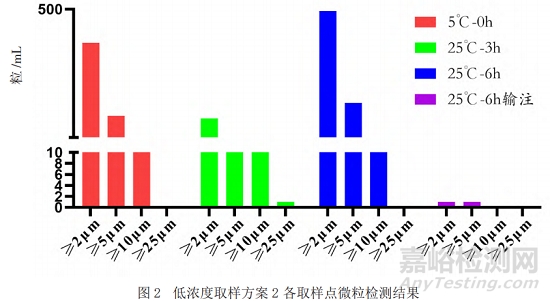
采用目視的方法對(duì)不同取樣點(diǎn)的樣品進(jìn)行檢測(cè)�,結(jié)果顯示均為無(wú)色澄清溶液且無(wú)明顯可見(jiàn)異物。本研究采用光阻法對(duì)不同放置時(shí)間�、不同稀釋濃度的樣品的不溶性微粒進(jìn)行分析���,除常規(guī)的質(zhì)量標(biāo)準(zhǔn)中報(bào)告≥10 μm���、≥25 μm的微粒數(shù)外���,還檢測(cè)了2 μm和5 μm的不溶性微粒。結(jié)果如圖1和圖2顯示(高濃度和低濃度結(jié)果趨勢(shì)一致�,數(shù)據(jù)未呈現(xiàn)),隨著放置時(shí)間的延長(zhǎng)�,不溶性微粒數(shù)呈增加趨勢(shì),但經(jīng)輸液器輸注后樣品的微粒數(shù)明顯減少��。
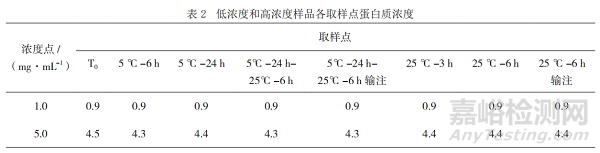
2.2 蛋白質(zhì)濃度
結(jié)果顯示��,低濃度和高濃度樣品各取樣點(diǎn)(含經(jīng)過(guò)輸液器流出的樣品)的蛋白質(zhì)濃度均符合擬定質(zhì)量標(biāo)準(zhǔn)(目標(biāo)濃度±15%)且未發(fā)生明顯變化���,見(jiàn)表2�����,表明本品臨床采用的一次性輸液器對(duì)產(chǎn)品未產(chǎn)生明顯的吸附����。
2.3 分子大小變異體
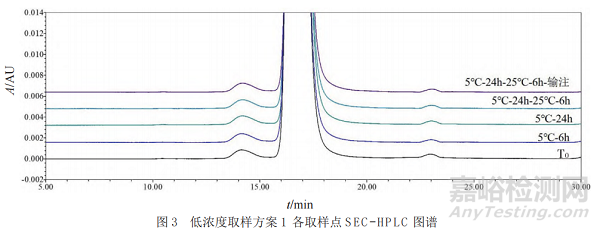
采用SEC-HPLC(方法精密度RSD為0.3%)對(duì)低濃度和高濃度樣品每個(gè)時(shí)間點(diǎn)的分子大小變異體進(jìn)行分析,代表性檢測(cè)圖譜見(jiàn)圖3��,所有取樣點(diǎn)單體的含量均為99.3%�����,聚體含量為0.7%~0.8%�,未檢測(cè)出片段。
2.4 配體競(jìng)爭(zhēng)抑制活性和細(xì)胞生物學(xué)活性
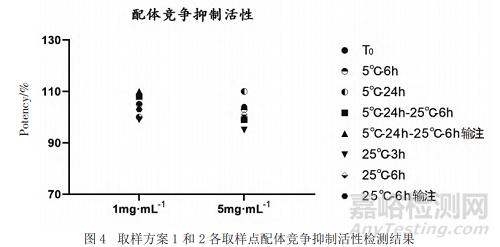
采用ELISA法評(píng)價(jià)的低濃度和高濃度樣品每個(gè)時(shí)間點(diǎn)的配體競(jìng)爭(zhēng)抑制活性�����,結(jié)果顯示����,不同時(shí)間點(diǎn)配體競(jìng)爭(zhēng)抑制活性均滿足擬定質(zhì)量標(biāo)準(zhǔn)(70%~130%)且未見(jiàn)明顯變化(見(jiàn)圖4)���;
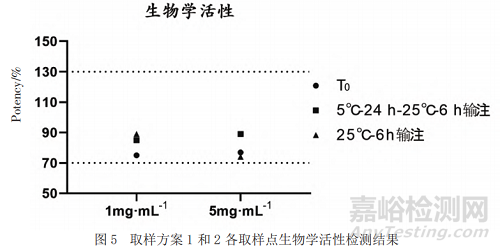
利用熒光素酶報(bào)告基因法檢測(cè)低濃度和高濃度樣品0 h以及不同條件下輸注后樣品的生物學(xué)活性���,結(jié)果顯示均滿足擬定質(zhì)量標(biāo)準(zhǔn)(70%~130%)且未見(jiàn)明顯變化(見(jiàn)圖5)。
三����、 討論
本研究主要通過(guò)理化活性手段評(píng)價(jià)效期末樣品的高�、低2個(gè)濃度的使用中穩(wěn)定性��。結(jié)果顯示�����,不同濃度點(diǎn)在不同時(shí)間點(diǎn)競(jìng)爭(zhēng)結(jié)合活性和生物學(xué)活性未見(jiàn)明顯變化趨勢(shì)����;對(duì)于可能影響效價(jià)和免疫原性的抗體聚體和片段未見(jiàn)增加;不溶性微粒檢測(cè)結(jié)果顯示�,隨著放置時(shí)間的延長(zhǎng),不溶性微粒數(shù)呈增加趨勢(shì)���,但經(jīng)輸液器輸注后樣品的微粒數(shù)明顯減少�,這是由于參照本品說(shuō)明書(shū)���,輸注時(shí)采用了連接0.2 µm過(guò)濾器的一次性精密過(guò)濾輸液器所致���;另外,其他的質(zhì)量屬性(外觀�、可見(jiàn)異物、蛋白質(zhì)濃度)在所有研究條件下也保持較好的穩(wěn)定性。上述研究結(jié)果支持本研究采用的近效期末抗PD-1單抗藥物具有良好的使用中穩(wěn)定性���。
相對(duì)于小分子藥物����,單克隆抗體藥物結(jié)構(gòu)更復(fù)雜并且對(duì)外界環(huán)境更敏感�,在配制和使用過(guò)程的多種因素均可能引起藥物關(guān)鍵質(zhì)量屬性的變化,從而影響產(chǎn)品的穩(wěn)定性[12-15]���;另外�,藥物在配制和使用過(guò)程中還可能受微生物��、細(xì)菌內(nèi)毒素等污染�,影響藥物的無(wú)菌保證水平����,所以嚴(yán)格意義上,除評(píng)價(jià)使用穩(wěn)定性樣品的理化活性類質(zhì)量屬性以外�,對(duì)于需要制備至輸注超過(guò)4 h的,還應(yīng)開(kāi)展微生物挑戰(zhàn)研究評(píng)估單抗注射液經(jīng)稀釋后的促微生物生長(zhǎng)和/或抗菌活性�,以支持稀釋后注射前樣品的貯存。此外����,一般考慮到使用中穩(wěn)定性研究試驗(yàn)應(yīng)能夠模擬最差條件�����,所以建議研究應(yīng)選擇貨架期末的產(chǎn)品進(jìn)行使用中穩(wěn)定性研究�����。但是相關(guān)指導(dǎo)原則[5]中也指出����,實(shí)際申報(bào)時(shí)常因穩(wěn)定性數(shù)據(jù)有限�,無(wú)法獲得效期末的試驗(yàn)數(shù)據(jù),此時(shí)可提供申報(bào)時(shí)長(zhǎng)期穩(wěn)定性的最后一個(gè)時(shí)間點(diǎn)用于使用穩(wěn)定性研究的試驗(yàn)數(shù)據(jù)�。