膠原蛋白是哺乳動物體內(nèi)含量最多����、分布最廣的功能性蛋白,具有止血性能��、生物相容性��、生物可降解性及低免疫原性。近年來被廣泛應(yīng)用于醫(yī)療健康����、食品飲料、護(hù)膚品及其他醫(yī)美行業(yè)中�。目前主流的膠原蛋白提取制備方法包括動物源提取和基因工程法兩大類,但通過動物源提取的膠原蛋白存在病毒����、排異反應(yīng)、細(xì)胞毒性等諸多問題和隱患��。FDA及歐盟均將動物源膠原蛋白在醫(yī)療領(lǐng)域的應(yīng)用產(chǎn)品列入最高等級風(fēng)險予以監(jiān)控����,世界各國也嚴(yán)格限制其進(jìn)出口。尋找一種安全�、有效并具有良好生物功效的膠原蛋白類材料在組織工程�、醫(yī)藥美容等領(lǐng)域受到越來越廣泛的關(guān)注�,因此以基因工程技術(shù)生產(chǎn)的重組膠原蛋白應(yīng)運而生��,成為目前學(xué)界及業(yè)界研究的重點�。
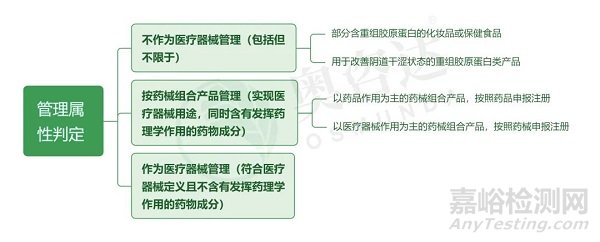
重組膠原蛋白類醫(yī)療產(chǎn)品是以重組膠原蛋白為主要成分�,以醫(yī)療為目的的產(chǎn)品����,隨著市場需求的增多,該類醫(yī)療產(chǎn)品的注冊需求也不斷增多��。根據(jù)國家藥監(jiān)局關(guān)于發(fā)布重組膠原蛋白類醫(yī)療產(chǎn)品分類界定原則的通告(2021年第27號)附件:重組膠原蛋白類醫(yī)療產(chǎn)品分類界定原則�,重組膠原蛋白類產(chǎn)品,依據(jù)產(chǎn)品預(yù)期用途��、作用機制等進(jìn)行綜合判定�,可判定為不作為醫(yī)療器械管理、按藥械組合產(chǎn)品管理或作為醫(yī)療器械管理��。
其中����,作為醫(yī)療器械管理的����,需要根據(jù)產(chǎn)品的材料特性�、結(jié)構(gòu)特征、預(yù)期用途��、適用形式等綜合判定產(chǎn)品管理類別��。重組膠原蛋白類醫(yī)療產(chǎn)品的管理類別應(yīng)當(dāng)不低于第二類�。歸納如下:
(注:圖中已獲證產(chǎn)品舉例僅為參考)
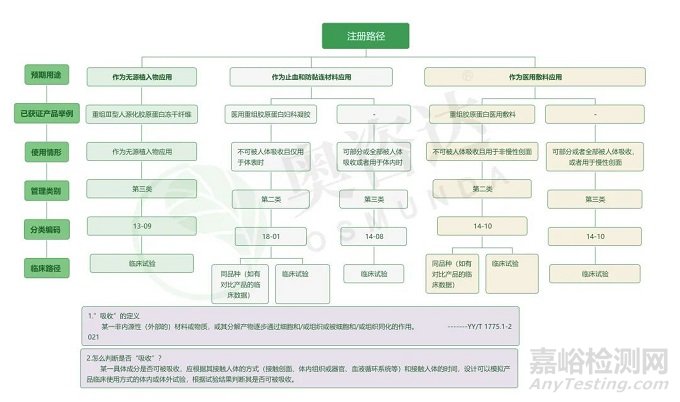
對重組膠原蛋白類產(chǎn)品的監(jiān)管審查旨在評估臨床前和臨床評估產(chǎn)生的科學(xué)證據(jù)所證明的安全性和有效性。按照我國現(xiàn)行的監(jiān)管制度��,當(dāng)下最熱門的“重組膠原蛋白醫(yī)用敷料”是否會被納入III類醫(yī)療器械管理目前尚不明確�,但去年醫(yī)用重組膠原蛋白可吸收敷料已被納入了III類醫(yī)療器械的管轄范圍中。
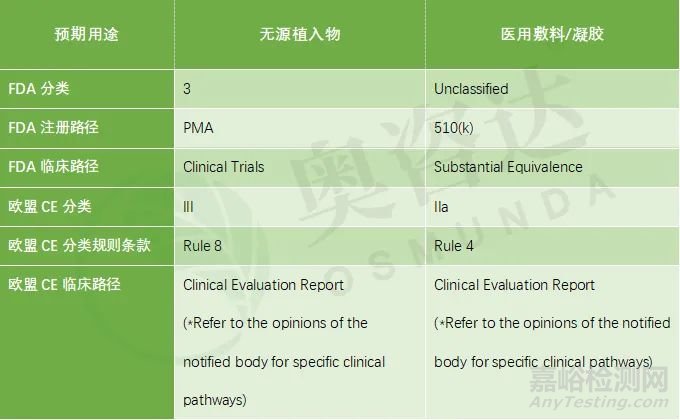
同樣地����,根據(jù)預(yù)期用途及使用方式的不同,重組膠原蛋白類產(chǎn)品分類在FDA及歐盟也有所差異����,分類及注冊路徑大致如下: