前言: 驗證是老生常談的一個話題����,對于已經驗證過的系統���,分析方法,工藝是否需要再驗證����,多長時間驗證或基于什么情況下再驗證?本文針對公共系統���,計算機系統和分析方法總結了各法規(guī)的針對再驗證提出的相關建議。
質量風險管理方式的應用貫穿藥品的整個生命周期����。作為質量風險管理系統的一部分�,驗證及確認范圍和程度的決定應基于經過證明的���、文件記錄的設施���、設備�、公用工程于工藝的風險評估����。既然驗證算是風險管理的一部分并且應該貫穿藥品的整個生命周期�,那么哪些部分需要驗證呢?基于WHO的要求�,驗證包括公共系統驗證(水系統�、HVAC系統)����,分析方法驗證����、清潔驗證����、工藝驗證、計算機系統驗證以及設備的確認���。而歐盟GMP針對包裝和運輸也提出了需要驗證�。有人會問���,驗證和確認到底有什么關系或者有何區(qū)別呢?其實驗證和確認本質上是一個概念���,確認一般針對設備�,儀器和系統而言����,而驗證一般針對工藝或生產過程����。就字面的解釋來看,確認是驗證的一部分���,并且確認應該在驗證實施前完成�。
正如WHO指南中所述:
Relationship between validation and qualification
Validation and qualification are essentially components of the same concept. The term qualification is normally used for equipment, utilities and systems, and validation for processes. In this sense, qualification is part of validation.
WHO指南認為應針對新廠房���,設備,設施和系統�,以及新建立的工藝和規(guī)程,或者出現重大變更時應進行驗證���。那么已經過驗證的公共設施,系統�,分析方法,工藝等����,是否還需要再驗證�?多長時間驗證?何種情況下驗證���?本文針對上述問題���,總結了各法規(guī)中針對HVAC, 水系統�,計算機系統以及分析方法建議的驗證周期以及需要再驗證的情況�。
1�、HVAC系統驗證
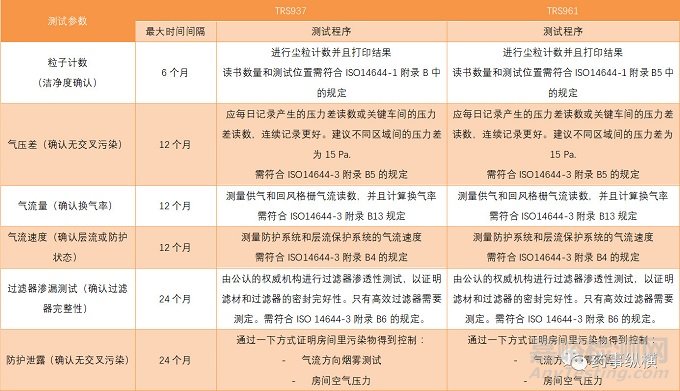
針對HVAC系統�,WHO在2011年出臺了TRS961文件用來代替原來發(fā)布的TRS937文件,在TRS937文件中����, WHO建議對HVAC系統每年進行驗證,驗證的內容包括溫度�,相對濕度,送風量����,回風量或排氣量���,換氣速度����,壓差�,單向流速度���,粒子計數等指標,而對于房間粒子計數���,建議每半年驗證一次���。而TRS961文件中建議的驗證周期刪除了���,表明測試周期應該基于在風險評估的基礎上由生產商定奪����,并且建議當影響到該系統性能的變更出現時應該進行再驗證。WHO于 2018年最新發(fā)布的TRS 1010文件中建議應基于風險���,設施類型���,產品���,以及變更的范圍和影響等方面考慮再驗證的實施�,該文件還未取代TRS961文件,小編認為原來建議的驗證周期還是有一定參考價值的�。
新舊文件對比

2�、水系統驗證
WHO出臺的TRS970 針對WPU驗證要求,將制藥用水分為BPW, BHPW和BWFI等不同類別的水質�,并且較最開始的文件收窄了對水系統的驗證周期,要求在第一階段時�,每天連續(xù)對飲用水連續(xù)采樣持續(xù)2周以監(jiān)測其水質。第二階段在第一階段得到滿意結果的條件下�,繼續(xù)采樣2周���,如果檢測結果仍能達到既定標準�,則該水可以用作FPP的生產�。第三階段是基于第二階段檢測結果滿意的條件下���,水系統運行一年再檢測���。在第三階段檢測結果仍滿意的條件下�,WHO建議對水系統應采取系統性回顧,包括如對水機產水�,總送水點���,總回水點���,用水點水質進行趨勢分析���,并制定警戒限和行動限,如果出現趨勢變差或水質不合格���,應查找原因并采取相應的措施�,同時評估是否需要再驗證���。在這個持續(xù)系統監(jiān)測的過程中應該使用在線監(jiān)測設備����,以對檢測流量(能推測出末端流速),壓力����,溫度����,電導率���,TOC等參數進行監(jiān)測�,相應的,在線監(jiān)測的指標也能反映出設備是否出現問題����,通過評估確認是否需要維護或需要更換部件,或需要再驗證���。
3�、計算機系統驗證
當計算機系統有變更時���,OMCL 建議對于該系統軟件進行評估以確定是否需要再驗證,同時要考慮到再驗證的范圍�,因為該變更可能不僅僅影響的是單一的計算機�,也可能影響到整個計算機控制系統。同樣����,如果計算機環(huán)境發(fā)生變化并對軟件的運行造成影響時����,計算機系統軟件建議被再驗證。對于專業(yè)版/定制版計算機系統���,OMCL建議對軟硬件配置每6個月進行定期回顧或者在變更完成后進行回顧�。WHO在2018年5月出臺了針對計算機系統驗證指南的征求意見稿�。文件中未對計算機系統有明確的對于周期性驗證的建議����。它建議周期性回顧計算機系統并且根據回顧結果評估是否需要再驗證���,并且再驗證的范圍和內容應該基于風險評估����。
4�、分析方法驗證
對于分析方法驗證�,WHO和ICH建議出現以下情況時進行確認或再驗證�,如當原料藥合成路線發(fā)生變化時(可能引入新的雜質���,副產物或降解產物���,或是引入新的溶劑)���,制劑的組成發(fā)生變化時�,使用的分析方法發(fā)生變化時���,或使用的分析方法從一個實驗室轉移到另一個實驗室時,或主要設備發(fā)生變化時等�,需要對分析方法進行確認或再驗證����。FDA針對分析方法驗證建議定期對方法進行趨勢分析以評估是否需要優(yōu)化方法或者對整個方法或部分方法進行再驗證����。當分析方法變化時,或者使用一個新的分析方法���,或者分析方法轉移時,要考慮進行分析方法驗證���。FDA指出如果分析方法只能滿足系統適用性條件而在操作時按照分析方法的操作條件要進行反復的調試�,那么這個分析方法建議被重新評價���,驗證或修正�。
從以上分析來看���,對設施設備�、分析方法等經過確認或驗證過的風險控制狀態(tài)的進行定期評估是非常有必要的����,這種定期評估可以確保其風險控制處于有效的狀態(tài)�,從而確保風險能夠在生命周期內得到控制�。經過最初的關鍵性評估和定期的評估后,必要情況下需要對關鍵的工藝和操作進行定期再驗證或再確認����。
【1】歐盟GMP/GDP�,annex 15 – qualification and validation (revision 1):
general: a quality risk management approach should be applied throughout the lifecycle of a medicinal product. As part of a quality risk management system, decisions on the scope and extent of validation and qualification should be based on a justified and documented risk assessment of the facilities, equipment, utilities and processes.
【2】WHO: Annex 2- Supplementary guidelines on good manufacturing practices for heating, ventilation and air-conditioning systems for non-sterile pharmaceutical dosage forms, TRS937, 2006.
【3】WHO: Annex 5- Supplementary guidelines on good manufacturing practices for heating, ventilation and air-conditioning systems for non-sterile pharmaceutical dosage forms, TRS961, 2011.
【4】WHO expert committee on specifications for pharmaceutical preparations, TRS1010.
【5】WHO:Annex 2 WHO good manufacturing practices: water for pharmaceutical use1
【6】OMCL:Validation of computerized systems core document
【7】OMCL:Validation of computerized systems core document – Annex 1
【8】WHO: Annex 4- Supplementary guidelines on good manufacturing practices: validation
【9】ICH Q2(R1)-Validation of analytical procedures: text and methodology
【10】 FDA:Analytical procedures and methods validation for drugs and biologics
【11】WHO: Guidelines on validation- Appendix 5 Validation of computerized system (May 2018)



