編者按
大尺寸裝載器械可為移植的自體或異體細(xì)胞提供免疫豁免部位�����,為細(xì)胞提供力學(xué)及理化條件支持�����,維持細(xì)胞的增殖�����,提升細(xì)胞的治療功能,因此被廣泛應(yīng)用于細(xì)胞療法�����。大尺寸裝載器械如膜控釋放系統(tǒng)�����、水凝膠�����、微針陣列貼片和3D支架等在內(nèi)的大尺寸裝載器械在維持細(xì)胞長期生存和加強(qiáng)其治療功能方面已經(jīng)展示出優(yōu)越的實驗室和臨床前治療效果�����。
中國工程院院刊《Engineering》2022年第6期刊發(fā)浙江大學(xué)顧臻教授研究團(tuán)隊的《用于細(xì)胞療法的大尺寸裝載器械》一文。文章從制備方法�����、材料選擇�����、器械特性及其對體外和體內(nèi)治療結(jié)果的影響等各方面對大尺寸器械進(jìn)行論述�����。由于各種疾病的治療對大尺寸器械具有不同的要求�����,為此�����,文章對大尺寸裝載器械的介紹圍繞疾病的種類展開�����,如糖尿病治療�����、心血管疾病治療�����、CAR-T細(xì)胞療法�����、3D打印水凝膠以建立血管網(wǎng)絡(luò)結(jié)構(gòu)等。進(jìn)一步地,文章還對大尺寸器械的設(shè)計策略和功能進(jìn)行討論�����,對該領(lǐng)域存在的挑戰(zhàn)和機(jī)遇進(jìn)行總結(jié)和展望�����。
一、引言
基于天然或工程化細(xì)胞的細(xì)胞療法已被廣泛應(yīng)用于治療各種疾病�����,包括內(nèi)分泌失調(diào)�����、心血管疾病�����、癌癥和神經(jīng)性疾病�����。此類療法可直接以細(xì)胞為功能單元進(jìn)行治療�����,或者利用細(xì)胞分泌的生物活性分子發(fā)揮治療作用�����。細(xì)胞療法具備徹底改變各種慢性疾病治療理念與策略的潛力�����。然而�����,細(xì)胞經(jīng)靜脈注射或局部注射進(jìn)入體內(nèi)后,往往伴隨著在體內(nèi)或者病灶部位滯留時間短的問題�����,導(dǎo)致治療效果不理想�����,并可能引發(fā)嚴(yán)重的安全性問題�����。研究人員因此而設(shè)計了獨特的植入式器械�����,用于細(xì)胞遞送�����,以克服以上障礙,滿足疾病治療的多種需求�����。為達(dá)到以上目標(biāo)�����,裝載器械必須具備高效的物質(zhì)交換能力�����,為細(xì)胞提供必需的營養(yǎng)物質(zhì)�����,如氧氣和氨基酸等�����;同時�����,在某些情況下�����,此類器械需要保護(hù)細(xì)胞免受免疫系統(tǒng)的攻擊�����。此外,裝載器械也需要具備一定的機(jī)械強(qiáng)度和高的生物相容性�����,以保持功能結(jié)構(gòu)的完整以及避免引起不必要的免疫反應(yīng)。根據(jù)尺寸大小�����,該類器械一般可分為微尺寸裝載器械和大尺寸裝載器械�����。因為大尺寸裝載器械(某一維尺寸大于1000 μm)很容易被改造以滿足治療各種疾病的不同需求�����,因此本文將重點介紹此類裝載器械(圖1)�����。例如�����,被研究得較為廣泛的膜控腔室型器械�����,其孔隙率�����、孔徑大小和膜厚度可以被精準(zhǔn)地調(diào)控。而另一類叫做微針陣列貼片(microneedle array patch, MN)的器械�����,其微針長度、幾何形狀�����、密度和硬度亦能被輕易調(diào)控�����。
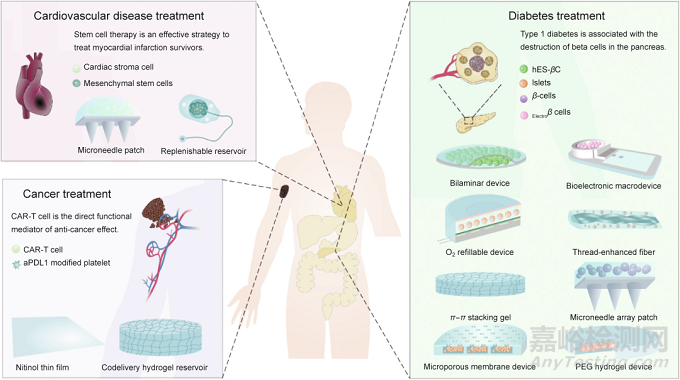
圖1. 大尺寸器械的設(shè)計及其在治療1型糖尿病、心肌梗死和癌癥免疫中的應(yīng)用�����。CAR:嵌合型抗原受體�����;hES-βC:胚胎干細(xì)胞來源的β細(xì)胞�����;Electroβ cells:電敏感的人源β細(xì)胞�����;aPDL1:抗程序性死亡受體配體1�����;PEG:聚乙二醇。
大尺寸器械可以將需要移植的細(xì)胞封裝在器械內(nèi)部,便于追蹤其在體內(nèi)的分布�����。另外�����,在器械失效或引起炎癥反應(yīng)時�����,從身體中取出大尺寸器械亦較為方便。目前�����,大尺寸器械已被用來遞送胰島或者胰島素分泌細(xì)胞治療糖尿病�����。該類器械也被用來遞送抗體分泌細(xì)胞治療神經(jīng)退行性疾病�����,遞送心臟基質(zhì)細(xì)胞(cardiac stromal cell, CSC)治療心臟病�����,遞送嵌合抗原受體T(CAR-T)細(xì)胞用于癌癥免疫治療�����,遞送外泌體分泌細(xì)胞治療帕金森癥。
本文中�����,我們將從制備方法、材料選擇�����、器械特性及其對體外和體內(nèi)治療結(jié)果的影響等各方面對大尺寸器械進(jìn)行論述。由于各種疾病的治療對大尺寸器械具有不同的要求�����,因此對器械的介紹將圍繞疾病的種類展開。進(jìn)一步地�����,本文對大尺寸器械的設(shè)計策略和功能進(jìn)行討論,對該領(lǐng)域存在的挑戰(zhàn)和機(jī)遇進(jìn)行總結(jié)和展望�����。
二、大尺寸器械用于糖尿病治療
目前�����,由于異體胰島供應(yīng)量少且長期服用免疫抑制類藥物伴隨著炎癥和癌癥風(fēng)險增加�����,因此胰島移植僅限于治療病情嚴(yán)重的胰島素缺乏性糖尿病患者。利用大尺寸裝載器械將移植胰島限制在內(nèi)部的免疫豁免部位�����,可以保護(hù)植入的胰島免受宿主免疫系統(tǒng)的攻擊,或可有效減少甚至免除免疫抑制藥物的使用�����。此外�����,此方法也可用于遞送異種胰島和人胚胎干細(xì)胞(human embryonic stem cell, hES-βC)制備的β細(xì)胞�����,或能解決胰島供應(yīng)量不足的問題�����。這類大尺寸器械主要包括膜控釋放系統(tǒng)、凝膠支架器械和微針陣列貼片類器械�����。這些器械都具備易制備、易回收的優(yōu)點�����。然而,植入器械表面的成纖維細(xì)胞過度生長�����、血管化不良和宿主免疫反應(yīng),都可能影響大尺寸器械的臨床轉(zhuǎn)化�����,我們將在下面進(jìn)行一一討論。
(一)膜控釋器械用于細(xì)胞封裝
膜控釋儲庫系統(tǒng)是一類表面覆蓋薄膜的密閉腔室型器械�����。薄膜上分布著合適密度和尺寸的孔洞,允許機(jī)體與儲庫內(nèi)進(jìn)行營養(yǎng)物質(zhì)和生物活性分子的交換�����。膜控釋儲庫系統(tǒng)尺寸較大,因此可以比較方便地對其外在大小�����、膜厚度以及孔洞尺寸進(jìn)行調(diào)控。迄今為止�����,膜控釋儲庫系統(tǒng)在細(xì)胞療法上已經(jīng)取得了重大進(jìn)展�����。例如,一種裝載了胰島素分泌細(xì)胞的器械已被開發(fā)出來�����,用以治療不同類型的糖尿病�����。此外�����,研究人員正在研究應(yīng)用降低免疫反應(yīng)�����、提供氨基酸和氧氣的策略等以提高植入細(xì)胞的存活率和增強(qiáng)其治療功能。
1. 具有合適膜孔大小的生物相容性器械
近來�����,利用兩層膜及其中間的腔室而制備的腔室型器件被研制出來�����。此類器械植入體內(nèi)后�����,若其表面不加以修飾�����,則易誘發(fā)機(jī)體的異物排斥反應(yīng)�����,造成器械被纖維化組織包裹。尤其是膜表面增生的纖維化組織易堵塞膜孔�����,從而影響膜兩側(cè)物質(zhì)的交換。因此�����,選擇具有較少異物反應(yīng)的膜材料�����,是保證移植物成活和器械在失效后被順利取出的關(guān)鍵。另外膜上孔徑的大小則決定膜兩側(cè)物質(zhì)的交換速率,從而影響到器械內(nèi)細(xì)胞的生存�����、活性及功能�����。然而�����,器械與外界所交換的物質(zhì)的尺寸通常介于細(xì)胞因子(約2 nm)與細(xì)胞直徑(約10 μm)的大小之間�����,何種孔徑大小的膜�����,既能保證良好的物質(zhì)交換�����,又能最大限度地減少宿主免疫系統(tǒng)對移植細(xì)胞的攻擊,仍然存在較大爭議�����。
在最近的一項工作中,Chang等將兩層聚己內(nèi)酯(polycaprolactone, PCL)納米孔膜貼合�����,制備了柔性雙層U型器械[圖2(a)~(c)]�����。與聚四氟乙烯(polytetrafluoroethylene, PTFE)膜(孔徑為400 nm)相比�����,研究人員所研發(fā)的膜孔徑為20 nm和200 nm的器械可以更有效地抑制免疫球蛋白通過�����,因此能更好地保護(hù)細(xì)胞免受宿主免疫系統(tǒng)的攻擊[圖2(d)]�����。由于其較好的物質(zhì)交換能力,封裝在器械中的hES-βC可以在培養(yǎng)基中存活5周以上�����。盡管孔徑為20 nm的膜比孔徑為200 nm膜表現(xiàn)出對胰島素和C肽更明顯的跨膜運輸阻礙作用[圖2(e)]�����,但膜孔徑為20 nm和200 nm的器械均達(dá)到約為1.5的葡萄糖刺激指數(shù)(glucose stimulation index, GSI)[圖2(f)]�����。將此膜控釋器械植入C57BL/6J小鼠皮下一個月后�����,該器械周圍沒有明顯的纖維化組織沉積�����。4個月后,器械周圍血管密度增加而巨噬細(xì)胞募集減少[圖2(g)]�����。值得注意的是�����,當(dāng)該器械的膜孔徑為200 nm時�����,該器械可以將細(xì)胞封裝在內(nèi)長達(dá)6個月而不泄露�����。但是,該過程伴隨著大約75%的細(xì)胞損失[圖2(h)]�����。在免疫缺陷非肥胖糖尿病-重度聯(lián)合免疫缺陷(NOD-SCID)小鼠中植入此器械6個月后,經(jīng)腹腔給小鼠注射葡萄糖�����,可以觀察到葡萄糖刺激的C肽分泌[圖2(i)、(j)]�����,且GSI在2~7之間[圖2(k)]�����。
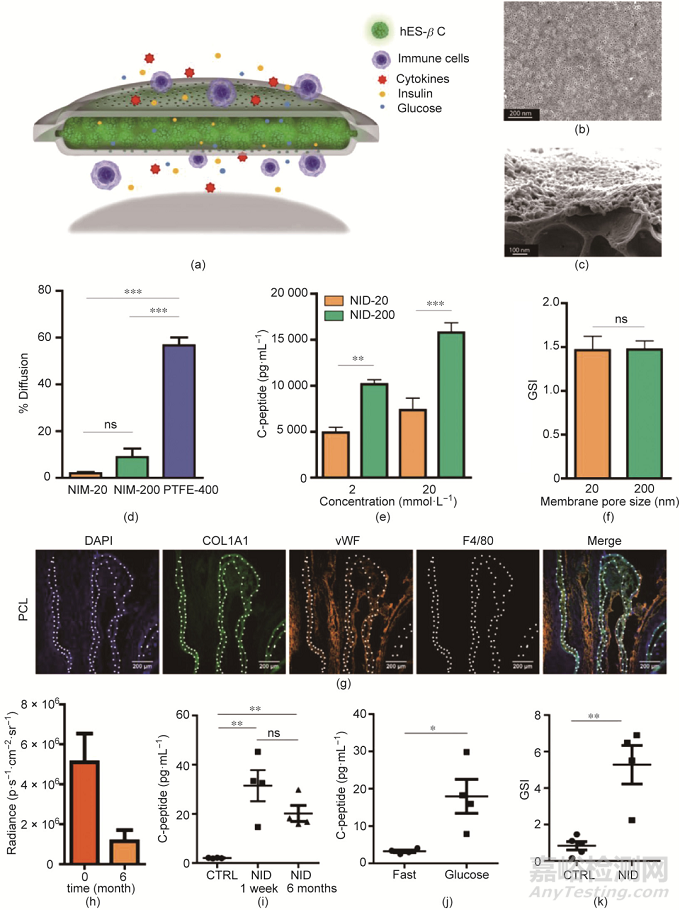
圖2. 一種用于hES-βC包封的PCL雙層膜器械�����。(a)雙層膜器械的示意圖�����。(b)PCL(聚己內(nèi)酯)膜的代表性掃描電子顯微鏡圖像�����。(c)具有納米多孔層和微孔層的PCL膜橫截面的代表性掃描電子顯微鏡圖像�����。(d)7天內(nèi)免疫球蛋白跨膜擴(kuò)散率�����。(e)暴露于葡萄糖溶液(2 mmol·L-1和20 mmol·L-1)后,封裝在hES-βC中C肽的分泌量(n = 4)�����。(f)在膜孔徑為20 nm (NID-20)和200 nm (NID-200)的材料中負(fù)載的hES-βC的葡萄糖刺激指數(shù)(GSI)�����。該裝置依次暴露在2 mmol·L-1和20 mmol·L-1的葡萄糖溶液中30 min�����。GSI:在20 mmol·L-1和2 mmol·L-1中C肽釋放量的比值,并定義為葡萄糖刺激指數(shù)�����。(g)PCL膜皮下植入C57BL/6J小鼠4個月后�����,細(xì)胞核(DAPI)、膠原蛋白(COL1A1)�����、新生血管(vWF)和巨噬細(xì)胞(F4/80)標(biāo)志物的免疫熒光染色圖像。白色虛線表示PCL膜的位置�����。(h)器械植入6個月后細(xì)胞的損耗量,Radiance:生物發(fā)光強(qiáng)度�����。(i)腹腔糖耐量實驗中血清C肽的釋放量�����。實驗組小鼠分別植入NID封裝的hES-βC 1周和6個月�����,未移植的小鼠作為對照(CTRL)�����,并在實驗前禁食(n = 4)�����。(j)植入NID封裝的hES-βC 6個月并禁食過夜的小鼠(n = 4)在糖耐量實驗前和60 min后的血清C肽水平�����。(k)植入NID封裝的(NID組)或裸露的hES-βC(CTRL組)6個月后的小鼠的GSI(n = 4)�����。*P < 0.05, **P < 0.01, ***P < 0.001�����。ns:無統(tǒng)計學(xué)意義。
在另一項研究工作中�����,研究人員制備了一種異物反應(yīng)較弱�����、對抗體和細(xì)胞因子具有高滲透性但同時又能夠限制細(xì)胞滲漏的器械�����。該器械由兩部分組成:①深度為150 µm的聚二甲硅氧烷(polydimethylsiloxane, PDMS)儲庫;②具有不同孔徑的多孔聚碳酸酯(PCTE)膜[圖3(a)�����、(b)]�����。隨后,研究人員將能夠分泌小鼠促紅細(xì)胞生成素的工程化HEK293T細(xì)胞(HEKepo細(xì)胞)封裝到該器械中�����。研究發(fā)現(xiàn)�����,巨噬細(xì)胞能夠穿透孔徑為1 µm的膜而浸潤到器械內(nèi)腔�����。將孔隙減小到0.8 µm�����,該PCTE膜則可以較好地阻止免疫細(xì)胞進(jìn)入器械內(nèi)�����。值得注意的是�����,在經(jīng)各組器械治療的小鼠體內(nèi),均檢測到抗HEKepo細(xì)胞的抗體�����,但均未引起明顯的移植物損傷。進(jìn)一步研究發(fā)現(xiàn)�����,將膜孔徑縮小到0.4 μm�����,能夠更加有效地阻止免疫細(xì)胞浸潤到器械內(nèi)部,同時又實現(xiàn)了氧氣�����、營養(yǎng)物質(zhì)和生物活性分子的交換�����。
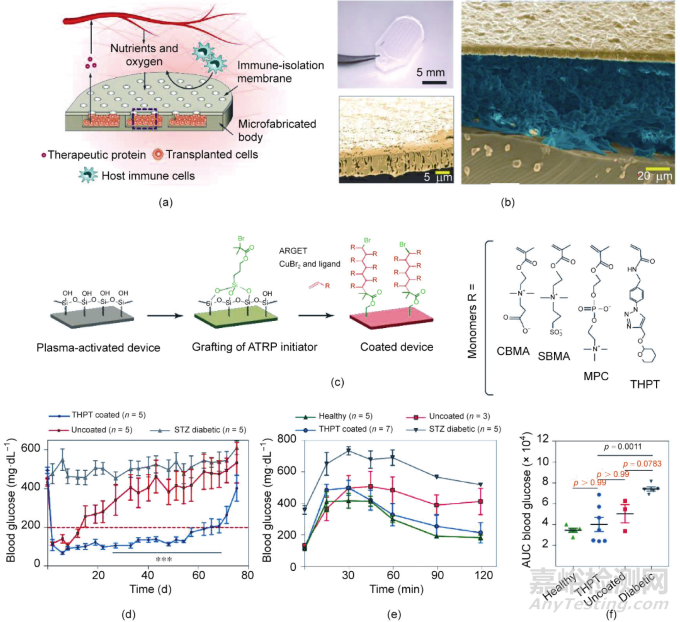
圖3. 用于細(xì)胞和胰島遞送的膜控腔室型器械�����。(a)微孔裝置的示意圖�����。(b)裝置的代表性圖像:用于小鼠實驗的代表性裝置圖片(左上);典型的橫截面掃描電子顯微鏡圖像(右)�����,偽彩顯示膜�����、細(xì)胞和硅膠體的位置;膜的偽彩圖像(左下)�����。(c)膜表面的改性方法�����。(d)用負(fù)載有胰島細(xì)胞(200~300當(dāng)量)的裝置治療的1型糖尿病小鼠的血糖水平�����,n = 5�����。(e)健康小鼠和裝置治療15天的糖尿病小鼠在糖耐量實驗后的血糖水平。(f)對(e)數(shù)據(jù)的分析結(jié)果�����。ATRP:原子轉(zhuǎn)移自由基聚合�����;ARGET:通過電子轉(zhuǎn)移再生的激活劑;CBMA:甲基丙烯酸羧基乙酯�����;SBMA:甲基丙烯酸磺基乙酯;MPC:2-甲基丙烯酰氧乙基磷酸膽堿�����;AUC:曲線下面積�����。
隨后,研究人員進(jìn)一步用三種兩性離子聚合物和四氫吡喃苯三唑(tetrahydropyran phenyl triazole, THPT)衍生聚合物對器械膜進(jìn)行修飾�����,以減少異物反應(yīng)[圖3(c)]�����。將器械植入C57BL/6J小鼠體內(nèi)后�����,THPT衍生聚合物修飾的膜在預(yù)防纖維化和維持細(xì)胞存活方面優(yōu)于兩性離子聚合物修飾膜。研究人員將胰島與海藻酸鈉凝膠混合并封裝在器械中�����,然后將其植入鏈脲佐菌素(streptozotocin, STZ)誘導(dǎo)的糖尿病C57BL/6J小鼠的腹腔內(nèi)�����。經(jīng)THPT修飾的器械可以維持小鼠正常血糖的平均時間為75天�����,遠(yuǎn)高于未修飾器械的21天[圖3(d)]�����。此外,在葡萄糖篩查試驗中�����,經(jīng)THPT修飾的器械治療的小鼠與健康小鼠一樣,能夠在120 min內(nèi)將小鼠血糖恢復(fù)到正常范圍[圖3(e)和(f)]�����。
2. 可重復(fù)充填氧氣的器械
充足的氧氣供應(yīng)對植入細(xì)胞的生存至關(guān)重要�����,因此在設(shè)計器械時需要將其納入考量范圍內(nèi)�����。其中�����,研究人員證明,向器械中吹入氧氣是一種可行的方法�����。Ludwig等開發(fā)了一款名為“β-Air”的器械。該器械內(nèi)包含一個可反復(fù)充填富氧空氣的儲罐�����。氧氣可以緩慢地穿過PTFE隔膜�����,到達(dá)胰島細(xì)胞所在的隔室�����。將德國長白母豬胰島封裝在“β-Air”器械中�����,隨后植入到Göttingen小型豬皮下�����,并取出檢驗�����。當(dāng)將該器械先后暴露于3.3 mmol·L?1和16.7 mmol·L?1的葡萄糖溶液中時�����,植入前和13天后取出的器械的GSI分別為3.5和6.7�����。隨后,研究人員將該裝置與生長激素釋放激素(growth hormone-releasing hormone, GHRH)激動劑結(jié)合�����,以增強(qiáng)植入后β細(xì)胞的生存和細(xì)胞增殖�����。研究發(fā)現(xiàn),包裹胰島的凝膠的表面積�����、輸送氣體方法、氣體成分均會影響細(xì)胞活力�����。例如�����,當(dāng)胰島密度為每平方厘米1000個且厚度為500 µm時,頻繁的空氣輸注或者開放型腔室均可有效地維持細(xì)胞活性�����。然而�����,當(dāng)胰島密度超過每平方厘米2000個時,在無空氣輸送或者僅輸送含氧量為20%或30%的空氣時�����,正常血糖的維持時間不會超過兩天。研究人員進(jìn)一步將器械推進(jìn)到臨床試驗�����,且給藥劑量設(shè)定為每千克體重2100個胰島�����。如果每天更新空氣�����,移植的器械可以將功能維持10個月以上。然而�����,由于植入胰島數(shù)量不足,C肽的基線水平僅為(0.04 ± 0.03) mmol·L-1�����,遠(yuǎn)低于健康個體的平均水平�����。移除器械后,植入部位有一個薄的纖維囊�����,血管化情況良好且無炎癥跡象�����。值得注意的是�����,在取出的移植物中�����,胰島仍保持著正常的形態(tài),分布著正常形態(tài)與功能的α和β細(xì)胞�����。
3. 預(yù)血管化器械
預(yù)血管化是另一種增強(qiáng)氧氣和營養(yǎng)供應(yīng)的有效策略。Pepper等發(fā)現(xiàn)�����,將植入部位預(yù)血管化�����,可以顯著提高植入胰島的存活率�����。他們設(shè)計了一種生物相容性的細(xì)胞袋(cell pouch, CP)器械作為胰島移植的免疫隔離區(qū)和預(yù)血管化部位。將CP預(yù)植入小鼠皮下4~5周�����,促使擬植入部位預(yù)先血管化�����。隨后�����,利用負(fù)載胰島的CP器械治療糖尿病小鼠�����,可將小鼠的血糖逐漸恢復(fù)到水平正常。移植100天后�����,95%的小鼠血糖恢復(fù)到正常水平。若此時將CP器械移除�����,則小鼠在1周內(nèi)又會回到高血糖水平。胰島移植到CP中后其功能依然正常�����。相反�����,直接進(jìn)行細(xì)胞移植不能逆轉(zhuǎn)糖尿病�����。然而�����,本研究中沒有對未預(yù)血管化的CP的治療效果進(jìn)行評估�����。
間充質(zhì)干細(xì)胞(mesenchymal stem cell, MSC)和富血小板血漿(platelet-rich plasma, PRP)也可以促進(jìn)血管生成�����。受此啟發(fā)�����,研究人員以生物相容性較高的聚乳酸(polylactic acid, PLA)為原料�����,利用3D打印技術(shù)制備出腔室型器械�����。微通道均勻分布在器械表面,保證新形成的血管能夠滲透到細(xì)胞庫中�����。在該器械中先裝入PRP和MSC�����,然后再將器械移植到大鼠和非人靈長類動物的皮下組織中�����。預(yù)裝載了PRP和MSC的器械表面形成了密集的血管網(wǎng)絡(luò),從而能夠提供一個快速進(jìn)行氧氣交換的微環(huán)境�����,為提高隨后裝載的胰島或能夠分泌睪酮的Laydig細(xì)胞的存活率提供了條件�����。此外,免疫抑制分子誘導(dǎo)的局部免疫抑制微環(huán)境可以與血管網(wǎng)絡(luò)協(xié)同作用�����,進(jìn)一步提高所移植的同種異體細(xì)胞的存活率�����。Paez-Mayorga等設(shè)計了一種皮下可植入的雙儲庫器械�����。該器械包含一個中央的細(xì)胞儲庫�����。中央儲庫兩側(cè)的空間則裝載了MSC和免疫抑制劑CTLA4Ig�����。這種設(shè)計不僅可以增強(qiáng)血管生成�����,還能夠建立免疫抑制微環(huán)境來保護(hù)包裹在裝置內(nèi)的同種異體Leydig細(xì)胞。
Song等則開發(fā)了一種微血管網(wǎng)篩�����。將該網(wǎng)篩覆蓋于器械表面�����,可促進(jìn)細(xì)胞附著�����,加速新生血管生成�����,促進(jìn)氧氣和營養(yǎng)物質(zhì)的供給�����。在該研究中�����,纖維蛋白基質(zhì)中培養(yǎng)的人臍靜脈內(nèi)皮細(xì)胞(human umbilical vein endothelial cell, HUVEC)可以在微柱基質(zhì)上自組裝形成血管網(wǎng)。兩周后�����,該血管網(wǎng)狀物可在器械表面誘導(dǎo)形成致密的具有正常功能的血管網(wǎng)。將裝載了胰島和覆蓋了微血管網(wǎng)的器械移植到SCID-Beige小鼠的皮下后�����,小鼠的血糖可以保持在正常水平達(dá)3個月。
4. 無線生物電子器械
上述器械的糖響應(yīng)胰島素釋放功能均建立在β細(xì)胞內(nèi)在的糖響應(yīng)控制機(jī)制之上�����。若想利用外部刺激來操縱這個信號環(huán)路,從而控制胰島素釋放�����,仍面臨較大挑戰(zhàn)。在機(jī)體內(nèi),朗格漢斯(Langerhans)胰島內(nèi)的β細(xì)胞能夠響應(yīng)血糖波動�����,并相應(yīng)地調(diào)整其胰島素的分泌速率。其機(jī)制如下:當(dāng)血糖升高時�����,經(jīng)葡萄糖轉(zhuǎn)運體運輸,葡萄糖加速流入β細(xì)胞�����,隨后在細(xì)胞內(nèi)產(chǎn)生大量三磷酸腺苷(adenosine triphosphate, ATP)�����,導(dǎo)致三磷酸腺苷/二磷酸腺苷(adenosine diphosphate, ADP)比值升高。然后�����,ATP敏感的K+通道關(guān)閉,導(dǎo)致細(xì)胞膜去極化�����,誘導(dǎo)電壓門控鈣離子通道(Cav)打開�����,促使鈣離子加速流入�����,刺激胰島素分泌。
基于這一原理�����,Krawczyk等設(shè)計了一種電子器械,并裝載了電壓敏感的人β細(xì)胞(electrosensitive human β-cells, Electroβ cells)和定制的生物電子接口�����,旨在遠(yuǎn)程控制胰島素釋放以治療1型糖尿病(type 1 diabete, T1D)[圖4(a)]�����。研究人員選擇HEK293T細(xì)胞轉(zhuǎn)染質(zhì)粒,在細(xì)胞膜上表達(dá)一個L-型電壓門控鈣離子通道�����,并使其能夠分泌人胎盤堿性磷酸酶(human placental-secreted alkaline phosphatase, SEAP)作為報告蛋白�����。與只表達(dá)電壓門控鈣離子通道的細(xì)胞相比�����,表達(dá)電壓門控鈣離子通道Cav1.2和內(nèi)向整流鉀離子通道Kir2.1的HEK293T細(xì)胞表現(xiàn)出較低的SEAP本底水平,并能夠?qū)崿F(xiàn)膜去極化觸發(fā)的SEAP釋放[圖4(b)和(c)]�����。隨后,選擇具有正常胰島素分泌機(jī)制但沒有葡萄糖感應(yīng)能力的β細(xì)胞系變體INSVesc進(jìn)行基因改造,獲得同時表達(dá)Cav1.2和Kir2.1通道以及proinsulin-NanoLuc的Electroβ細(xì)胞系,實現(xiàn)胰島素的可控分泌并方便對其進(jìn)行監(jiān)測[圖4(d)~(f)]�����。
隨之�����,一種用于體內(nèi)植入的無線電刺激器械也被設(shè)計和制備出來[圖4(a)]�����。在該大尺寸器械中,鉑電極被安裝在包裹Electroβ細(xì)胞的半透膜兩側(cè),可以對細(xì)胞施加電脈沖刺激�����。此外,一個配電盤(switchboard)被連接到該設(shè)備�����,以產(chǎn)生用于電刺激的方形單極脈沖。在糖耐量測試中�����,體內(nèi)植入器械的糖尿病小鼠在電刺激60 min后�����,其血糖迅速恢復(fù)到正常水平�����,并呈現(xiàn)出類似于經(jīng)人胰島治療的血糖反應(yīng)曲線[圖4(g)]。通過實時血糖監(jiān)測發(fā)現(xiàn)�����,只要電刺激30 min�����,器械在1 h內(nèi)就能將糖尿病小鼠的血糖恢復(fù)至正常水平[圖4(h)]�����。將含有Electroβ細(xì)胞的器械移植后3周內(nèi),器械表現(xiàn)出良好的生物相容性�����,其免疫細(xì)胞浸潤或器械相關(guān)的細(xì)胞毒性基本可以忽略不計。該系統(tǒng)的優(yōu)勢在于,它能對血液中葡萄糖水平進(jìn)行實時監(jiān)測并依外部控制而做出響應(yīng)。然而�����,擴(kuò)大這些設(shè)備的生產(chǎn)規(guī)?����?赡芫哂幸欢ㄌ魬?zhàn)性。
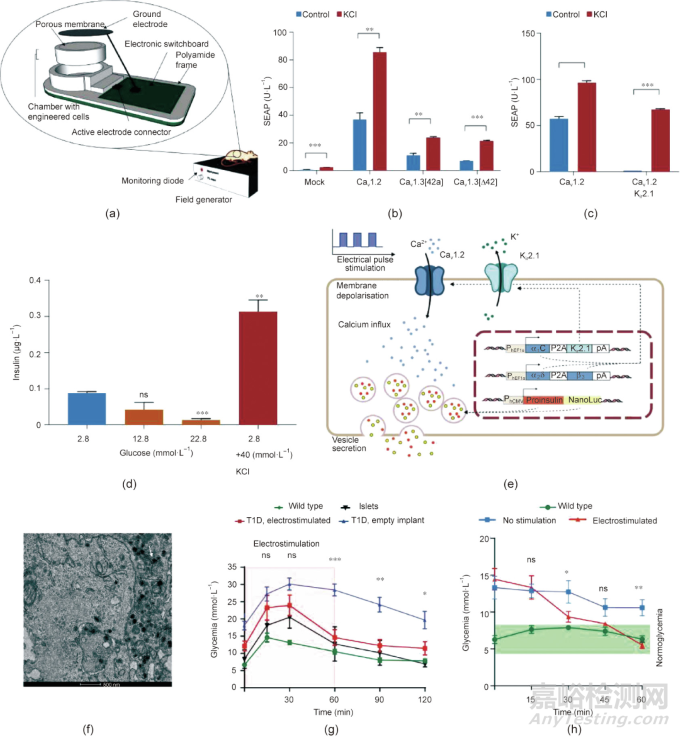
圖4. 一種裝有β細(xì)胞的無線控制的生物電子大尺寸器械。(a)該器械的三維模型�����。(b)不同鈣離子通道的報告蛋白分泌量的比較。(c)表達(dá)Cav1.2的細(xì)胞或共同表達(dá)Cav1.2和Kir2.1的細(xì)胞的性能比較。Cav1.2�����、Cav1.3 [42a]和Cav1.3 [?42]是三種L型電壓門控鈣通道�����。數(shù)據(jù)為平均值±標(biāo)準(zhǔn)誤差,n = 3�����;**P < 0.01�����,***P < 0.001�����。(d)暴露在不同的葡萄糖溶液中�����,Electroβ細(xì)胞中胰島素釋放量。數(shù)據(jù)為平均值±標(biāo)準(zhǔn)誤差,n = 3�����;**P < 0.01�����,***P < 0.001。(e)在電刺激下�����,Electroβ細(xì)胞的胰島素分泌途徑。PhEF1α-α2/β1-P2A-β3-pA和PhEF1α-α1C-P2A-Kir2.1-pA是表達(dá)Cav1.2和Kir2.1的轉(zhuǎn)基因結(jié)構(gòu)域�����。(f)Electroβ細(xì)胞的代表性透射電子顯微鏡圖像。白色箭頭指向含有胰島素的囊泡�����。(g)葡萄糖耐量實驗�����。植入48 h后�����,裝置中的Electroβ細(xì)胞被電刺激60 min(紅色區(qū)域)�����;然后�����,腹腔注射葡萄糖后監(jiān)測小鼠的血糖水平�����。野生型(wild type)�����,n = 8�����;1型糖尿病小鼠,植入物電刺激(T1D, implant electrostimulated)�����,n = 6�����;1型糖尿病小鼠,空植入物(T1D, empty)�����,n = 10;胰島(islets)�����,n = 3�����。(h)血糖的實時監(jiān)測記錄數(shù)據(jù)。植入裝置的空腹1型糖尿病小鼠被電刺激30 min�����,并監(jiān)測血糖水平�����。綠色區(qū)域表示正常血糖范圍。野生型(wild type)�����,n = 6�����;無刺激(no stimulation)�����,n = 6�����;電刺激(electrostimulated)�����,n = 7�����。
(二)微針陣列貼片用于細(xì)胞遞送
微針陣列貼片是另一種大尺寸器械�����,已經(jīng)被廣泛研究用于無痛地遞送胰島素、疫苗�����、抗癌藥物�����、活細(xì)胞和其他種類的藥物�����,治療多種疾病�����。貼片表面均勻地分布著微針�����,這些微針能夠刺入皮膚,因此賦予微針陣列貼片經(jīng)皮給藥的能力。此外�����,微針陣列貼片可以承擔(dān)通信功能�����,讓微針陣列貼片上負(fù)載的細(xì)胞能夠感知微針?biāo)诮M織的生理環(huán)境的變化�����。
Ye等利用微針陣列貼片負(fù)載能夠產(chǎn)生胰島素的β細(xì)胞,用于治療Ⅰ型糖尿病[圖5(a)]�����。在該方法中�����,微針陣列貼片以甲基丙烯酸酯化的透明質(zhì)酸(hyaluronic acid, HA)為原料制備而成[圖5(b)]�����,并在脫模后進(jìn)行紫外線交聯(lián)�����。為了維持β細(xì)胞的活性�����,細(xì)胞被包裹在海藻酸鈉微凝膠中�����,然后再貼合于微針陣列貼片的背面[圖5(c)]�����。另外�����,微針中還額外整合了葡萄糖信號放大器(glucose-signal amplifier, GSA)�����。將該貼片貼于皮膚后,微針能夠插入真皮組織中�����,使整個器械獲得實時感知血糖波動并響應(yīng)釋放藥物的能力。在Ⅰ型糖尿病小鼠模型中�����,負(fù)載細(xì)胞的微針陣列貼片能夠感知高血糖并隨之釋放胰島素�����,使血糖維持在正常范圍的時間達(dá)到10 h以上[圖5(d)]。重要的是�����,連續(xù)使用兩個微針陣列貼片并不會導(dǎo)致小鼠低血糖[圖5(e)]�����。在該器械中�����,微針陣列貼片和海藻酸鈉微凝膠能夠?qū)?beta;細(xì)胞與宿主的免疫系統(tǒng)隔離�����,減少免疫排斥反應(yīng)�����。此外,微針陣列貼片的多孔網(wǎng)絡(luò)結(jié)構(gòu)能夠幫助β細(xì)胞感受組織液的葡萄糖濃度變化。然而�����,要想將該器械推到臨床應(yīng)用,還需要做很多工作�����,包括如何擴(kuò)大化生產(chǎn)。
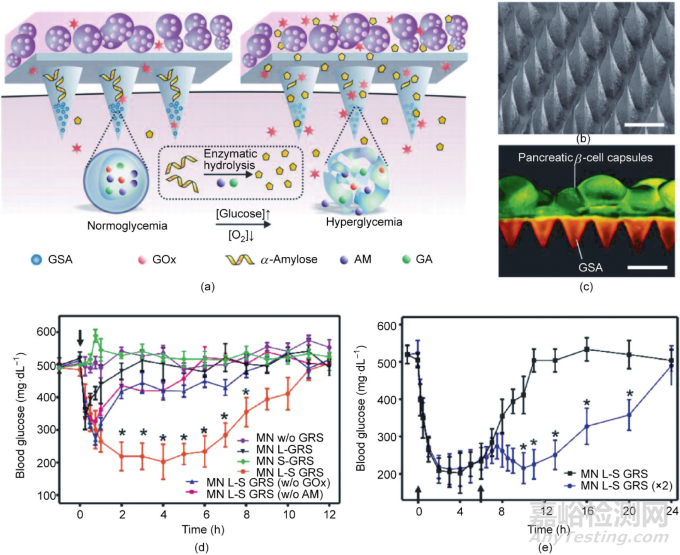
圖5. 用于細(xì)胞和胰島遞送的微針陣列貼片�����。(a)葡萄糖響應(yīng)機(jī)制示意圖。[Glucose]和[O2]分別代表葡萄糖和O2的濃度。GOx:葡萄糖氧化酶�����;AM:淀粉酶�����;GA:葡糖淀粉酶。(b)代表性掃描電子顯微鏡圖像�����。(c)負(fù)載細(xì)胞的微針貼片的熒光圖像�����。GSAs用羅丹明標(biāo)記,細(xì)胞用鈣-α-淀粉酶標(biāo)記�����。(d)使用微針貼片的1型糖尿病小鼠的在體血糖調(diào)節(jié)能力�����。MN w/o GRS:空MN�����;MN L-GRS:微針貼片與細(xì)胞凝膠;MN S-GRS:無細(xì)胞微針貼片�����;MN L-S GRS:裝有凝膠的微針貼片�����;MN L-S GRS (w/o GOx):MN L-S GRS不使用葡萄糖氧化酶(GOx)�����;MN L-S GRS(不使用AM)�����。MN L-S GRS:不使用直鏈淀粉。(e)1型糖尿病小鼠在接受兩次連續(xù)的微針貼片治療后的血糖水平�����。
(三)中空多孔纖維
理想的大尺寸器械表面應(yīng)具備致密的血管網(wǎng)絡(luò),使器械內(nèi)與周圍生理環(huán)境之間可以順暢地進(jìn)行物質(zhì)交換�����。與此相似,增加裝置的比表面積也可以促進(jìn)物質(zhì)交換�����。為此�����,Tan等利用膜表面孔徑為(0.27 ± 0.02) μm的中空微孔聚醚砜纖維制備了一種大尺寸器械。纖維的外表面修飾了抗炎細(xì)胞因子白細(xì)胞介素-4(IL-4)�����,可以誘導(dǎo)巨噬細(xì)胞向M2型極化�����。此外,利用纖維連接蛋白(fibronectin, FN)修飾纖維的內(nèi)表面構(gòu)建仿生微環(huán)境�����,促進(jìn)β細(xì)胞在纖維膜內(nèi)表面黏附并形成單細(xì)胞層。修飾前后�����,纖維的孔隙大小沒有發(fā)生明顯變化�����,卻使纖維內(nèi)的β細(xì)胞數(shù)量增加了10倍�����,證明這一策略具有較高的可行性。
類似地�����,Wang等設(shè)計了一種納米纖維器械,可用于自體�����、同種異體或異種胰島移植�����,治療Ⅰ型糖尿病。該裝置由表面的納米纖維膜和核心的海藻酸鈉水凝膠組成�����。納米纖維膜由熱塑性硅樹脂-聚碳酸酯-聚氨酯制成�����。納米纖維膜的孔徑小于500 nm,可防止免疫細(xì)胞浸潤�����。在Ⅰ型糖尿病小鼠模型中�����,腹腔植入該器械能夠逆轉(zhuǎn)免疫缺陷和免疫正常小鼠的糖尿病癥狀�����。另外�����,通過微創(chuàng)手術(shù)將該器械移植到實驗狗的腹腔中�����。兩周后�����,在取出的器械中仍能觀察到存活的人β細(xì)胞�����,但同時也觀察到免疫排斥反應(yīng)�����。
(四)水凝膠
水凝膠是一種能夠在水或生物流體中膨脹的交聯(lián)高分子網(wǎng)絡(luò)�����。水凝膠的親水鏈可以容納大量的水分子,因此有足夠的空間成為藥物�����、蛋白質(zhì)和細(xì)胞的“儲庫”�����。水凝膠可以由天然大分子如海藻酸鈉和明膠�����,或者合成聚合物如聚乙二醇[poly(ethylene glycol), PEG]和聚(2-羥乙基甲基丙烯酸酯)[poly(2-hydroxyethyl methacrylate), PHEMA]制備�����。目前針對水凝膠的研究主要集中在改善其機(jī)械強(qiáng)度�����,減少異物反應(yīng)及促進(jìn)水凝膠與機(jī)體間的營養(yǎng)物質(zhì)和氧氣的交換速率�����,目標(biāo)是提高細(xì)胞的存活率和維持器械性能�����。
1. 聚合物線增強(qiáng)海藻酸鈉水凝膠強(qiáng)度
海藻酸鈉是目前應(yīng)用最廣泛的水凝膠原料�����,具有良好的生物相容性。但是�����,海藻酸鈉水凝膠存在一些局限性。例如�����,海藻酸鈉不可避免地含有脂多糖、肽聚糖和脂磷壁酸�����,而這些物質(zhì)可能被免疫系統(tǒng)識別為外來分子�����,導(dǎo)致異物反應(yīng)和器件表面纖維化�����。此外�����,海藻酸鈉水凝膠的機(jī)械強(qiáng)度較低�����,導(dǎo)致水凝膠器械不易植入或移除。目前�����,研究人員已經(jīng)開發(fā)了一些策略�����,來提高海藻酸鈉水凝膠的機(jī)械強(qiáng)度。此外�����,新的生物相容性材料也在開發(fā)中,以替代海藻酸鈉并解決其體內(nèi)應(yīng)用面臨的局限性�����。
An等開發(fā)了一種能夠釋放鈣離子的納米多孔聚合物線。將聚合物線做成螺紋線結(jié)構(gòu)�����,并在其表面覆蓋封裝有胰島的海藻酸鈉水凝膠�����,從而獲得螺紋線增強(qiáng)的海藻酸鈉凝膠纖維[圖6(a)]�����。海藻酸鈉水凝膠能夠牢固地黏附在納米多孔線上[圖6(b)]�����,且胰島能夠在該器械中存活[圖6(c)]�����。在葡萄糖溶液中�����,該器械能夠模擬胰島功能�����,實現(xiàn)胰島素的動態(tài)糖響應(yīng)分泌�����。在I型糖尿病小鼠實驗中�����,將負(fù)載大鼠胰島的海藻酸鈉凝膠纖維植入小鼠腹腔中�����,兩天后血糖即恢復(fù)至正常范圍內(nèi)�����,且在4周內(nèi)將血糖維持在正常水平[圖6(d)]�����。移植后第28天,進(jìn)行腹腔葡萄糖耐量試驗(intraperitoneal glucose tolerance test, IPGTT)(2 g·kg-1)�����,糖尿病小鼠和健康小鼠的血糖在2 h內(nèi)均回到正常水平[圖6(e)]�����。負(fù)載人胰島的海藻酸水凝膠纖維能夠逆轉(zhuǎn)免疫缺陷型的糖尿病SCID-Beige小鼠的高血糖[圖6(f)]�����,并維持正常血糖超過4個月�����。在實驗狗中,將10 in(注:1 in=2.54 cm)長的海藻酸鈉水凝膠纖維放置在肝臟和隔膜之間�����,移植的胰島能夠存活�����,并實現(xiàn)糖響應(yīng)型的胰島素分泌[圖6(g)]�����。
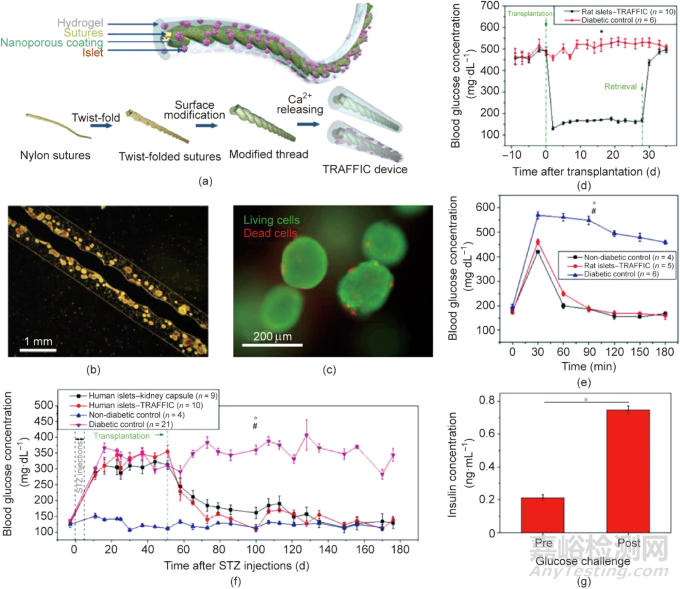
圖6. 一種用于細(xì)胞和胰島遞送的螺紋線增強(qiáng)型海藻酸鈉水凝膠�����。(a)該器械的示意圖�����。TRAFFIC:用于封裝胰島的線增強(qiáng)海藻酸纖維�����。(b)代表性的胰島裝載器械圖像�����。(c)封裝在纖維中的胰島的活/死染色�����。(d)糖尿病的C57BL/6J小鼠移植封裝大鼠胰島器械后的血糖水平�����,n = 6~10�����,*P < 0.05。(e)在取回裝置前�����,接受葡萄糖注射后的糖尿病小鼠的血糖水平�����,n = 4~5,*P < 0.05(糖尿病對照vs大鼠胰島器件)�����,#P > 0.05(非糖尿病對照vs器件治療的大鼠)�����。(f)糖尿病SCID-Beige小鼠移植各種類型的人胰島后的血糖水平�����,n = 4~21�����,*P < 0.05(人胰島器械vs糖尿病對照)�����,#P > 0.05(人胰島-腎膠囊vs人胰島器械)。(g)封裝在纖維凝膠中的胰島植入前和植入后,小鼠體外葡萄糖刺激的胰島素分泌情況�����,n = 3�����,*P < 0.05�����。所有數(shù)據(jù)都是以平均值±平均值的標(biāo)準(zhǔn)誤差表示�����。
2. 盤狀三唑兩性離子水凝膠
另一種提高水凝膠機(jī)械強(qiáng)度的方法是研制大塊狀水凝膠�����。在眾多水凝膠中,三唑兩性離子水凝膠具有較高的拉伸性能和機(jī)械穩(wěn)定性�����,因此受到研究者的青睞�����。Liu等開發(fā)了多種基于三唑兩性離子水凝膠的盤狀水凝膠用于胰島移植�����,其原料包括聚季銨化三唑羧基甜菜堿丙烯酰胺[poly(quaternized triazole carboxybetaine acrylamide), P(qTR-CB)]、聚三唑羧基甜菜堿丙烯酰胺[poly(triazole carboxybetaine acrylamide), P(TR-CB)]和聚三唑磺基甜菜堿丙烯酰胺[poly(triazole sulfobetaine acrylamide)或P(TR-SB)]�����。通過提高合成過程中的單體濃度,可以促進(jìn)強(qiáng)離子鍵的形成�����,因此能夠增強(qiáng)凝膠的機(jī)械強(qiáng)度。三唑磺基甜菜堿丙烯酰胺(triazole sulfobetaine acrylamide, TR-SB)制備的P(TR-SB)水凝膠�����,具有比聚羧基甜菜堿(polycarboxybetaine, PCB)水凝膠高20倍的斷裂應(yīng)變�����,且其在健康小鼠皮下植入后幾乎沒有異物反應(yīng)�����。在糖尿病小鼠植入負(fù)載大鼠胰島的P(TR-SB)凝膠后�����,小鼠的血糖可以維持在正常水平長達(dá)一個月�����。與之對比�����,包裹于海藻酸鈉凝膠中的胰島則無法持續(xù)維持血糖正常�����。取出該凝膠后,將其先后置于2.8 mmol·L-1和16.7 mmol·L-1的葡萄糖溶液中并培養(yǎng)60 min�����,發(fā)現(xiàn)胰島素分泌量增加約1.5倍�����。此外�����,P(TR-SB)凝膠在植入小鼠后�����,其周圍的血管化程度也增長明顯�����。
3. 不可降解的聚乙二醇水凝膠
為了促進(jìn)器件周圍的血管化�����,Weaver等制備了一種蛋白酶促降解型聚乙二醇水凝膠�����,并在水凝膠中加入精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)和血管內(nèi)皮生長因子(vascular endothelial growth factor, VEGF)�����。RGD為胰島細(xì)胞提供黏附位點�����,而VEGF則可刺激器件周圍血管網(wǎng)絡(luò)的形成�����。此外�����,研究人員利用這些材料制造了一個多層胰島封裝器械�����。該器械主要包括兩部分:①器械核心為封裝了胰島的不可降解聚乙二醇水凝膠�����;②核心外部則包裹了一層促血管網(wǎng)絡(luò)生成的可降解聚乙二醇凝膠�����。相比于傳統(tǒng)的海藻酸鈉水凝膠�����,該聚乙二醇水凝膠能夠更好地維持胰島活性�����。將包裹了雄性Lewis大鼠胰島的器械植入雌性Lewis大鼠腹腔脂肪墊中�����,可以發(fā)現(xiàn)�����,外層修飾有VEGF聚乙二醇水凝膠的器械能夠更好地促進(jìn)血管密度的增加�����。
4. 多孔管狀水凝膠
如前所述�����,增加器械的比表面積可以促進(jìn)器械內(nèi)的胰島與周圍環(huán)境的物質(zhì)交換。Naficy等制備了一種由聚丙烯乙二醇(polypropylene glycol, PPG)和親水聚氨酯(hydrophilic polyurethane, HPU)構(gòu)成的可移除式多孔管狀器械�����,用于β細(xì)胞或胰島移植�����。HPU-PPG水凝膠剛度范圍為100 ~ 400 kPa,可提供機(jī)械支撐�����。為了獲得該器械�����,首先需要制備氯化鈉顆粒預(yù)填充的水凝膠�����,再用水沖洗除去氯化鈉晶體,從而獲得多孔結(jié)構(gòu)�����。這些孔洞中可以填充海藻酸鈉水凝膠,用于進(jìn)一步負(fù)載β細(xì)胞系或胰島細(xì)胞簇�����。實驗發(fā)現(xiàn)�����,海藻酸鈉水凝膠與內(nèi)部細(xì)胞具有良好的生物相容性。體外實驗結(jié)果表明�����,相比于普通RPMI 1640培養(yǎng)基�����,含33 mmol·L?1葡萄糖溶液的HEPES緩沖液[Krebs-Ringer Bicarbonate N-(2-hydroxyethyl)piperazine-N'-2-ethane sulfonic acid buffer]可以更好地刺激負(fù)載在器械中的胰島釋放出胰島素,使24 h內(nèi)胰島素釋放量翻倍�����。結(jié)果表明,胰島可能比β細(xì)胞系具有更好的糖響應(yīng)胰島素釋放性能。此外�����,水凝膠不易降解�����,在植入后可以完整取出�����。
三�����、大尺寸器械用于心血管疾病治療
心肌梗死(myocardial infarction, MI)會造成心肌細(xì)胞損傷�����,致使約36%的MI幸存者面臨較高的心衰風(fēng)險。干細(xì)胞療法能夠通過旁分泌機(jī)制�����,分泌再生因子治療MI�����,改善心臟功能�����,預(yù)防心力衰竭。因此�����,延長MI部位干細(xì)胞的滯留時間�����,具有改善干細(xì)胞治療MI療效的潛力�����。其中�����,可注射支架和心臟貼片已被開發(fā)用于提高細(xì)胞遞送效率�����?����?勺⑸渲Ъ芸蔀橹踩氲募?xì)胞提供生理支持�����,誘導(dǎo)血管形成,緩解纖維化�����。心臟補(bǔ)片可以提供直接的機(jī)械支持來增強(qiáng)心臟功能�����,并構(gòu)建一個適合細(xì)胞生長的微環(huán)境。
(一)心臟補(bǔ)片用于MI治療
Kim等將脫去細(xì)胞的細(xì)胞外基質(zhì)(decellularized cell-derived extracellular matrice, CDM)沖壓在聚乙烯醇(polyvinyl alcohol, PVA)水凝膠上,獲得可拉伸的細(xì)胞外基質(zhì)薄膜�����,用于干細(xì)胞的遞送�����。CDM能夠促進(jìn)細(xì)胞黏附�����,提高NIH-3T3成纖維細(xì)胞在器械內(nèi)的增殖速度�����。在大鼠MI模型中�����,負(fù)載間充質(zhì)干細(xì)胞器械的治療效果優(yōu)于直接注射或與FN/PVA水凝膠共用的間充質(zhì)干細(xì)胞�����,顯示了該器械的優(yōu)越性�����。基于心肌細(xì)胞外基質(zhì)和甲基丙烯酸明膠(gelatin methacrylate, GelMA)�����,Bejleri等也設(shè)計了一種生物打印的心臟補(bǔ)片,用于遞送心臟祖細(xì)胞�����。這種心臟補(bǔ)片具有足夠的機(jī)械強(qiáng)度�����,能夠有效促進(jìn)新血管再生�����,并能在體內(nèi)保留14天以上�����。
Song等開發(fā)了一種引入導(dǎo)電高分子聚丙烯酸的氧化海藻酸鈉-明膠水凝膠,具有良好的自愈性�����、生物相容性�����、導(dǎo)電能力以及機(jī)械穩(wěn)定性。在凝膠內(nèi)培養(yǎng)的新生兒心肌細(xì)胞表現(xiàn)出改善的分化肌節(jié)和細(xì)胞間接觸�����,以及組織良好的肌節(jié)α-肌動蛋白和定向分布的肌節(jié)�����。該貼片能夠顯著抑制心肌纖維化�����,增加左室壁厚度�����,促進(jìn)血管生成�����。Song等也利用重編程的成纖維細(xì)胞制備了預(yù)血管化的心臟補(bǔ)片�����。
此外�����,為了避免因器械內(nèi)細(xì)胞活力降低導(dǎo)致的治療功能減弱或喪失�����、增加貼片的保存時間與擴(kuò)展應(yīng)用場景�����,Huang等研制了一種可以冷凍保存的、負(fù)載并能夠分泌細(xì)胞因子的心臟補(bǔ)片用于MI后的心臟修復(fù)�����。
(二)微針陣列貼片用于MI治療
如何實現(xiàn)貼片與MI部位的物質(zhì)交換效率以提高治療效果仍具有較大挑戰(zhàn)�����。為了促進(jìn)微針貼片與MI給藥部位的物質(zhì)交換�����,Tang等制備了一種負(fù)載CSC的微針陣列貼片�����,方便CSC與MI部位細(xì)胞的物質(zhì)交換�����,促進(jìn)細(xì)胞再生因子向受損心肌的運輸[圖7(a)]�����。微針陣列貼片由易結(jié)晶的PVA制備而成 [圖7(b)]�����。貼片上的微針可以刺入心肌組織,吸收組織間隙液發(fā)生微腫脹�����,在凝膠內(nèi)部形成微米級通道,允許貼片與宿主心肌細(xì)胞直接進(jìn)行物質(zhì)交換和信息傳遞�����。CSC被包裹在位于MN貼片背面的生物相容性纖維蛋白凝膠中[圖7(c)]�����,并保持良好的存活率[圖7(d)]�����。與直接進(jìn)行心肌組織內(nèi)注射相比�����,這種方法延長了CSC在損傷部位的滯留時間�����。在培養(yǎng)基中培養(yǎng)時,整合在貼片頂部的細(xì)胞在7天內(nèi)存活狀況良好[圖7(e)]�����。另外,CSC能夠從纖維蛋白凝膠遷移到微針貼片的腔中[圖7(f)]�����,并分泌再生因子到培養(yǎng)基中�����,從而證明其具備提高心肌細(xì)胞活力的能力[圖7(g)]�����。在大鼠MI模型中[圖7(h)]�����,將含有1 × 106個基質(zhì)細(xì)胞的MN貼片貼在新形成的MI區(qū)[圖7(i)和(j)],并在MI區(qū)放置7天以上[圖7(k)]�����。與對照組相比�����,治療后心肌細(xì)胞凋亡數(shù)量減少�����,血管生成密度顯著增加[圖7(j)]�����,心臟的梗死壁和存活組織較厚[圖7(j)]�����。治療三周后,接受MN-CSC移植的心臟纖維化程度降低[圖7(l)]�����。
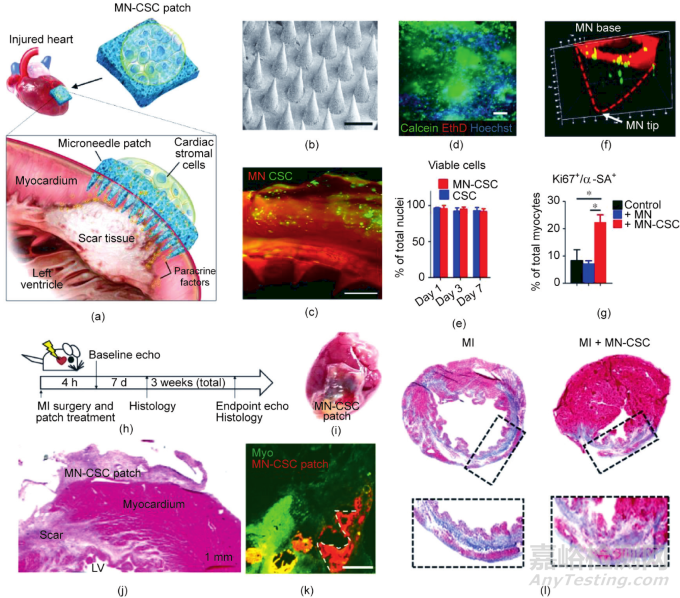
圖7. 微針陣列貼片遞送心臟基質(zhì)細(xì)胞用于MI治療。(a)細(xì)胞整合的微針貼片的設(shè)計示意圖�����。(b)微針貼片的代表性圖像�����,比例尺:500 μm�����。(c)細(xì)胞整合的微針貼片的熒光圖像,比例尺:500 μm�����。(d)細(xì)胞活/死染色的代表性圖像,比例尺:200 μm�����。(e)細(xì)胞存活率的定量分析�����,n = 3�����,數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差表示。(f)細(xì)胞(綠色)與微針貼片整合3天后的代表性共聚焦圖像�����。(g)用增殖標(biāo)志物Ki67和α-肉瘤肌動蛋白(α-SA)對新生大鼠心肌細(xì)胞(NRCM)進(jìn)行的定量分析�����。NRCM單獨培養(yǎng)或在有MN或MN-CSC補(bǔ)丁的情況下培養(yǎng)�����,n = 3,數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差表示�����。(h)動物研究的整體設(shè)計示意圖。(i)用細(xì)胞貼片處理的心臟的代表性圖像�����。(j)用細(xì)胞貼片處理的心臟的蘇木精和伊紅(H&E)染色�����,LV:左心室�����。(k)用微針貼片處理后7天的心臟的熒光圖像�����,比例尺:400 μm�����。(l)使用Masson's三色染色的心肌切片的代表性圖像�����,心臟是在心肌梗塞三周后獲得的�����,藍(lán)色表示疤痕組織�����;紅色表示存活的心肌�����。
(三)可填充式細(xì)胞儲庫用于MI治療
在另一項研究中�����,Whyte等制備了一種治療型細(xì)胞儲庫�����,主要通過干細(xì)胞分泌的旁分泌因子治療心肌梗死�����。該器械主要由三個部分組成:附著于心臟的細(xì)胞儲庫、植入皮下的通路端口和連接它們的管道。儲庫的可透膜面向心臟表面�����,而不透膜向外�����。體外實驗表明�����,儲存在器械內(nèi)的小鼠間充質(zhì)干細(xì)胞能夠在培養(yǎng)基中存活28天,并持續(xù)向培養(yǎng)基中釋放熒光素酶�����。此外�����,該研究證實�����,通過填充管道�����,可向細(xì)胞儲庫補(bǔ)充干細(xì)胞�����。由于間充質(zhì)干細(xì)胞的生存時間較短�����,這種多次反復(fù)給藥的策略可以在多個時間尺度上向MI部位遞送細(xì)胞相關(guān)因子�����,包括細(xì)胞因子�����、趨化因子和旁分泌因子�����。
四�����、大尺寸器械用于CAR-T細(xì)胞療法
CAR-T細(xì)胞療法在治療pre-B型急性淋巴細(xì)胞白血病或B細(xì)胞淋巴瘤方面取得較好的效果�����,但是應(yīng)用于實體瘤治療時仍面臨多重挑戰(zhàn)�����。CAR-T細(xì)胞是發(fā)揮抗癌活性的直接功能介質(zhì)�����,因此在設(shè)計用于實體腫瘤治療的CAR-T細(xì)胞遞送器械時�����,必須考慮提升CAR-T細(xì)胞停留在腫瘤部位的能力和數(shù)量�����,并為細(xì)胞提供物理支持�����,提高CAR-T細(xì)胞的生存能力和抗癌活性。
為了實現(xiàn)上述目標(biāo)�����,Coon等開發(fā)了用于CAR-T細(xì)胞遞送的鎳鈦合金薄膜(thin-film nitinol, TFN)�����。薄膜上設(shè)計有微型圖像�����,允許金屬膜在外力作用下發(fā)生形變,單軸拉伸形變可超過100%�����。通過將纖維蛋白凝膠層覆蓋在器械表面�����,可以促進(jìn)CAR-T細(xì)胞的黏附和遷移�����。此外,抗CD3�����、CD28和CD137的抗體亦被結(jié)合到纖維蛋白凝膠上�����,用以刺激CAR-T細(xì)胞的擴(kuò)增�����。在體外培養(yǎng)實驗中,TFN上的CAR-T細(xì)胞能夠保持功能達(dá)6天�����。在不可切除的卵巢癌模型中�����,通過TFN遞送的CAR-T細(xì)胞能夠根除70%的小鼠腫瘤�����,延長平均生存時間至80天�����,遠(yuǎn)遠(yuǎn)高于靜脈注射或瘤內(nèi)注射CAR-T細(xì)胞的小鼠的生存時間�����。這種方法為增強(qiáng)CAR-T細(xì)胞對實體瘤的抗腫瘤活性提供了一種選擇。
GFOGER修飾的海藻鈉水凝膠也被用于增強(qiáng)T細(xì)胞在腫瘤部位的增殖和滯留能力�����,并對切除的4T1腫瘤和多灶性卵巢癌具有顯著的抗癌活性�����。Weiden等開發(fā)了一種可注射�����、生物相容�����、功能化的聚異氰酸多肽水凝膠�����。當(dāng)T細(xì)胞與其一同注射到腫瘤部位后�����,該凝膠可改善T細(xì)胞在腫瘤部位的停留時間并持續(xù)釋放出細(xì)胞�����。此外�����,將能夠分泌IL-15的CAR-T細(xì)胞與PEG-殼聚糖水凝膠聯(lián)合注射至視網(wǎng)膜母細(xì)胞瘤中,可以顯著提高CAR-T細(xì)胞的抗癌活性�����,從而保住了小鼠的視力。這些治療策略均取得了令人鼓舞的治療結(jié)果�����。然而�����,免疫抑制和低氧的腫瘤微環(huán)境仍可能會阻礙CAR-T細(xì)胞對實體腫瘤的抗癌活性。因此�����,研究人員又發(fā)展了一些新的策略來解決這些問題�����。
為了逆轉(zhuǎn)腫瘤免疫抑制微環(huán)境�����,Hu等設(shè)計了一種可生物降解的HA水凝膠儲庫�����,用于同時遞送硫酸軟骨素蛋白聚糖4(chondroitin sulfate proteoglycan 4, CSPG4)靶向的CAR-T細(xì)胞�����、抗程序性細(xì)胞死亡配體1抗體(anti-programmed cell death ligand 1 antibody, aPDL1)修飾的血小板(P-aPDL1)和細(xì)胞因子IL-15包裹的聚乳酸-羥基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]納米顆粒[圖8(a)和(b)]�����。將水凝膠植入術(shù)后腫瘤部位�����,局部腫瘤的復(fù)發(fā)和遠(yuǎn)端腫瘤生長均得到了抑制�����。水凝膠儲庫能夠持續(xù)緩慢地向周圍腫瘤組織釋放CAR-T細(xì)胞�����,避免了因細(xì)胞突釋而導(dǎo)致的CAR-T細(xì)胞大量失活�����。同時,水凝膠中加載的IL-15能夠維持CAR-T細(xì)胞的活性[圖8(a)]。此外�����,術(shù)后炎癥環(huán)境能夠觸發(fā)血小板活化�����,加速抗aPDL1的釋放,抑制免疫檢查點通路�����,增強(qiáng)CAR-T細(xì)胞的殺傷作用�����。在體外實驗中�����,血小板能夠在96 h內(nèi)完全地從水凝膠中釋放出來�����;與之對比,在相同條件下�����,只有50%的CAR-T細(xì)胞從水凝膠中釋放[圖8(c)]�����。在共體外培養(yǎng)實驗中�����,含有P-aPDL1和CAR-T細(xì)胞的水凝膠顯示出較好的抗癌活性[圖8(d)]�����。在體內(nèi)實驗中,裝載CAR-T細(xì)胞和P-aPDL1的水凝膠儲庫顯示出明顯高于其他組的腫瘤抑制活性[圖8(e)]�����。值得注意的是�����,這種水凝膠的全身抗癌活性證實了水凝膠的單側(cè)給藥可以抑制對側(cè)腫瘤的生長[圖8(f)]�����。
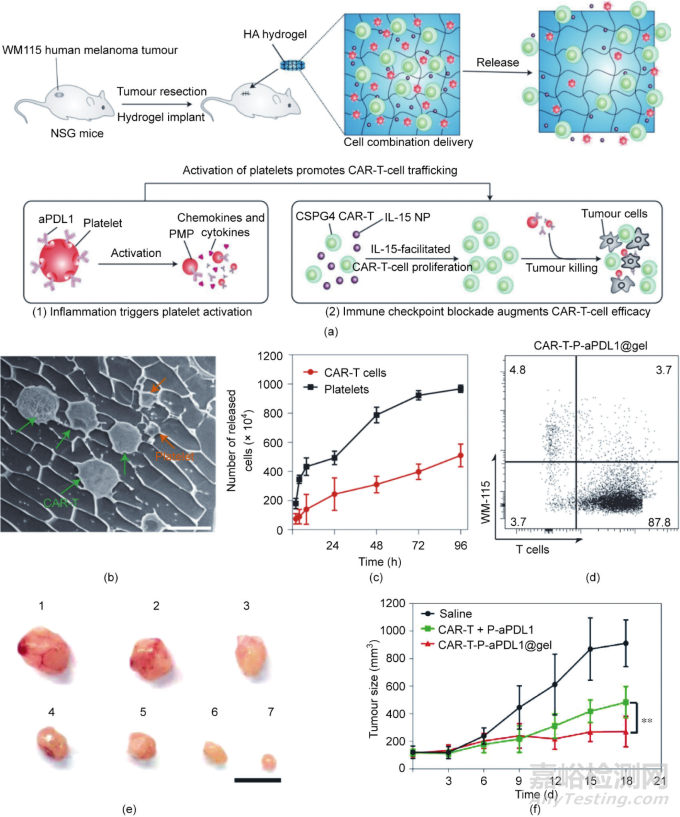
圖8. 一種用于同時遞送和緩慢釋放CAR-T細(xì)胞和偶聯(lián)了a-PDL1的血小板的水凝膠儲庫�����。(a)水凝膠用于手術(shù)后細(xì)胞免疫療法的機(jī)制示意圖�����。PMP:血小板衍生的微粒子;NP:納米粒子�����。(b)裝有細(xì)胞和血小板的水凝膠的典型冷凍掃描電子顯微鏡圖像�����,比例尺:10 μm�����。(c)CAR-T細(xì)胞和血小板在體外的釋放,1×107個CAR-T細(xì)胞和1×107個血小板被裝入水凝膠�����,n = 3�����。(d)腫瘤細(xì)胞和T細(xì)胞共培養(yǎng)72 h后的細(xì)胞流式圖�����,n = 3�����,數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差表示�����。(e)治療三周后小鼠腫瘤的代表性圖像�����,小鼠接受了以下治療�����,1:生理鹽水;2:P-aPDL1@gel�����;3:CAR-T細(xì)胞�����;4:CAR-T + P-aPDL1�����;5:CAR-T@gel�����;6:CAR-T@gel + P-aPDL1�����;7:CAR-T-P-aPDL1�����,比例尺:1 cm�����。(f)右側(cè)原發(fā)腫瘤治療后左側(cè)腫瘤的大小�����,n = 6�����,**P = 0.0023�����,數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差表示�����。
為了改善腫瘤缺氧微環(huán)境�����,Luo等制備了一種多孔水凝膠包被的免疫芯片系統(tǒng)�����,用于同時遞送CAR-T細(xì)胞、IL-15和O2到實體腫瘤中�����。在實體瘤內(nèi)�����,凝膠層逐漸降解并向腫瘤微環(huán)境釋放氧氣�����,從而為CAR-T細(xì)胞提供氧氣�����,促進(jìn)CAR-T細(xì)胞從免疫芯片遷移到腫瘤�����。該療法能夠增強(qiáng)T細(xì)胞對腫瘤基質(zhì)的浸潤并提高細(xì)胞的存活率�����,降低腫瘤細(xì)胞HIF-1α和Ki67的表達(dá)�����,展示出抑制腫瘤生長的能力�����。
五�����、3D打印水凝膠以建立血管網(wǎng)絡(luò)結(jié)構(gòu)
實體器官包含相互穿插的血管網(wǎng)絡(luò)�����,具有物質(zhì)輸送功能?����;谏锵嗳菪运z的3D打印血管網(wǎng)絡(luò)對于人工器官(包括復(fù)合血管骨骼�����、骨骼肌、心臟組織和肝臟)的細(xì)胞生存至關(guān)重要�����。Cui等采用質(zhì)地較硬的PLA和載細(xì)胞的柔性GelMA分別構(gòu)建骨支架和血管�����,將局部生物活性因子固定�����,并結(jié)合3D打印技術(shù)建立具有血管網(wǎng)絡(luò)的骨骼�����。此外�����,Zhang等以內(nèi)皮細(xì)胞自促作用為基礎(chǔ)�����,利用3D打印技術(shù)制備基于水凝膠的含血管心肌組織�����,將血管形成和血管新生結(jié)合起來�����。
最近�����,Grigoryan等開發(fā)了一種3D打印策略�����,創(chuàng)建具有內(nèi)部纏繞血管網(wǎng)絡(luò)的生物相容性水凝膠�����,并通過血管內(nèi)3D流體混合器和二尖瓣進(jìn)一步將其功能化�����。該研究發(fā)現(xiàn)�����,無毒的食品添加劑檸檬黃可吸收多余光子,從而增強(qiáng)立體投影在z軸的分辨率�����,使制備具有纏繞血管網(wǎng)絡(luò)的柔性水凝膠成為可能�����。此外�����,通過3D打印技術(shù)�����,在血管網(wǎng)絡(luò)中還進(jìn)一步引入了功能性血管內(nèi)流體混合器和二尖瓣[圖9(a)]�����,證實這種3D打印技術(shù)能夠產(chǎn)生具有拓?fù)浣Y(jié)構(gòu)的功能性血管�����。在該研究中,研究人員利用3D打印技術(shù)制備了非連續(xù)的立方晶格和纏繞環(huán)面[圖9(b)和(c)]�����,并證實血管間存在O2運輸[圖9(d)]�����。此外�����,該研究還進(jìn)一步制備了具有類似肺泡拓?fù)浣Y(jié)構(gòu)的水凝膠�����,用于研究呼吸過程中的氧氣交換過程[圖9(e)]�����,證實分支的血管網(wǎng)絡(luò)�����、水凝膠膨脹和血液重定向都能夠?qū)崿F(xiàn)更快的氧氣交換�����。研究人員還制備了包裹哺乳動物細(xì)胞的可植入水凝膠�����,驗證了這種打印策略與活細(xì)胞的相容性�����。該纖維蛋白水凝膠器械中含有肝臟組織聚集物�����、內(nèi)皮細(xì)胞嵌入的血管腔以及用于固定纖維蛋白凝膠的水凝膠錨栓�����,被用作肝臟模型進(jìn)行研究[圖9(f)和(g)]�����。在慢性肝損傷小鼠模型中�����,該器械能夠在體內(nèi)存活超過14天,并在肝聚集物附近的微血管中發(fā)現(xiàn)了宿主血細(xì)胞�����。這種用于打印血管網(wǎng)絡(luò)的3D打印技術(shù)�����,可應(yīng)用于大型3D器械中�����,促進(jìn)其與機(jī)體的氧氣和營養(yǎng)物質(zhì)的交換�����。
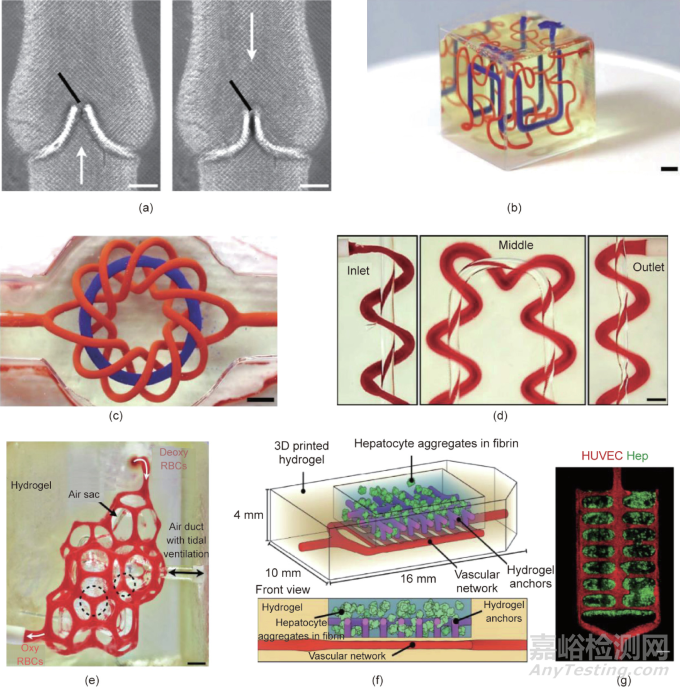
圖9. 具備精密血管結(jié)構(gòu)功能的3D打印柔性水凝膠�����。(a)在由20 wt%的聚乙二醇二丙烯酸酯(PEGDA�����;6 kg•mol-1)制成的水凝膠中3D打印出纏繞的軸向血管和螺旋線�����,比例尺:3 mm�����。(b)水凝膠內(nèi)的希爾伯特曲線�����,比例尺:3 mm�����。(c)環(huán)狀物和環(huán)形結(jié)�����,比例尺:3 mm�����。(d)軸向血管和包圍的螺旋�����,紅細(xì)胞從入口流向出口,比例尺:1 mm�����。(e)有紅細(xì)胞流動的肺泡狀結(jié)構(gòu)的照片�����,Deoxy RBCs:脫氧紅細(xì)胞�����,oxy RBCs:含氧紅細(xì)胞�����,比例尺:1 mm�����。(f)裝有肝細(xì)胞聚集物的多室水凝膠構(gòu)造�����,血管網(wǎng)絡(luò)中播種了內(nèi)皮細(xì)胞�����。(g)部分水凝膠的共聚焦顯微鏡圖像�����,Hep:肝細(xì)胞聚集物�����。
六�����、討論與結(jié)論
在過去的幾年里�����,人們用生物相容的惰性材料或可降解材料制備了具有各種結(jié)構(gòu)的大尺寸器械�����,用于遞送細(xì)胞以治療多種疾?����。ū?)�����。大尺寸器械通常被精心設(shè)計�����,滿足細(xì)胞對營養(yǎng)�����、氧氣�����、細(xì)胞因子和免疫豁免環(huán)境的需求�����,維持細(xì)胞(無論是異體還是異種細(xì)胞)的生存活性和治療功能�����。為了達(dá)到這些目標(biāo)�����,近年來發(fā)展起來的預(yù)血管化策略和構(gòu)建局部免疫抑制環(huán)境的策略�����,能最大限度地為移植物供給氧氣和營養(yǎng)物質(zhì)�����,防止其被宿主免疫系統(tǒng)攻擊�����,從而提高細(xì)胞的負(fù)載率,減少器械體積�����,發(fā)揮出器械應(yīng)有的治療功能。同時�����,這些策略也有助于器械的植入和移除�����。必須指出的是�����,用于細(xì)胞治療的大尺寸器械必須根據(jù)每種疾病的具體要求而定制�����。
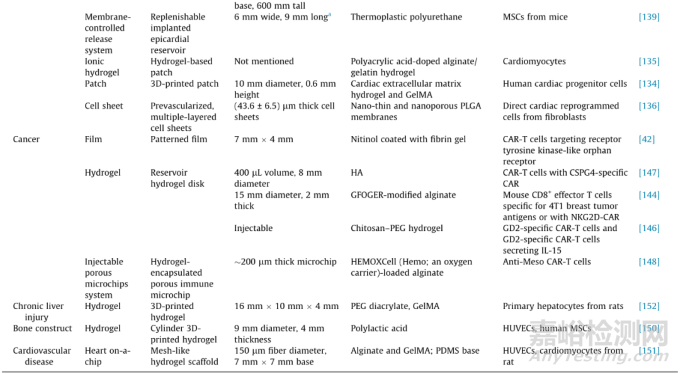
表1 具有代表性的細(xì)胞治療器械
Note: size was estimated from the image of the device provided in these References. PCL: polycaprolactone; PTFE: polytetrafluoroethylene; CP: cell pouch; HA: hyaluronic acid; PPG: polypropylene glycol; PVA: polyvinyl alcohol; 3D: three-dimensional; HUVEC: human umbilical vein endothelial cell; MSC: mesenchymal stem cell; GelMA: gelatin methacrylate.
治療T1D的大尺寸器械在植入期間必須將功能性細(xì)胞限制在裝置內(nèi)部�����,并保證胰島素能夠足量釋放至器械外,以調(diào)節(jié)血糖水平。然而�����,將胰島素分泌細(xì)胞的存活和功能維持足夠長的時間甚至終生仍具有極高的挑戰(zhàn)性�����。使用生物相容性和免疫相容性材料在減少異物反應(yīng)和纖維化方面已經(jīng)取得了一些成功�����。這些策略對于器械和機(jī)體微環(huán)境間物質(zhì)的順利交換以維持器械內(nèi)部封裝的細(xì)胞的功能和活性來說至關(guān)重要�����。此外�����,降低纖維化也避免了裝置與周圍組織的黏附�����,方便器械失效后能夠被移出體外�����。目前�����,胰島或β細(xì)胞植入器械的研究重點仍集中在優(yōu)化腔體器械膜的理化特性,以減少纖維化并促進(jìn)新生血管再生�����。
近年來�����,隨著多能干細(xì)胞來源的胰島素分泌細(xì)胞的相關(guān)研究逐漸成熟�����,異體胰島供應(yīng)短缺的問題得到了一定程度的解決�����。提高分化細(xì)胞在移植期間的存活率可能有利于疾病的治療�����。相比于胰島�����,多能干細(xì)胞來源的治療性細(xì)胞可能潛在的易誘發(fā)全身性疾病或癌癥�����。因此�����,基于這些細(xì)胞的大尺寸器械必須被設(shè)計得足夠堅固和耐用�����。另外�����,植入的位置需要仔細(xì)選擇����,以減少碰撞和器械破裂導(dǎo)致其失效的可能性����。另外����,減少免疫反應(yīng)對細(xì)胞生存至關(guān)重要����,需要更多的研究來證實免疫系統(tǒng)對植入細(xì)胞在周期超過一年時的影響。此外����,與凝膠相比����,腔室型器械具有更高的強(qiáng)度����,可能更適合于干細(xì)胞移植����。
雖然通過干細(xì)胞誘導(dǎo)生成胰島細(xì)胞能夠緩解胰島供應(yīng)短缺的問題����,但是如何將大量細(xì)胞植入尺寸可接受的器械是另一個難點����。據(jù)估計����,要使受試者恢復(fù)正常血糖水平,需要30萬個當(dāng)量的胰島����。然而����,膜控釋系統(tǒng)與生理環(huán)境之間緩慢的養(yǎng)分和氧氣交換要求容器的厚度小于300 µm����。此外����,體內(nèi)可供負(fù)載了細(xì)胞的器械植入的空間有限����。如何提高臨床相關(guān)的密閉擴(kuò)散室中的功能細(xì)胞的密度,同時保持其生存活性和治療功能����,仍然是一個挑戰(zhàn)。將2D結(jié)構(gòu)轉(zhuǎn)化為3D結(jié)構(gòu)或通過外部裝置提供營養(yǎng)物質(zhì)和氧氣(如“β-Air”裝置)是解決這一問題的一種可行選擇����。此外����,利用3D打印技術(shù)����,在植入物內(nèi)部構(gòu)建血管網(wǎng)絡(luò)或空氣網(wǎng)絡(luò)可能有助于解決這一問題����。
在未來����,裝載胰島素分泌細(xì)胞的大尺寸器械可能會成為一種“現(xiàn)成”的產(chǎn)品����,用于治療內(nèi)源性胰島素分泌不足的患者����。大尺寸器械可通過微創(chuàng)手術(shù)植入����。干細(xì)胞來源的治療細(xì)胞作為另一種“現(xiàn)成”產(chǎn)品����,通過器械上的外接端口����,可反復(fù)填充至已植入的器械中����,增強(qiáng)其治療作用����。此外,聯(lián)合使用胰島素分泌細(xì)胞和胰高血糖素分泌細(xì)胞的大尺寸器械����,或能改善血糖控制����。
在眾多基于干細(xì)胞的MI療法中����,為了延長細(xì)胞治療時間����,其中一種療法是將裝載了細(xì)胞的器械植入到心臟表面����,并經(jīng)一個管道多次充填細(xì)胞到器械中����。充足的營養(yǎng)物質(zhì)和氧氣供應(yīng)是延長細(xì)胞生存時間的另一種選擇����,且可以避免復(fù)雜的細(xì)胞填充過程����。如果裝置是可生物降解的����,則不需要移除植入的細(xì)胞和器械,可以避免因器械移除而造成的二次創(chuàng)傷����,增強(qiáng)患者的依從性����。另外,心臟在不停地跳動����,因此如何將器械安裝到心臟表面并固定是一項很有挑戰(zhàn)性的工作����。因此,為了滿足MI的治療要求����,用于治療MI的器械需要具有靈活性����、黏性、耐用性和生物相容性����。在未來����,MI治療器械將能夠同時提供監(jiān)測和細(xì)胞遞送功能。對治療MI的細(xì)胞可根據(jù)病情的發(fā)展進(jìn)行類型和數(shù)量的調(diào)整。
CAR-T細(xì)胞免疫治療中����,器械設(shè)計的重點已經(jīng)從提供物理支持轉(zhuǎn)變?yōu)閷⑨尫诺侥[瘤中的CAR-T細(xì)胞或基因工程T細(xì)胞的治療功能最大化����。此類器械一般植入到腫瘤部位����,直接對病灶部位進(jìn)行細(xì)胞遞送����。再通過生物活性分子修飾器械����,刺激CAR-T細(xì)胞增殖����,增強(qiáng)對腫瘤細(xì)胞的殺傷能力。例如����,PLGA納米顆粒中包裹的IL-15可以顯著促進(jìn)CAR-T細(xì)胞的增殖和存活,從而增強(qiáng)器械的抗實體瘤活性����。未來����,開發(fā)出將細(xì)胞釋放裝置植入內(nèi)部器官腫瘤(而不是皮膚和眼睛等淺表器官)的策略����,將進(jìn)一步擴(kuò)大這種裝置的臨床應(yīng)用����。
本文選自中國工程院院刊《Engineering》2022年第6期
作者:劉薇, 王延芳, 王金強(qiáng), Olivia L. Lanier, Marissa E. Wechsler, Nicholas A. Peppas, 顧臻
來源:Macroencapsulation Devices for Cell Therapy[J].Engineering,2022,13(6):53-70