就在剛剛,F(xiàn)DA加速批準(zhǔn)由衛(wèi)材(Eisai)和渤?。˙iogen)聯(lián)合開發(fā)的Leqembi(lecanemab)用以治療阿爾茨海默病(AD)!Leqembi是近年來靶向β淀粉樣蛋白的第二款創(chuàng)新阿爾茨海默病療法�,本次獲批也代表在阿爾茨海默病治療領(lǐng)域的又一項重要進(jìn)展!
阿爾茨海默病是老年人中最常見的神經(jīng)退行性疾病��,而淀粉樣蛋白沉積是患者大腦的標(biāo)志性特征����。靶向淀粉樣蛋白是阿爾茨海默病新藥開發(fā)的重要方向之一。Leqembi為一抗β淀粉樣蛋白(Aβ)抗體����,能與可溶性Aβ聚合體結(jié)合�,并且促進(jìn)它們的清除����。它具有改變疾病病理��,緩解疾病進(jìn)展的潛力�,F(xiàn)DA曾授予此療法快速通道資格��、優(yōu)先審評資格��、突破性療法認(rèn)定�。
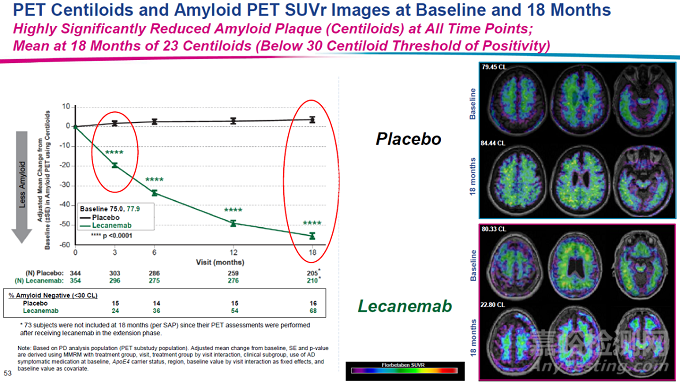
在一項雙盲����、安慰劑為對照組�、平行組別的2b期臨床試驗中,研究人員們納入了856名因AD或輕度AD導(dǎo)致輕度認(rèn)知功能障礙(MCI)的患者�,他們確認(rèn)存在淀粉樣蛋白病理。試驗結(jié)果顯示,接受Leqembi治療患者的淀粉樣蛋白呈現(xiàn)劑量與時間相關(guān)下降。接受獲批劑量(每兩周10 mg/kg)Leqembi的患者自基線至第79周,大腦中淀粉樣蛋白水平出現(xiàn)統(tǒng)計上的顯著降低��,相較之下����,安慰劑組患者的淀粉樣蛋白水平則維持不變。
▲Lecanemab顯著降低大腦中的淀粉樣蛋白沉積(圖片來源:參考資料[2])
在2022年年底召開的阿爾茨海默病臨床試驗大會上��,衛(wèi)材和渤健公布Leqembi的3期臨床試驗數(shù)據(jù)。與安慰劑相比����,Leqembi在18個月后將評估患者認(rèn)知和日常功能的綜合評分CDR-SB的增加速度降低27%(CDR-SB評分越高意味著患者臨床功能越低)����,并在18個月里將淀粉樣蛋白沉積水平降低約70%。在接受治療6個月后�,Leqembi組與安慰劑組的CDR-SB評分就出現(xiàn)統(tǒng)計顯著的差別�,并且在治療過程中差別持續(xù)擴大��。這一結(jié)果代表著靶向淀粉樣蛋白的阿爾茨海默病療法在3期臨床試驗中的重要突破�。FDA預(yù)計不久后會收到此一完整數(shù)據(jù)的遞交�。
“阿爾茨海默病造成患者在日常生活中嚴(yán)重失能����,并對他們的家人產(chǎn)生巨大的影響,” FDA藥物評估和研究中心(CDER)神經(jīng)科學(xué)主任Billy Dunn博士說道,“這項治療選項是靶向且影響阿爾茨海默病潛在病理機制與疾病進(jìn)展的最新療法��,并非僅僅治療疾病癥狀。”
參考資料:
[1] FDA Grants Accelerated Approval for Alzheimer’s Disease Treatment. Retrieved January 6, 2023 from https://www.fda.gov/news-events/press-announcements/fda-grants-accelerated-approval-alzheimers-disease-treatment
[2] 2022 Clarity AD CTAD Presentations. Retrieved January 6, 2023, from https://www.eisai.com/ir/library/presentations/pdf/e4523_221130.pdf