摘 要 Abstract
脂質(zhì)納米顆粒(LNP)遞送技術(shù)的突破,推動(dòng)了RNA 療法的發(fā)展��,受到了廣泛關(guān)注���。mRNALNP制備是mRNA 疫苗從純化mRNA(原液)到成品(制劑)的生產(chǎn)過程的關(guān)鍵步驟,涉及脂質(zhì)制備或篩選�����、mRNA 包封/ 裝載��、純化等工序,目前最常用的方法是將水相和脂質(zhì)成分快速混合的微流控法�����?��;贚NP 自組裝的特點(diǎn)���,本文梳理了微流控條件下mRNA-LNP 制備的考慮要點(diǎn)。首先��,在制備過程中��,各脂質(zhì)成分比例�����、脂質(zhì)和水相的流體動(dòng)力學(xué)�����、pH 值控制��、緩沖液的選擇與LNP 顆粒大小��、形態(tài)、封裝效率和表面電荷等關(guān)鍵質(zhì)量屬性息息相關(guān)���,需要不斷探索mRNA-LNP 制備的關(guān)鍵工藝參數(shù)和最佳操作范圍���。其次,還應(yīng)關(guān)注mRNA 在被包封到LNP 過程中的降解問題���,以及生產(chǎn)過程中mRNA 原液的任何變化對LNP 的影響�����。此外�����,本文還提出了針對含有多種mRNA 分子的疫苗(如自我擴(kuò)增型mRNA 疫苗和多價(jià)疫苗)中LNP 制備的考慮要點(diǎn),以期為國內(nèi)相關(guān)企業(yè)在mRNA 疫苗制劑生產(chǎn)質(zhì)量控制方面提供有益參考��。
The breakthrough of lipid nanoparticle (LNP) delivery technology has promoted the development of RNA-based therapies, which has attracted extensive attention. The preparation of mRNA-LNP is a key step in the manufacturing process of mRNA vaccine from the bulk purified mRNA (drug substance) to the final vaccine (drug product), which involves lipid preparation and screening, mRNA encapsulation/loading, purification and other processes. The most common method for mRNA-LNP preparation is to rapidly mix the aqueous phase and lipid components by microfluidic technology. Based on the characteristics of self-assembly of LNP, some considerations on the preparation of mRNA-LNP under microfluidic conditions were summarized in this article. Firstly, it was found that some important parameters in process such as the proportion of each lipid component, flow dynamics of the lipid and aqueous phase, pH control,and the selection of buffer would be closely related to the key quality attributions of LNP, for example, particle size, morphology, encapsulation efficiency, and surface charge. Therefore, it is necessary to continuously explore the critical process parameters and their operational ranges optimal for mRNA-LNP. Secondly, specific attention should be given to degradation of the mRNA during encapsulation into the LNP and the impact of any change related to the mRNA drug substance on the critical quality attributes of the LNP. In addition, this article raised some concerns about the preparation of LNP in final vaccines containing multiple mRNA species such as selfamplifying mRNA vaccines and multivalence mRNA vaccines. It is hoped that these considerations will provide useful reference for domestic enterprises in the quality control of drug products of mRNA vaccines.
關(guān)鍵詞 Key words
脂質(zhì)納米顆粒���;mRNA 疫苗�����;制劑�����;質(zhì)量控制
lipid nanoparticle; mRNA vaccine; drug products; quality control
mRNA 疫苗因其抗原設(shè)計(jì)簡單���、適應(yīng)性強(qiáng)�����、具有誘導(dǎo)體液免疫和細(xì)胞免疫應(yīng)答的潛力��,以及具有高效���、快速、低成本的生產(chǎn)特點(diǎn)��,在疫苗領(lǐng)域引起了一場巨大的革命���。已有多種mRNA 疫苗被用于傳染性疾病和癌癥的研究��,并顯示出一定的優(yōu)越性���。而作為在新冠肺炎(COVID-19)大流行期間首批進(jìn)入臨床開發(fā)的候選疫苗�����, 兩款COVID-19 mRNA疫苗——BNT162b2 和mRNA-1273���,憑借Ⅲ期臨床試驗(yàn)中約95% 的有效性[1-2],被一些國家或地區(qū)的監(jiān)管機(jī)構(gòu)批準(zhǔn)用于緊急使用�����,以抗擊新冠肺炎疫情[3-4]���。其中�����,BNT162b2 是首個(gè)被列入世界衛(wèi)生組織(WHO)緊急使用清單的mRNA 疫苗[5]��。截至2022 年9 月��, 全球共有371個(gè)COVID-19 候選疫苗處于開發(fā)階段��,其中屬于mRNA 技術(shù)路線的有65 個(gè),40 個(gè)已進(jìn)入臨床試驗(yàn)階段[6]���。隨著COVID-19mRNA 候選疫苗臨床試驗(yàn)進(jìn)展的不斷推進(jìn)��, WHO[7]�����、美國食品藥品監(jiān)督管理局(FDA)[8]�����、歐洲藥品管理局(EMA)[9]��、我國國家藥品監(jiān)督管理局藥品審評中心(CDE)[10] 等監(jiān)管機(jī)構(gòu)陸續(xù)發(fā)布了相應(yīng)的指南���,旨在規(guī)范和指導(dǎo)對此類產(chǎn)品的申報(bào)���。其中,WHO近期發(fā)布的《關(guān)于預(yù)防傳染病mRNA 疫苗質(zhì)量�����、安全性及有效性評估的法規(guī)考慮》(Evaluation ofthe Quality, Safety and Efficacy of Messenger RNA Vaccines for the Prevention of Infectious Diseases:Regulatory Considerations)[7] 是針對mRNA 產(chǎn)品的首個(gè)全球性法規(guī)���,對于指導(dǎo)各國(地區(qū))監(jiān)管當(dāng)局評價(jià)此類產(chǎn)品��、明確監(jiān)管要求具有重要指導(dǎo)意義�����。本文基于已上市RNA 產(chǎn)品生產(chǎn)工藝的主要特點(diǎn),結(jié)合最新的WHO 法規(guī)要求�����,以及當(dāng)前mRNA 脂質(zhì)納米顆粒(mRNA-LNP) 設(shè)計(jì)、生產(chǎn)和應(yīng)用特點(diǎn)�����,對mRNA-LNP生產(chǎn)過程中的質(zhì)量控制考慮要點(diǎn)進(jìn)行了梳理。
1�����、mRNA-LNP 的應(yīng)用進(jìn)展
脂質(zhì)納米顆粒(lipidnanoparticle���,LNP) 通常由多種脂質(zhì)組成�����,用于包封mRNA 和增強(qiáng)其穩(wěn)定性的遞送系統(tǒng),可以避免mRNA 在細(xì)胞外降解���,促進(jìn)其被細(xì)胞攝取和釋放到細(xì)胞質(zhì)中。脂質(zhì)成分包括但不限于可電離/ 陽離子脂質(zhì)���、輔助脂質(zhì)[ 如中性脂質(zhì)和(或)膽固醇] 和通過聚乙二醇化(PEGylation)修飾的脂質(zhì)[7]。LNP 的出現(xiàn)對RNA 療法的發(fā)展具有里程碑式的意義�����,成功解決了對RNA 進(jìn)行保護(hù)和遞送的難題。目前���,基于病毒和非病毒的載體都已被開發(fā)用于RNA的遞送。其中�����,基于病毒的載體主要包括逆轉(zhuǎn)錄病毒載體�����、慢病毒載體��、腺病毒載體和痘病毒載體[11]��。通常��,基于病毒的載體通過病毒感染途徑侵入細(xì)胞��,因此它們具有基因?qū)胄矢?����、基因定點(diǎn)傳遞��、免疫反應(yīng)增強(qiáng)等優(yōu)點(diǎn)���,但也存在致突變、致癌等缺點(diǎn)[12]��。與病毒載體相比���,非病毒載體(如魚精蛋白復(fù)合物�����,陽離子脂質(zhì)體和基于脂質(zhì)���、聚合物或脂質(zhì)/ 聚合物的納米顆粒等)表現(xiàn)出更好的靈活性和安全性[13-14]�����,而LNP由于具有相對容易和可規(guī)?����;纳a(chǎn)方式���, 現(xiàn)已被用于前沿的mRNA 候選疫苗和廣泛使用的新型冠狀病毒疫苗。
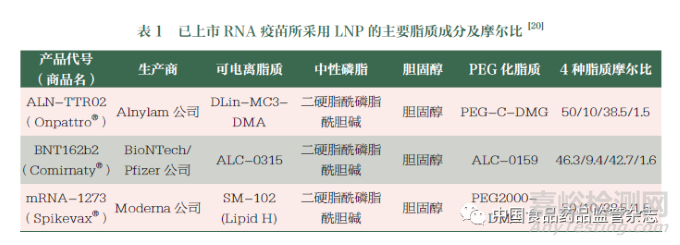
可電離的陽離子脂質(zhì)(ionizable lipids��,ILs) 的開發(fā)使實(shí)現(xiàn)RNA 細(xì)胞質(zhì)遞送成為可能���。最早的LNP 制劑是于2018 年上市的siRNA 疫苗Onpattro®�����,其前身是包裹質(zhì)粒DNA 的質(zhì)粒脂質(zhì)顆粒(SPLP)[15]��,后進(jìn)一步發(fā)展為含有小干擾RNA(siRNA)的穩(wěn)定化核酸脂質(zhì)顆粒(SNALP)[16]��,再經(jīng)過對陽離子脂質(zhì)的一系列優(yōu)化和篩選后獲批上市�����。作為首個(gè)使用ILs 的RNA上市藥品��,ALN-TTR02 包含對pH 值敏感的ILs( DLin-MC3-DMA)��,其被設(shè)計(jì)成在酸性pH 條件下質(zhì)子化呈正電性�����,而在生理pH 條件下幾乎呈中性��。與陽離子脂質(zhì)相比�����,ILs 不僅有利于在酸性pH 條件下與帶負(fù)電荷RNA 發(fā)生靜電相互作用�����,還能夠誘導(dǎo)內(nèi)體逃逸和降低細(xì)胞毒性[17]���。換句話說,可電離的LNP 不易被網(wǎng)狀內(nèi)皮系統(tǒng)識別然后被去除[18]。進(jìn)入內(nèi)體后�����,可電離的LNP 在內(nèi)體的酸性環(huán)境(pH 值為5~6) 中帶正電荷��,并自發(fā)地與陰離子內(nèi)體脂質(zhì)融合���,從而將RNA 釋放到細(xì)胞質(zhì)中���。當(dāng)ILs 的解離常數(shù)(pKa) 值介于6.2~6.5 之間時(shí),通過靜脈注射途徑可以實(shí)現(xiàn)靶向肝臟的最佳效率[19]��。此后上市的兩款COVID-19 mRNA 疫苗顯然借鑒了Onpattro®的納米平臺技術(shù)�����,但分別對ILs 進(jìn)行了優(yōu)化���。在mRNA-1273 的開發(fā)中�����, 考慮到Onpattro® 中DLin-MC3-DMA 的緩慢降解可能導(dǎo)致潛在的毒性���,Moderna 公司開發(fā)了一類新型可電離脂質(zhì)SM-102��,以替代DLin-MC3-DMA [20] �����;而BNT162b2 也同樣基于上述考慮�����,使用了Acuitas 公司的可電離脂質(zhì)ALC-0315[20]��。上述兩款COVID-19 mRNA 疫苗的脂質(zhì)均由ILs��、PEG 化脂質(zhì)、中性脂質(zhì)和膽固醇組成�����,但4 種脂質(zhì)的摩爾比相對不同��,具體見表1���。
2���、mRNA-LNP 的制備
LNP 的制備依賴于自組裝能力���,即脂質(zhì)成分發(fā)生分子間相互作用而自發(fā)組織成納米結(jié)構(gòu)實(shí)體��。在mRNA 疫苗中��,帶負(fù)電荷的mRNA 和帶正電荷的可電離/ 陽離子脂質(zhì)之間通過靜電相互作用結(jié)合���,再通過脂質(zhì)組分之間的疏水作用和范德華作用進(jìn)行組裝��,進(jìn)而形成mRNA-LNP 復(fù)合物���。該過程是從純化mRNA(原液)到成品(制劑)的生產(chǎn)過程的關(guān)鍵步驟,涉及脂質(zhì)制備或篩選��、mRNA 包封/ 裝載�����、純化等工序[10]��。
2.1 脂質(zhì)制備或篩選
應(yīng)對所選擇脂質(zhì)的來源和純度進(jìn)行表征。例如���, 對于動(dòng)物源性( 包括人源性) 材料��,應(yīng)符合現(xiàn)行的《WHO 與藥品生物制品相關(guān)的傳染性海綿狀腦病指南》(WHO Guidelineson Transmissible Spongiform Encephalopathies in Relation to Biological and Pharmaceutical Products)[21] 的相關(guān)要求���;對于潛在外源因子,應(yīng)提供相關(guān)支持性證據(jù)和風(fēng)險(xiǎn)評估結(jié)果�����,確保其已被去除或得到控制[7] ���;對于此前未開展過非臨床或臨床研究的新型脂質(zhì)���,應(yīng)提供其生產(chǎn)工藝和檢定、遺傳毒性和系統(tǒng)毒性評估的詳細(xì)信息[7]�����。最后���,對于由脂質(zhì)產(chǎn)生的潛在雜質(zhì)(與工藝和產(chǎn)品相關(guān)),應(yīng)就其臨界值進(jìn)行論證�����,以便能夠?qū)ζ溥m當(dāng)檢定和達(dá)到臨床接受范圍[7]。
在對4 種脂質(zhì)成分的篩選中���,ILs 是最關(guān)鍵的�����,它是影響mRNA 遞送和轉(zhuǎn)染效率的決定性因素���。如上所述,需要將ILs 設(shè)計(jì)為對內(nèi)體酸化反應(yīng)敏感[22]���。因此�����,pKa 被視為篩選的重要指標(biāo)���。此外,為提升遞送效率��,通常還需要考慮ILs 的分子形態(tài)(優(yōu)先考慮錐形結(jié)構(gòu))和可降解性。中性輔助磷脂一般為飽和磷脂��,可提高陽離子脂質(zhì)體的相變溫度�����,支持層狀脂質(zhì)雙層結(jié)構(gòu)的形成并穩(wěn)定其結(jié)構(gòu)排列�����,常用的有二硬脂酰磷脂酰膽堿(DSPC)�����、二油酰磷脂酰乙醇胺(DOPE) 等��。膽固醇有較強(qiáng)的膜融合性�����,促進(jìn)mRNA 胞內(nèi)攝入和胞質(zhì)進(jìn)入��。研究表明���,當(dāng)LNP 遞送系統(tǒng)不含膽固醇時(shí),其穩(wěn)定性和效力均有所下降[23]。PEG 化脂質(zhì)位于脂質(zhì)納米粒表面���,其含量決定顆粒的大小���,主要用于改善LNP 親水性,避免其被免疫系統(tǒng)快速清除�����,防止顆粒聚集��,增加穩(wěn)定性�����。不同于其他脂質(zhì)�����,研究發(fā)現(xiàn)��,過多的PEG 會對LNP 的細(xì)胞攝入和轉(zhuǎn)染產(chǎn)生不利影響[20,22-23]�����。因此,PEG 化脂質(zhì)被設(shè)計(jì)成最終會發(fā)生解離并使PEG 脫落���。通過調(diào)整4 種脂質(zhì)的比例���,可以改變LNP的理化屬性,如顆粒大小�����、形態(tài)�����、封裝效率和表面電荷�����,從而更好地適應(yīng)接種的組織[24]��。
2.2 mRNA 包封/ 裝載
目前��, 絕大多數(shù)LNP 的合成主要基于自組裝的原理��。“自組裝”的概念來源于材料學(xué)�����,是指由非共價(jià)相互作用驅(qū)動(dòng)的單個(gè)分子自發(fā)排列成超分子組裝體[25]�����,其最主要的特點(diǎn)是可以通過簡單的組分混合來完成制備���,并且通過微調(diào)單個(gè)組分可以改變整個(gè)復(fù)合體的理化特性[22]��。雖然上述兩款COVID-19mRNA 疫苗自組裝的技術(shù)細(xì)節(jié)尚未公布�����, 但Moderna 公司發(fā)布的關(guān)于交錯(cuò)人字形微流體混合器(staggered herringbone micromixer, SHM)[26-28] 和乙醇納米沉淀(ethanol-dropnanoprecipitation)[29-30] 的研究���,以及關(guān)于BNT162b2 的研究[31-32]表明, 兩款COVID-19 mRNA疫苗采用的LNP 是由脂質(zhì)的乙醇相溶液通過滲濾轉(zhuǎn)移到水相緩沖液中形成的�����。此外���,一些研究亦證實(shí)了利用微流體通過兩相溶液混合包封形成mRNA-LNP 的可行性[30,33-35]。微流體技術(shù)被認(rèn)為是一種適用于《藥品生產(chǎn)質(zhì)量管理規(guī)范》(Good Manufacturing Practice���,GMP)設(shè)施的可擴(kuò)展系統(tǒng),能夠高度控制和提供可重復(fù)的混合力�����,對于混合毫升(ml)級別劑量的溶液十分有效[22,36]��。此前�����,SHM 被廣泛使用���,其常規(guī)流速為12ml/min[37]�����。但當(dāng)生產(chǎn)規(guī)模擴(kuò)大后,單個(gè)SHM 通常難以達(dá)到GMP 所需的高通量速度[38]�����。這導(dǎo)致需要同時(shí)使用多個(gè)SHM才能實(shí)現(xiàn)更高的生產(chǎn)量���,其質(zhì)量控制的難點(diǎn)是需要確保多個(gè)SHM具備相同的關(guān)鍵質(zhì)量屬性�����,如粒徑大小���、分散系數(shù)和包封率[39-41]���。而后續(xù)研發(fā)的環(huán)形微流體混合器(TrM)有效地解決了上述問題,它保留了SHM 的非湍流平流混合�����,同時(shí)通過增加混合器尺寸��,使單混合器的流速提高到近200ml/min, 并保持了mRNALNP的關(guān)鍵質(zhì)量屬性[18,42]��,確保臨床前生產(chǎn)規(guī)模擴(kuò)大后的兼容性���,并簡化了工藝放大過程��。LNP 的制備原理主要是通過兩相溶液快速混合包封形成復(fù)合物�����,首先需要將4 種脂質(zhì)和純化后的mRNA 原液分別溶于有機(jī)相溶液和酸性水緩沖液���。隨后,將兩相溶液按照適當(dāng)比例進(jìn)行快速混合��。在該過程中,酸性溶液會促使脂質(zhì)中的可電離脂類離子化而呈正電性���,從而實(shí)現(xiàn)與帶負(fù)電荷的mRNA 結(jié)合形成有效包封�����。與此同時(shí)�����, 隨著對乙醇相溶液的稀釋�����, 脂質(zhì)的溶解度不斷降低并逐漸析出凝固���, 從而形成在水相溶液中包裹mRNA 的脂質(zhì)顆粒[43]。
2.3 復(fù)合物的純化
在對mRNA 進(jìn)行包封后���,需要使用切向流過濾(TFF)進(jìn)行純化�����,其目的是去除未包封的mRNA、游離的聚合物或脂質(zhì)材料���,以及mRNA 和脂質(zhì)溶劑等���。在此過程中,通常選擇具有適當(dāng)截留分子量(MWCO)的超濾膜��,以確保mRNA-LNP 復(fù)合物無法通過濾膜���。此外��,除菌過濾是保障疫苗制劑無菌性的重要步驟��,通過除菌級過濾器�����,使細(xì)菌等微生物���、污染物和雜質(zhì)在過濾器中被截留并隨其丟棄[44]。
3�����、微流控條件下mRNALNP制備的質(zhì)量控制
如上所述, 在微流控條件下���,基于LNP 具有自組裝的特性��,可以通過將水相和脂質(zhì)成分快速混合來完成mRNA-LNP制備���。該方法的優(yōu)勢是可以通過建立相關(guān)控制操作條件的關(guān)鍵工藝參數(shù)和最佳操作范圍,實(shí)現(xiàn)對LNP 理化特性的精確控制�����,以確保mRNA-LNP 生產(chǎn)的一致性���。
3.1 對脂質(zhì)比例的考慮
在LNP 合成過程中���,脂質(zhì)是必不可少的輔料成分��。研究表明�����,各脂質(zhì)成分比例的細(xì)微差異都可能會影響LNP 的理化屬性���,如顆粒大小��、形態(tài)���、封裝效率和表面電荷的改變���,進(jìn)而導(dǎo)致不同的安全性[23]。因此�����,應(yīng)監(jiān)測脂質(zhì)摩爾比或陽離子脂質(zhì)與mRNA 比例(如氮磷比)的變化情況�����,這也是確定產(chǎn)品一致性和穩(wěn)定性的重要指標(biāo)��。
3.2 總流速和流量比
兩相溶液總流速(total flowrate, TFR)和流量比(flow rateratio, FRR)是影響混合的兩個(gè)重要參數(shù)�����。如前所述�����,mRNA 包封/ 裝載的方式是將有機(jī)溶劑中的脂質(zhì)與含有核酸的水相混合,而TFR 和FRR 決定了所形成LNP的粒徑大小���。通過對多個(gè)陽離子脂質(zhì)體對比發(fā)現(xiàn)��,無論怎樣選擇陽離子脂質(zhì)�����,LNP 的粒徑大小都會隨混合流速的增加而減小��,例如���, 當(dāng)TFR 從5ml/min 增加到10~20ml/min 時(shí),LNP 的粒徑會逐漸減小并趨于穩(wěn)定[18]��。同時(shí)研究還發(fā)現(xiàn)�����,在混合溶液中��,隨著FRR 的增大��,即水相溶液與有機(jī)相溶液比例的增大�����,也會導(dǎo)致LNP 的粒徑變小[18]���。其原因是在混合過程中受到脂質(zhì)和水相的流體動(dòng)力學(xué)和剪切力的共同影響[7]�����,更高比例的水相溶液和更快的流速有助于減少粒子融合而形成更小的粒子[45]���。由此可見,通過對FRR 和TFR 等微流體操作參數(shù)的控制���,可以準(zhǔn)確地生產(chǎn)所需要的LNP�����,這對于確保生產(chǎn)一致性至關(guān)重要���。
3.3 對pH 值的控制
ILs 在酸性pH 條件下帶正電荷、在生理pH 條件下呈中性的特性[46]��,是確保LNP 的形成與mRNA 包封同步完成的關(guān)鍵��。在酸性環(huán)境中�����,ILs 官能團(tuán)通過質(zhì)子化攜帶正電荷�����,同時(shí)由于其在水相溶液中具有疏水性��,能夠驅(qū)動(dòng)囊泡(vesicles)的形成以及與帶有負(fù)電荷的mRNA 的封裝���。最初的囊泡形成后�����,隨著被進(jìn)一步稀釋���、透析或過濾,溶液pH 值升高���,中性環(huán)境可使脂質(zhì)具有更強(qiáng)的疏水性�����,從而推動(dòng)囊泡融合��,導(dǎo)致可電離脂質(zhì)與mRNA 被進(jìn)一步隔離到固體LNP 的內(nèi)部[47]���。在該過程中,pH 值的變化在mRNA包封過程中發(fā)揮了重要作用,當(dāng)兩相溶液混合后�����,pH 值介于水相緩沖液的pH 值與可電離脂質(zhì)乙醇緩沖液的pH 值之間��。因此��,應(yīng)確保初始混合溶液的酸性環(huán)境�����,并對稀釋過程中pH 值的變化進(jìn)行精準(zhǔn)控制�����。此外,pH 值環(huán)境的不同��,亦對LNP 粒徑大小產(chǎn)生影響��。研究發(fā)現(xiàn)���,在酸堿中和過程中��,siRNA-LNP 形態(tài)也在不斷變化��,在pH 值為 4 的酸性條件下融合成的顆粒粒徑較小���,但在pH 值為7.4 的堿性條件下,在透析過程中會融合成粒徑較大的電子致密顆粒[48]�����。
3.4 緩沖液的選擇
混合過程通常還需要使用緩沖劑��、滲透劑和低溫保護(hù)劑等其他輔料���。例如�����,Moderna 公司采用Tris-HCl 緩沖液作為羥基清除劑�����,對mRNA 提供額外的穩(wěn)定作用[47]��。不同的緩沖液對LNP 的關(guān)鍵質(zhì)量屬性也會產(chǎn)生影響��。例如���,研究發(fā)現(xiàn),在使用溴化三甲基-2, 3- 二油酰氧基丙基銨(DOTAP) 制備陽離子脂質(zhì)納米顆粒(cationic lipid nanoparticle��,cLNP) 時(shí)��, 使用Tris 緩沖液產(chǎn)生的cLNP 比使用枸櫞酸鹽緩沖液產(chǎn)生的cLNP粒徑更小���、分散系數(shù)更高���,同時(shí),兩者也顯示出不同的Zeta 電位[18]。因此��,對于緩沖液的使用及其影響���,應(yīng)在mRNA 制劑工藝設(shè)計(jì)中加以考慮��。
3.5 mRNA 原液的考慮
基于裸露mRNA 的不穩(wěn)定性�����,LNP 中mRNA 的包封率/ 比例也應(yīng)被視為關(guān)鍵質(zhì)量屬性���。mRNA 疫苗的劑量取決于mRNA 的含量,因此需要特別關(guān)注并最小化mRNA 在被包封到LNP 過程中的降解問題��,以及生產(chǎn)過程中mRNA 原液的任何變化(如序列��、長度或二級結(jié)構(gòu)的變化)可能對LNP 的關(guān)鍵質(zhì)量屬性(如粒徑大小和分布��、形態(tài)以及表面特性)產(chǎn)生的影響[7]���。為此���,應(yīng)對混合工藝一致性進(jìn)行驗(yàn)證��,確保LNP 中mRNA 的包封率/ 比例符合預(yù)期標(biāo)準(zhǔn)�����。
4��、對含有多種mRNA分子的疫苗中LNP 制備的考慮
對于含有多種mRNA 分子的疫苗��, 如聯(lián)合疫苗、多價(jià)疫苗或自我擴(kuò)增型mRNA(self-amplifying mRNA���,samRNA)疫苗�����,在生產(chǎn)時(shí)應(yīng)給予更多關(guān)注和考慮��。例如��,對于samRNA疫苗��,應(yīng)結(jié)合其不同的產(chǎn)品類型分別進(jìn)行考慮���。對于病毒復(fù)制子與目的抗原基因在同一個(gè)讀碼框的sa-mRNA,其配制成LNP 的生產(chǎn)方法和質(zhì)量控制方法與非自我擴(kuò)增型mRNA 疫苗大致相同。然而�����,對于病毒復(fù)制子在單獨(dú)的讀碼框中的sa-mRNA�����,其編碼復(fù)制子的mRNA 和表達(dá)目標(biāo)抗原的mRNA 可能被編碼在不同的分子上�����。因此�����,在mRNA 包封/ 裝載過程中��,重要的是應(yīng)將上述兩種mRNA 包封在一起�����,以便其在體內(nèi)可以被同一個(gè)細(xì)胞吸收��。這需要采用額外的生產(chǎn)工藝和質(zhì)量控制方法���,如考慮兩個(gè)被包封mRNA 的摩爾比��,以確保所需mRNA 被充分包裹在相同LNP 中[7]���。對于聯(lián)合疫苗或多價(jià)疫苗�����,應(yīng)考慮確保LNP 制備過程中不同種類mRNA 的適當(dāng)比例���,優(yōu)化每種mRNA 的表達(dá),最小化免疫干擾問題�����。另外��,還應(yīng)考慮mRNA 在被包封到LNP 之前是否被混合��,或者是否每個(gè)mRNA被單獨(dú)包封到LNP 后���,再將所形成的兩個(gè)或更多mRNA-LNP 混合?��?傊?�,無論是哪種情況��,都應(yīng)結(jié)合相關(guān)數(shù)據(jù)進(jìn)行說明和驗(yàn)證[7]��。
5���、結(jié)語
隨著Moderna 公司和BioNTech/Pfizer 公司成功開發(fā)了COVID-19 mRNA 疫苗�����,mRNA 平臺技術(shù)和LNP 受到前所未有的關(guān)注�����。我國《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》[49] 明確提出�����,要針對潛在傳染病風(fēng)險(xiǎn)�����,加快建立核酸疫苗等新型疫苗技術(shù)平臺���,滿足應(yīng)急研發(fā)和生產(chǎn)需求���。與此同時(shí),國內(nèi)3 家企業(yè)自主開發(fā)的mRNA 疫苗已經(jīng)進(jìn)入臨床研究階段���,另有至少7 家企業(yè)也在積極推進(jìn)mRNA 技術(shù)的應(yīng)用[50]�����。盡管mRNA 疫苗是一項(xiàng)新技術(shù)且生產(chǎn)相對簡單���,但其中很多工藝的質(zhì)量控制是非常復(fù)雜的�����,且在此類產(chǎn)品的風(fēng)險(xiǎn)評估方面仍需要開展大量研究工作���。本文介紹了mRNA 制劑工藝的主要流程及工藝特點(diǎn)��,結(jié)合WHO 技術(shù)指南和近期相關(guān)研究進(jìn)展�����,梳理分析了mRNA 疫苗制劑過程控制中的關(guān)鍵考慮要點(diǎn)�����,以期為國內(nèi)mRNA疫苗制劑研發(fā)企業(yè)提供參考�����。


