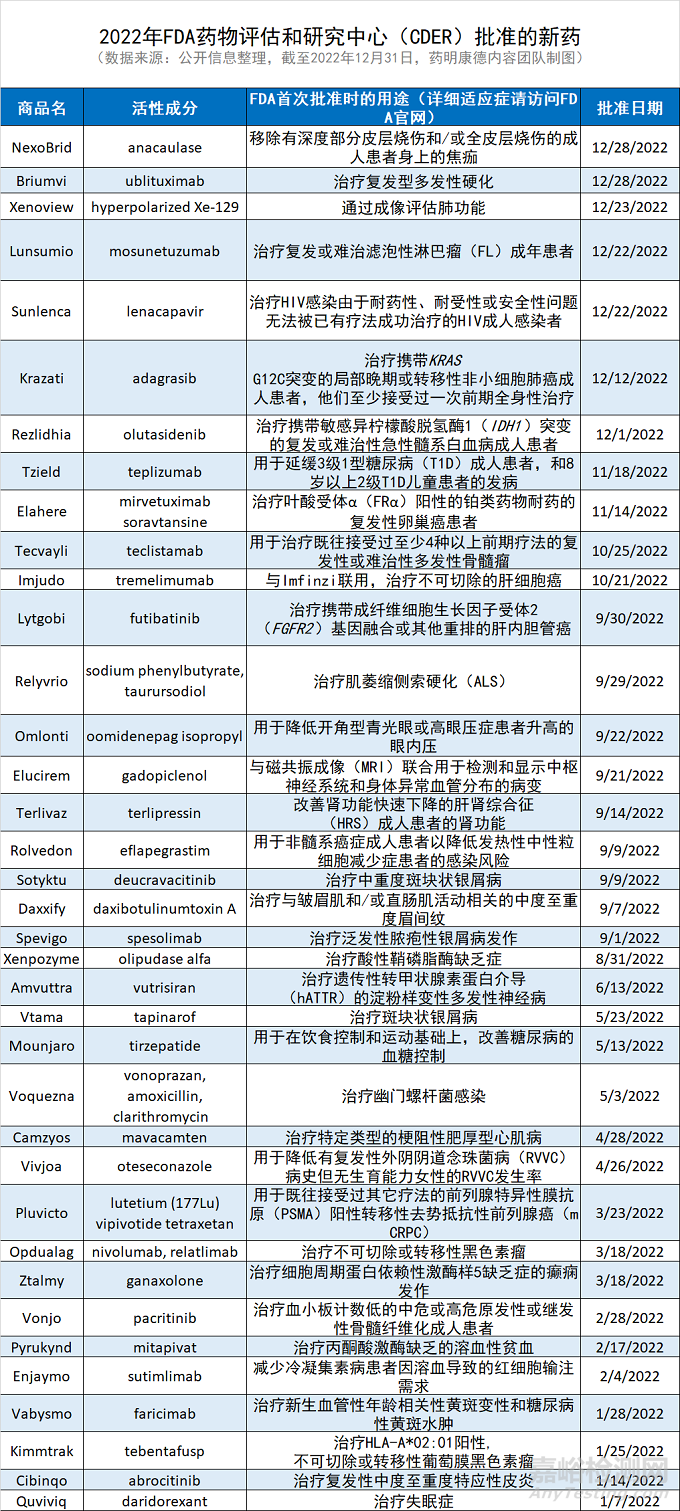
新年伊始�,美國(guó)FDA藥物評(píng)價(jià)和研究中心(CDER)發(fā)布了2022年度的新藥獲批報(bào)告。在這一年里����,CDER一共批準(zhǔn)了37款新藥���。過(guò)去10年里���,CDER每年平均批準(zhǔn)43款新藥。
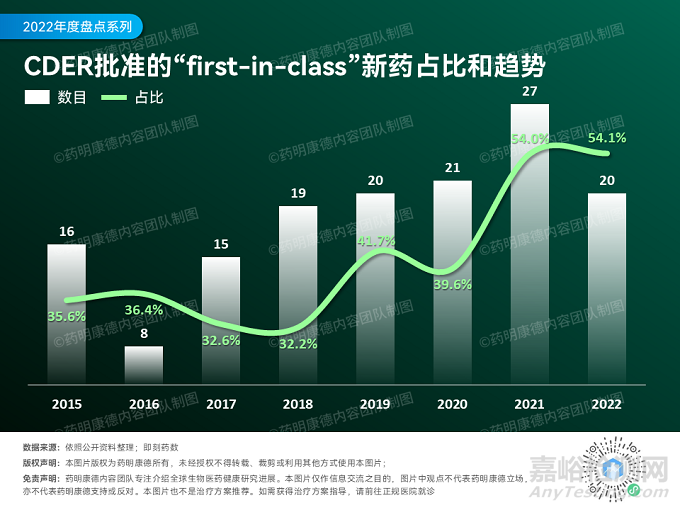
從創(chuàng)新性上看���,今年FDA批準(zhǔn)的新藥里���,共有20款為“first-in-class”療法,占全年獲批新藥總數(shù)的54.1%(20/37)�!從歷史上看,“first-in-class”新藥的占比與去年的54%非常接近����,為近十年來(lái)的最高值。這些新藥的作用機(jī)制不同于已有療法����,有潛力為大眾健康帶來(lái)重要的積極影響。
▲2015年到2022年FDA下屬CDER批準(zhǔn)的新藥中,“first-in-class”(FIC)的新藥數(shù)目與占比���,點(diǎn)擊圖片可觀看大圖(數(shù)據(jù)來(lái)源:公開(kāi)資料整理����,數(shù)據(jù)來(lái)自CDER發(fā)布的年度報(bào)告)
CDER報(bào)告中著重介紹的“first-in-class”新藥包括:
Camzyos(mavacamten)是一款心肌肌球蛋白別構(gòu)抑制劑���,用于改善特定梗阻性肥厚型心肌?���。╫HCM)成人患者�。這是FDA批準(zhǔn)的首款心肌肌球蛋白別構(gòu)可逆性抑制劑。
Mounjaro(tirzepatide) 同時(shí)激活兩種激素受體�,可提供更好的血糖控制。它在去年5月獲得FDA批準(zhǔn)����,用于與控制飲食和鍛煉聯(lián)用,改善成人2型糖尿病患者的血糖控制���。
Pluvicto(lutetium 177 Lu vipivotide tetraxetan)是首款用于治療前列腺特異性膜抗原(PSMA)陽(yáng)性轉(zhuǎn)移性去勢(shì)抵抗性前列腺癌(mCRPC)患者的靶向放射配體療法���,它將同位素療法與靶向化合物結(jié)合在一起����。
Sunlenca(lenacapavir)是一款具有多階段作用機(jī)制的“first-in-class”衣殼抑制劑���。它在去年12月獲批用于聯(lián)合其他抗逆轉(zhuǎn)錄病毒藥物治療多重耐藥人類免疫缺陷病毒(HIV)感染的成人患者���。Sunlenca是首個(gè)基于衣殼抑制劑的HIV治療選項(xiàng)���,此“first-in-class”藥物向HIV患者提供了一種新的���、一年兩次的治療選擇。
Tzield(teplizumab)是首款能延緩1型糖尿病發(fā)作的藥物����。它是一種抗CD3的單克隆抗體,它有望通過(guò)結(jié)合特定的免疫細(xì)胞����,使其不再攻擊生產(chǎn)胰島素的細(xì)胞。
Voquezna Triple Pak(伏諾拉生����,阿莫西林����,克拉霉素三重組合)和Voquezna Dual Pak(伏諾拉生�,阿莫西林雙重組合)在去年5月獲批上市,用于治療成人幽門(mén)螺桿菌(Helicobacter pylori)感染�。這兩種組合均包含伏諾拉生,這是一款“first-in-class”鉀離子競(jìng)爭(zhēng)性酸阻滯劑�,是美國(guó)30多年來(lái)批準(zhǔn)的首款源于新藥物類型的創(chuàng)新抑酸療法。
FDA用多種方式促進(jìn)和加快新藥審評(píng)
在2022年獲批的37款新藥中�,12款獲得快速通道資格,13款獲得突破性療法認(rèn)定���,21款獲得優(yōu)先審評(píng)資格(不包括使用優(yōu)先審評(píng)券遞交監(jiān)管申請(qǐng)的藥物)�,6款藥物獲得加速批準(zhǔn)�。總計(jì)24款藥物使用了一種或多種加快審評(píng)過(guò)程的資格認(rèn)定�。
突破性療法的數(shù)量同樣是衡量創(chuàng)新性的一個(gè)標(biāo)準(zhǔn)。與已有療法相比���,這些療法在治療特定的嚴(yán)重疾病時(shí)�,可能表現(xiàn)出更好的臨床效益����。
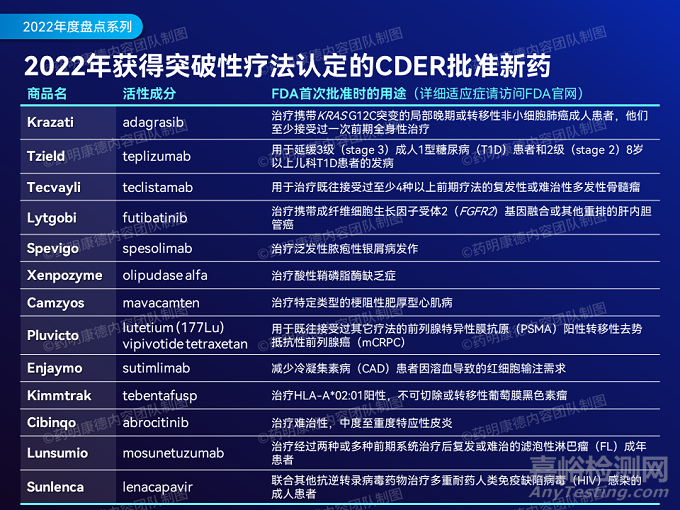
▲2022年CDER批準(zhǔn)的獲得突破性療法認(rèn)定的新藥����,點(diǎn)擊圖片可觀看大圖(數(shù)據(jù)來(lái)源:公開(kāi)資料����,藥明康德內(nèi)容團(tuán)隊(duì)制圖)
多項(xiàng)批準(zhǔn)為特定患者群體帶來(lái)首款獲批療法
在報(bào)告中,CDER還著重介紹了多款值得關(guān)注的擴(kuò)展適應(yīng)癥批準(zhǔn)���。其中多項(xiàng)批準(zhǔn)為特定患者群體帶來(lái)首款FDA獲批療法���。它們包括:
Dupixent(dupilumab)在2022年成為首款獲得FDA批準(zhǔn)����,治療嗜酸性食管炎的療法,同年也成為首款FDA批準(zhǔn)的治療結(jié)節(jié)性癢疹的藥物���。
Enhertu(trastuzumab deruxtecan)在2022年獲得加速批準(zhǔn)����,成為首款治療HER2低表達(dá)乳腺癌亞型患者的療法�。這是一個(gè)新的HER2陰性乳腺癌患者亞群,患者雖然在癌細(xì)胞表面表達(dá)HER2蛋白����,但不足以被歸類為HER2陽(yáng)性����。
Imcivree(setmelanotide)在2022年成為首個(gè)幫助Bardet-Biedl綜合征患者控制體重的FDA獲批療法���。
Olumiant(baricitinib)在2022年成為首款獲批治療COVID-19的免疫抑制劑����,同時(shí)也是首款FDA批準(zhǔn)治療斑禿的系統(tǒng)性療法�。
Opdivo(nivolumab)在2022年成為首款CDER批準(zhǔn)的肺癌新輔助療法。
外用JAK抑制劑Opzelura(ruxolitinib)是首款獲得CDER批準(zhǔn)幫助非節(jié)段性白癜風(fēng)患者恢復(fù)皮膚色素的療法����。
Pedmark(sodium thiosulfate)是首款獲批用于在接受順鉑化療的兒科患者中降低聽(tīng)力喪失風(fēng)險(xiǎn)的療法。
Vidaza(azacitidine)在2022年獲得CDER批準(zhǔn)治療年齡一個(gè)月以上的新確診幼年粒單核細(xì)胞白血病患者����。這是針對(duì)這種白血病類型的首個(gè)獲批療法。
Vijoice(alpelisib)在2022年獲批治療PIK3CA相關(guān)過(guò)度生長(zhǎng)疾病譜系(PROS)(PROS)�,這是一種主要影響兒童的罕見(jiàn)過(guò)度生長(zhǎng)綜合征。這是針對(duì)這一適應(yīng)癥的首款獲批療法�。
Xalkori(crizotinib)獲批治療無(wú)法切除、復(fù)發(fā)或難治性炎性ALK陽(yáng)性肌纖維母細(xì)胞瘤(IMT)患者�。這是用于治療IMT的首款獲批藥物���。
附:2021年FDA批準(zhǔn)的新藥列表,點(diǎn)擊圖片可觀看大圖