原輔料相容性試驗(yàn)是研究非活性成分在產(chǎn)品質(zhì)量中的作用的一個(gè)重要組成部分���。 對(duì)用于相容性研究的輔料的選擇��,應(yīng)該基于對(duì)原料藥及其雜質(zhì)��、輔料及其雜質(zhì)��、降解途徑和藥品生產(chǎn)可能采用的工藝條件的系統(tǒng)理解[1]���。
原輔料相容性實(shí)驗(yàn)設(shè)計(jì)的目的是判斷原料藥和輔料之間是否會(huì)發(fā)生化學(xué)反應(yīng),試驗(yàn)設(shè)計(jì)要緊緊圍繞這點(diǎn)�����。原輔料相容性實(shí)驗(yàn)設(shè)計(jì)并無固定標(biāo)準(zhǔn)�����,目前常用的指導(dǎo)原則有4種。
1��、QbD指導(dǎo)原則[1]
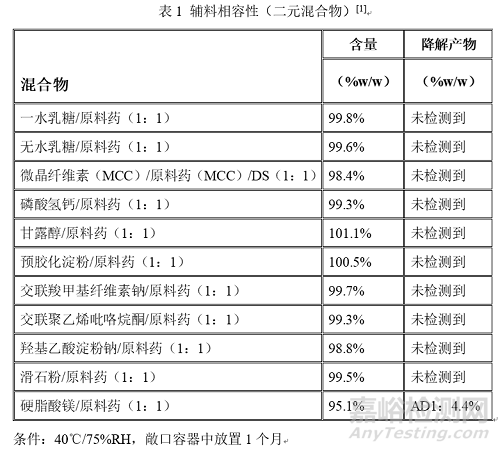
QbD指導(dǎo)原則中原料藥與輔料的比例均為1:1��,混合形成二元混合物�����,在25℃/60%RH和40℃/75%RH條件下��,分別在敞口和密閉容器中放置一個(gè)月���。
2���、《化學(xué)藥物制劑研究基本技術(shù)指導(dǎo)原則》[2]
化學(xué)藥物制劑研究基本技術(shù)指導(dǎo)原則確定了原料藥與輔料的比例:輔料用量較大的(如稀釋劑等),可按原料藥:輔料=1:5的比例混合��,若用量較小的(如潤滑劑等)��,可按原料藥:輔料=20:1的比例混合���,但何為用量較大��,用量較小�����,并無明確的比例規(guī)定�����,相容性研究具體內(nèi)容如下:
本相容性研究指藥物與輔料間及藥物與藥物間相互作用研究��。前者將在下面輔料部分進(jìn)行闡述�����。后者主要是復(fù)方制劑研究中需要考慮的問題�����,實(shí)驗(yàn)可參照藥物穩(wěn)定性指導(dǎo)原則中影響因素的實(shí)驗(yàn)方法進(jìn)行���。
藥物與輔料相容性研究為處方中輔料的選擇提供了有益的信息和參考。藥品申請(qǐng)人可以通過前期調(diào)研���,了解輔料與輔料間�����、輔料與藥物間相互作用情況���,以避免處方設(shè)計(jì)時(shí)選擇不宜的輔料�����。對(duì)于缺乏相關(guān)研究數(shù)據(jù)的���,可考慮進(jìn)行相容性研究。例如口服固體制劑�����,可選若干種輔料��,若輔料用量較大的 (如稀釋劑等) ���,可按主藥: 輔料=1: 5的比例混合�����,若用量較小的 (如潤滑劑等) ��,可按主藥: 輔料=20: 1的比例混合��,取一定量參照藥物穩(wěn)定性指導(dǎo)原則中影響因素的實(shí)驗(yàn)方法或其他適宜的實(shí)驗(yàn)方法重點(diǎn)考察性狀���、含量���、有關(guān)物質(zhì)等等,必要時(shí)���,可用原料藥和輔料分別做平行對(duì)照實(shí)驗(yàn)��,以判別是原料藥本身的變化還是輔料的影響。
如處方中使用了與藥物有相互作用的輔料�����,需要用實(shí)驗(yàn)數(shù)據(jù)證明處方的合理性��。
3 原輔料相容性試驗(yàn)標(biāo)準(zhǔn)操作規(guī)程[3]
3.1原輔料相容性試驗(yàn)-針對(duì)國內(nèi)申報(bào)項(xiàng)目
若輔料用量較大的(如稀釋劑等)�����,可按主藥:輔料=1:5 的比例混合���,若用量較小的如潤滑劑等)��,可按主藥:輔料=20:1 的比例混合或根據(jù)實(shí)際情況設(shè)定混合比例��,取一定量���,參照藥物穩(wěn)定性指導(dǎo)原則中影響因素的實(shí)驗(yàn)方法或其他適宜的實(shí)驗(yàn)方法��,重點(diǎn)考察性狀���、含量、有關(guān)物質(zhì)等等��,必要時(shí)��,可用原料藥和輔料分別做平行對(duì)照實(shí)驗(yàn)�����,以判別是原料藥本身的變化還是輔料的影響��。
影響因素試驗(yàn)一般包括高溫���、高濕�����、光照試驗(yàn)��。一般將原料藥供試品置適宜的容器中(如稱量瓶或培養(yǎng)皿��,攤成≤5mm 的薄層��,疏松原料藥攤成≤10mm厚的薄層進(jìn)行試驗(yàn)���。
高溫試驗(yàn)
供試品置密封潔凈容器中��,在 60C條件下放置 10 天��,于第 5 天和第 10天取樣��,檢測有關(guān)指標(biāo)。如供試品發(fā)生顯著變化��,則在 40C下同法進(jìn)行試驗(yàn)�����。如60C無顯薯變化��,則不必進(jìn)行 40C試驗(yàn)��。
高濕試驗(yàn)
供試品置恒濕密閉容器中,于 25C��、RH90%5%條件下放置 10 天��,在第5 天和第 10 天取樣檢測���。檢測項(xiàng)目應(yīng)包括吸濕增重項(xiàng)��。若吸濕增重 5%以上�����,則應(yīng)在 25C��、RH 755%下同法進(jìn)行試驗(yàn)�����;若吸濕增重 5%以下�����,且其他考察項(xiàng)目符合要求��,則不再進(jìn)行此項(xiàng)試驗(yàn)�����。液體制劑可不進(jìn)行此項(xiàng)試驗(yàn)�����。恒濕條件可采用恒溫恒濕箱或通過在密閉容器下部放置飽和鹽溶液來實(shí)現(xiàn)���。根據(jù)不同的濕度要求��,選擇NaCl飽和溶液(15.5- 60C�����,RH 75%14%)或 KNO3 飽和溶液(25CRH 92.5%)���。
光照試驗(yàn)
供試品置光照箱或其它適宜的光照容器內(nèi)���,于照度 4500Lx士500Lx 條件下放置 10 天�����,在第 5天和第 10 天取樣檢測���。
以上為影響因素穩(wěn)定性研究的一般要求�����。根據(jù)藥品的性質(zhì)必要時(shí)可以設(shè)計(jì)其他試驗(yàn)���,如考察 pH 值、氧���、低溫�����、凍融等因素對(duì)藥品穩(wěn)定性的影響��。
3.2原輔料相容性試驗(yàn)-針對(duì)國外申報(bào)項(xiàng)目
選擇輔料:>2 個(gè)輔料每一類功能性輔料(例如:填充劑��、粘合劑�����、崩解劑���、潤滑劑���、潤濕劑、助流劑�����、包衣材料):
API 和輔料的配比:接近處方中的常用配比
API 1:10
API:粘合劑或崩解劑:1:1
API:潤滑劑或助流劑:10:1
容器/封裝:管/密封��, 500 mg 粉末/管
貯存條件:加速 40C/75% H 開口���,50C/75% RH/密閉
取樣時(shí)間:0天,2 周,4 周
樣品分析:物理外觀�����,含量和雜質(zhì)《含量和雜質(zhì)必須來自同一樣品)其他注意事項(xiàng):
1:在各種實(shí)驗(yàn)條件下需設(shè)計(jì) API 的參比并檢驗(yàn)
2:可以準(zhǔn)備第二份樣品粉末混合物加 5%的水���,雙工作負(fù)荷
3:硬脂酸和磷酸氛鈣在 40"C
4 ICH[4]
原輔料相容性研究在ICH 藥品研發(fā)Q8(R2)2.1.2 Excipients部分中也有明確要求(第3頁),具體內(nèi)容如下:
輔料
申報(bào)者應(yīng)針對(duì)各種輔料的作用��,詳述其選擇過程���,配比以及可能影響的藥物制劑性能(如穩(wěn)定性、生物利用度)或可生產(chǎn)性。處方中應(yīng)包括藥物制劑生產(chǎn)中所用到的所有物質(zhì)�����,不論其是否出現(xiàn)在成品中(如:工藝輔助劑)��。必要時(shí)��,應(yīng)建立輔料之間的相容性(比如雙重防腐系統(tǒng)中防腐劑的組合)���。同時(shí)�����,應(yīng)闡述輔料(如抗氧劑��、滲透促進(jìn)劑���、崩解劑、控釋劑)是否能實(shí)現(xiàn)預(yù)期的作用�����,是否能在預(yù)期的有效期內(nèi)發(fā)揮作用���?����?赡艿那闆r下�����,可以利用有關(guān)輔料性能的資料���,來論證輔料的選擇和質(zhì)量屬性�����,并支持證明藥物制劑質(zhì)量標(biāo)準(zhǔn)的合理性(3.2.P.5.6)�����。
有關(guān)輔料安全性方面的資料�����,可以被交叉引用(3.2.P.4.6)�����。
綜上所述�����,目前尚無統(tǒng)一的原輔料相容性試驗(yàn)設(shè)計(jì)指南���,因此在設(shè)計(jì)原輔料相容性試驗(yàn)時(shí)應(yīng)充分考慮原料藥、輔料的理化性質(zhì)�����。
5.實(shí)驗(yàn)考慮
5.1輔料種類與比例
仿制藥開發(fā)過程中���,原研品輔料種類基本都能查詢到�����,按照原研品輔料種類做實(shí)驗(yàn)即可�����。但是輔料用量大多不能查到�����,當(dāng)不確定輔料用量時(shí)�����,實(shí)驗(yàn)設(shè)計(jì)可根據(jù)原料藥占比來確定原料藥和輔料的比例��。例如�����,原料藥占20%��,輔料最多是80%���,原料藥:輔料=1:8�����;原料藥占50%���,輔料最多是50%,原料藥:輔料=1:1��;也可參考以上四種指導(dǎo)原則。
5.2實(shí)驗(yàn)條件
原輔料相容性實(shí)驗(yàn)條件設(shè)計(jì)可參考以上四種指導(dǎo)原則或2020版中國藥典9001《原料藥物與制劑穩(wěn)定性試驗(yàn)指導(dǎo)原則》�����。雖然實(shí)驗(yàn)條件多是在高溫��、高濕和強(qiáng)光條件下���,但具體藥物具體分析,并不需要三種條件都做�����。例如�����,在已知原料藥光不穩(wěn)定的基礎(chǔ)上���,要取消強(qiáng)光條件���,并對(duì)樣品避光處理。主輔料相容性實(shí)驗(yàn)設(shè)計(jì)的目的是判斷原料藥和輔料是否會(huì)發(fā)生化學(xué)反應(yīng)�����,高溫、高濕和強(qiáng)光條件僅是來加速化學(xué)反應(yīng)發(fā)生的速度��。
5.3實(shí)驗(yàn)指標(biāo)
原輔料相容性的實(shí)驗(yàn)指標(biāo)一般包括:物理外觀��、含量���、有關(guān)雜質(zhì)���、水分等。除此之外��,根據(jù)原料藥的性質(zhì)必要時(shí)可以設(shè)計(jì)其他試驗(yàn)���,比如考察pH值��、晶型���、熔點(diǎn)等。在一般原輔料相容性試驗(yàn)中���,物理外觀��、含量���、有關(guān)雜質(zhì)�����、水分均需測定�����。樣品含量的測定存在一定爭議�����。有些人認(rèn)為樣品吸濕會(huì)導(dǎo)致含量下降,從而影響結(jié)果的判斷���;有些人認(rèn)為含量是樣品的重要控制指標(biāo)���,在分析驗(yàn)證方法無法對(duì)所有潛在雜質(zhì)監(jiān)控時(shí),含量是重要佐證��。筆者認(rèn)為��,吸濕問題可通過控制室內(nèi)濕度和單獨(dú)稱樣來避免,含量需要測定�����。
5.4實(shí)驗(yàn)結(jié)果
由于原輔料相容性實(shí)驗(yàn)樣品眾多�����,也常常出現(xiàn)異常數(shù)據(jù)���。例如數(shù)據(jù)忽上忽下�����,造成這種數(shù)據(jù)的主要原因是樣品沒有混勻���,所以不同取樣時(shí)間的數(shù)據(jù)呈鋸齒狀。故原輔料相容性試驗(yàn)數(shù)據(jù)看趨勢變化���。同時(shí)��,實(shí)驗(yàn)數(shù)據(jù)呈現(xiàn)趨勢性下降�����,首先要排除原料藥的影響�����,若原料藥在劇烈條件下也發(fā)生降解��,則不是原料藥和輔料的問題�����。再排除原料藥影響的基礎(chǔ)上���,含量下降多少�����,有關(guān)物質(zhì)增加多少可以認(rèn)定兩者不相容呢,這并沒有固定的標(biāo)準(zhǔn)��。一般有關(guān)物質(zhì)增加3%�����,含量下降3%以上��,就可以說明原料藥和輔料不相容。
6總結(jié)
原輔料相容性實(shí)驗(yàn)的原輔料配比�����、實(shí)驗(yàn)條件并不能完全模擬制劑產(chǎn)品的生產(chǎn)過程��,故實(shí)驗(yàn)數(shù)據(jù)顯示原料藥和輔料存在不相容問題���,但并不影響產(chǎn)品開發(fā)繼續(xù)使用該輔料��。例如�����,硬脂酸鎂與原料藥發(fā)生反應(yīng)生成新的化合物���,在已知原料藥和除硬脂酸鎂以外的所有輔料并無相互作用的基礎(chǔ)上,制劑研究者采用硬脂酸鎂外加來減少和原料藥的接觸���,所得樣品雜質(zhì)低于未知雜質(zhì)的限量�����,穩(wěn)定性良好�����。
注意:原輔料相容性實(shí)驗(yàn)結(jié)果提示原料藥和輔料不相容并不代表該輔料一定不能用��。實(shí)驗(yàn)結(jié)果僅是為制劑研究者提示某些輔料和原料藥存在相容性風(fēng)險(xiǎn)�����,至于輔料能不能用需要綜合考慮��。
[1] “質(zhì)量源于設(shè)計(jì)” 理念應(yīng)用于仿制藥申報(bào)(ANDA)速釋制劑示例���。
[2] 化學(xué)藥物制劑研究基本技術(shù)指導(dǎo)原則��。
[3] 原輔料相容性實(shí)驗(yàn)的標(biāo)準(zhǔn)操作規(guī)程�����。
[4] 藥物原輔料相容性研究要求�����、不相容情形及篩選試驗(yàn)。