今日頭條
海思科長效DPP-4抑制劑報(bào)產(chǎn)�����。海思科二肽基肽酶-4(DPP-4)超長效抑制劑HSK7653片的上市申請獲CDE受理�����,擬用于2型糖尿病治療���。2022年8月��,海思科宣布HSK7653已完成兩項(xiàng)III期臨床試驗(yàn)���。兩項(xiàng)試驗(yàn)共入組超過900例2型糖尿病患者�,試驗(yàn)結(jié)果均達(dá)到預(yù)設(shè)終點(diǎn)��。如果獲批����,該新藥有望成為全球首個(gè)降糖藥雙周制劑,為患者提供一個(gè)更優(yōu)的治療選擇���。
國內(nèi)藥訊
1.輝大眼科基因療法獲FDA臨床批件�。輝大(上海)生物宣布其首個(gè)基因治療產(chǎn)品HG004已獲得FDA臨床許可����,即將開展國際多隊(duì)列、劑量探索性研究�,評(píng)估單次注射用于RPE65基因突變引起的相關(guān)性視網(wǎng)膜病變成人及兒童患者的安全性、耐受性和初步有效性����。在臨床前Rpe65基因敲除小鼠模型中,單次注射后第17周�����,HG004與AAV2產(chǎn)品相比,小鼠視網(wǎng)膜功能恢復(fù)分別提高67.6%和35.8%�����。
2.傳奇生物BCMA CAR-T國際III期臨床積極���。傳奇生物靶向BCMA的CAR-T療法Carvykti(西達(dá)基奧侖賽���,Cilta-cel)用于既往接受過1-3線治療(包括蛋白酶體抑制劑和免疫調(diào)節(jié)藥物)且來那度胺耐藥的多發(fā)性骨髓瘤患者的III期臨床CARTITUDE-4(NCT04181827)達(dá)到主要終點(diǎn)��。與泊馬度胺�����、硼替佐米和地塞米松(PVd)或達(dá)雷妥尤單抗(CD38單抗)����、泊馬度胺和地塞米松(DPd)相比,Cilta-cel顯著改善患者的無進(jìn)展生存期(PFS)�����。詳細(xì)結(jié)果將于醫(yī)學(xué)會(huì)議上公布。
3.晨泰可入腦EGFR抑制劑報(bào)產(chǎn)�。晨泰醫(yī)藥與阿斯利康合作開發(fā)的EGFR抑制劑佐利替尼(zorifertinib/AZD3759)的上市申請獲CDE受理,用于治療晚期非小細(xì)胞肺癌伴中樞神經(jīng)系統(tǒng)轉(zhuǎn)移患者�。zorifertinib是一款新一代EGFR-TKI藥物,具有高達(dá)100%的血腦屏障透過率�。此前,晨泰醫(yī)藥宣布佐利替尼的II/III期EVEREST研究完成最后1例受試者的末次訪視�,將基于該研究結(jié)果提交上市申請。該研究的主要研究者為吳一龍教授���。
4.科州MEK抑制劑擬納入優(yōu)先審評(píng)�。科州制藥1類新藥MEK抑制劑妥拉美替尼(HL-085)獲CDE擬納入優(yōu)先審評(píng)�����,用于治療既往接受過免疫治療的攜帶NRAS突變的晚期黑色素瘤患者�。公布于ASCO 2020會(huì)議上的I/II期臨床結(jié)果顯示,HL-085在可評(píng)估患者中的最佳客觀緩解率(ORR)為33.3%���,疾病控制率為83.3%����,中位無進(jìn)展生存期為17.4周��。
5.歌禮RdRp抑制劑國內(nèi)獲批猴痘臨床。歌禮口服病毒聚合酶抑制劑ASC10獲國家藥監(jiān)局臨床默示許可����,擬針對(duì)猴痘適應(yīng)癥開展臨床研究。臨床前研究顯示�����,ASC10-A具有廣譜抗病毒活性�����,對(duì)包括猴痘病毒等在內(nèi)多種病毒均具有強(qiáng)效抗病毒活性�����。在美國����,F(xiàn)DA已批準(zhǔn)該藥物在美國開展用于猴痘適應(yīng)癥的Ⅰb期臨床試驗(yàn)���。
6.固安鼎泰三靶點(diǎn)DNA腫瘤疫苗獲批臨床��。固安鼎泰海規(guī)生物1類生物制品NMM腫瘤治療性DNA疫苗裸質(zhì)粒注射液獲國家藥監(jiān)局臨床默示許可���,擬用于晚期實(shí)體瘤和復(fù)發(fā)�、難治性淋巴瘤的治療�。去年4月,該公司獲得一項(xiàng)名為《 一種抗腫瘤重組NMM融合抗原質(zhì)粒DNA疫苗》的專利授權(quán)(CN109081873B)����;該項(xiàng)發(fā)明設(shè)計(jì)和構(gòu)建一種融合有3個(gè)腫瘤抗原靶點(diǎn)(NY-ESO-1, MUC1,MAGE-A3)的重組質(zhì)粒DNA(pNMM)疫苗。
國際藥訊
1.禮來非共價(jià)BTK抑制劑獲FDA加速批準(zhǔn)���。禮來旗下Loxo Oncology公司非共價(jià)BTK抑制劑Jaypirca(pirtobrutinib)獲FDA加速批準(zhǔn)��,用于治療BTK抑制劑經(jīng)治����、復(fù)發(fā)/難治性套細(xì)胞淋巴瘤(MCL)患者����。在Ⅰ/Ⅱ期BRUIN臨床中,pirtobrutinib在這類難治性患者中達(dá)到50%(95% CI:41-59)的緩解率����,分別有13%與38%的患者達(dá)成完全與部分緩解。患者的中位DOR為8.3個(gè)月(95% CI:5.7-尚無法評(píng)估)��。Jaypirca是首個(gè)針對(duì)BTK抗性癌癥的BTK抑制劑�����。
2.FDA批準(zhǔn)K藥輔助治療NSCLC����。默沙東PD-1單抗帕博利珠單抗(Keytruda)獲FDA 批準(zhǔn)新適應(yīng)癥,用于IB期(T2a≥4cm)���、II或IIIA期非小細(xì)胞肺癌 (NSCLC)患者切除和鉑類化療后的輔助治療��。在關(guān)鍵Ⅲ期臨床KEYNOTE-091中�����,與安慰劑相比�����,無論腫瘤PD-L1的表達(dá)量如何,Keytruda均可增加患者的無病生存期(DFS)�。對(duì)于接受輔助化療的患者,Keytruda組的中位DFS為58.7個(gè)月,安慰劑組為34.9個(gè)月(風(fēng)險(xiǎn)比=0.73�����;95%CI:0.60-0.89)�����。
3.KIT/PDGFRα抑制劑獲FDA優(yōu)先審評(píng)資格�。FDA受理Blueprint公司口服KIT/PDGFRα抑制劑Ayvakit(avapritinib)的補(bǔ)充新藥申請并授予其優(yōu)先審評(píng)資格,用于治療惰性系統(tǒng)性肥大細(xì)胞增多癥成人患者����。預(yù)計(jì)今年5月22日之前公布審評(píng)結(jié)果。在注冊PIONEER臨床(NCT03731260)中�����,與對(duì)照組相比�����,Ayvakit治療組24周時(shí)患者的平均TSS改變具有統(tǒng)計(jì)學(xué)顯著改善(下降15.6分vs下降9.2分���,p=0.003)�。基石擁有該新藥的大中華區(qū)權(quán)益��。
4.BMS靶向CD19自體CAR-T早期臨床積極����。百時(shí)美施貴寶靶向CD19的CAR-T療法Breyanzi(lisocabtagene maraleucel)治療復(fù)發(fā)/難治性(R/R)慢性淋巴細(xì)胞白血病(CLL)/小淋巴細(xì)胞淋巴瘤(SLL)的Ⅰ/Ⅱ期臨床達(dá)到主要終點(diǎn)。與歷史對(duì)照組相比���,Breyanzi顯著改善患者的完全緩解率���。2021年2月,F(xiàn)DA已批準(zhǔn)該新藥用于治療接受過兩種或以上系統(tǒng)治療的復(fù)發(fā)/難治性大B細(xì)胞淋巴瘤(LBCL)成人患者�����。
5.Aβ蛋白疫苗早期臨床積極�����。AC Immune公司抗Aβ疫苗ACI-24.060用于治療前驅(qū)期(prodromal)阿爾茨海默病患者的Ⅰ/Ⅱ期臨床結(jié)果積極�。ACI-24.060旨在激發(fā)針對(duì)Aβ寡聚體和焦谷氨酸Aβ的多克隆抗體反應(yīng),抑制淀粉樣蛋白斑塊形成�����。中期結(jié)果顯示�����,二劑低劑量ACI-24.060兩周后就激發(fā)抗Aβ抗體反應(yīng)���,疫苗總體耐受性良好����。目前����,接種高劑量的AD患者隊(duì)列已啟動(dòng),試驗(yàn)將擴(kuò)展至包括唐氏綜合癥患者�����。
6.強(qiáng)生撤回伊布替尼治療MSL的NDA�。強(qiáng)生日前在歐盟撤回BTK抑制劑伊布替尼(Imbruvica)聯(lián)合苯達(dá)莫司汀與利妥昔單抗一線治療套細(xì)胞淋巴瘤(MCL)患者的新適應(yīng)癥上市申請。原因是人用藥品委員會(huì)認(rèn)為Imbruvica的研究數(shù)據(jù)不足以支持該適應(yīng)癥中的應(yīng)用�����。在III期SHINE研究中�,中位隨訪84.7個(gè)月時(shí)�����,伊布替尼組的中位無進(jìn)展生存期為80.6個(gè)月�����,安慰劑組為52.9個(gè)月(HR=0.75��;95%Cl:0.59-0.96�����;P=0.01)�����。
醫(yī)藥熱點(diǎn)
1.全國整體疫情已進(jìn)入低流行水平����。1月30日����,國務(wù)院聯(lián)防聯(lián)控機(jī)制舉行新聞發(fā)布會(huì)。國家衛(wèi)健委新聞發(fā)言人米鋒介紹:春節(jié)期間�,國務(wù)院聯(lián)防聯(lián)控機(jī)制相關(guān)部門持續(xù)做好服務(wù)保障���,廣大醫(yī)務(wù)人員和各行業(yè)工作者堅(jiān)守崗位,防控工作平穩(wěn)有序��,“乙類乙管”措施落地見效��。目前全國整體疫情已進(jìn)入低流行水平����,各地疫情保持穩(wěn)步下降態(tài)勢�。
2.98%以上縣市達(dá)到麻風(fēng)消除目標(biāo)。1月29日是第70屆“世界防治麻風(fēng)病日”暨第36屆“中國麻風(fēng)節(jié)”���。今年世界防治麻風(fēng)病日活動(dòng)的主題為“弘揚(yáng)時(shí)代精神���,消除麻風(fēng)危害”。國家疾控局當(dāng)日發(fā)布消息稱���,我國消除麻風(fēng)危害目前進(jìn)入新階段�,全國98%以上的縣(市)達(dá)到消除目標(biāo)��。
3.WHO更新應(yīng)對(duì)輻射和核緊急情況藥物清單�。1月27日���,世界衛(wèi)生組織在其官網(wǎng)更新了應(yīng)對(duì)輻射和核緊急情況建議儲(chǔ)備的藥物清單。根據(jù)清單�����,典型的輻射應(yīng)急儲(chǔ)備包括以下藥物:穩(wěn)定碘(用于阻止或減少甲狀腺對(duì)放射性碘的吸收)���、普魯士藍(lán)(去除人體內(nèi)部的放射性物質(zhì)銫和鉈)���、螯合劑(對(duì)一些金屬及放射性元素有促排作用)、含鋁抗酸劑和藻酸鹽(增加放射性鍶的排出)�����、碳酸氫鈉�、生長因子、昂丹司瓊��、洛派丁胺等和其他用于治療嘔吐�����、腹瀉和感染的藥物����。
評(píng)審動(dòng)態(tài)
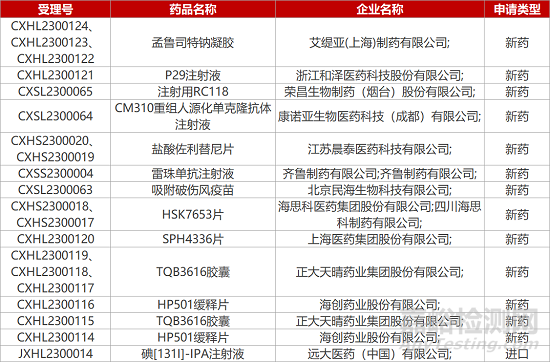
1. CDE新藥受理情況(01月31日)
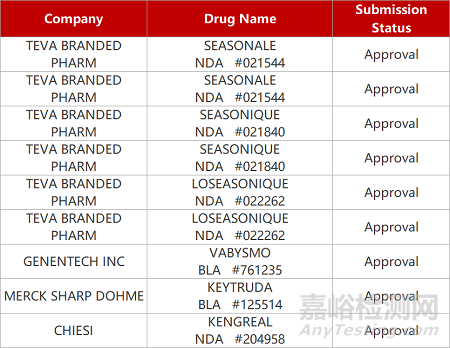
2. FDA新藥獲批情況(北美01月27日)