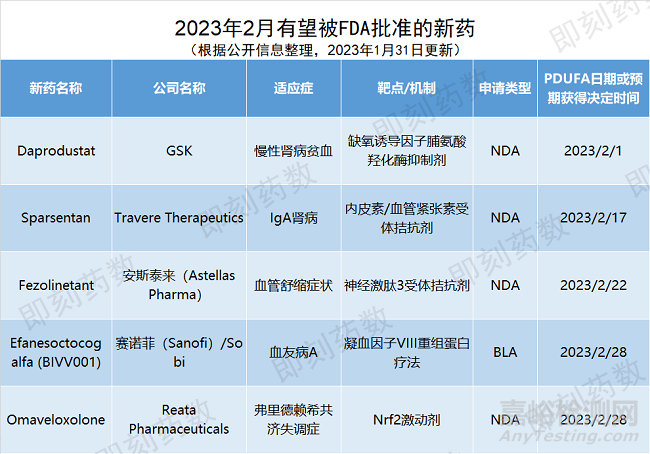
根據(jù)PDUFA的預期目標日期�����,預計2月�����,美國FDA將對5個創(chuàng)新藥物的批準做出監(jiān)管決定�����。
▲2月有望在美國獲批的新藥
藥物名稱:Daprodustat
公司名稱:GSK
適應癥:慢性腎?�。–KD)貧血
GSK開發(fā)的daprodustat是一款口服缺氧誘導因子脯氨酰羥化酶抑制劑(HIF-PHI)。它通過抑制氧敏感脯氨酰羥化酶����,以穩(wěn)定缺氧誘導因子。全球有超過7億慢性腎?���。–KD)患者����,估計其中1/7的患者患有貧血��。慢性腎病貧血為CKD腎功能失代償期主要并發(fā)癥之一����。隨著CKD的進展�����,CKD貧血的患病率和嚴重程度逐漸增加。腎性貧血患者較常規(guī)貧血難以糾正�����,患者乏力嚴重。CKD貧血與不良臨床結(jié)局相關,并對患者和醫(yī)療保健系統(tǒng)造成沉重負擔。
FDA于2022年4月受理了該藥物的新藥申請(NDA)��,PDUFA日期設定為2023年2月1日����。這一NDA申請獲得名為ASCEND項目結(jié)果支持����。ASCEND項目包含5項3期臨床試驗�����,其中兩項關鍵的心血管結(jié)果試驗ASCEND-ND和ASCEND-D的結(jié)果發(fā)表在《新英格蘭醫(yī)學雜志》上�����,這兩項針對非透析患者(ASCEND-ND)和透析患者(ASCEND-D)開展的試驗均達到主要療效和安全性終點����,daprodustat改善和/或維持血紅蛋白(Hb)在目標水平(10-11.5 g/dL)內(nèi)。
藥物名稱:Sparsentan
公司名稱:Travere Therapeutics
適應癥:IgA腎病
Sparsentan是一種具有雙重機制的內(nèi)皮素/血管緊張素受體拮抗劑(DEARA)��,通過阻斷內(nèi)皮素A和血管緊張素Ⅱ的1型通路�����,可減少蛋白尿��,保護細胞并防止腎小球硬化和系膜細胞增殖�����。Sparsentan最初由百時美施貴寶(BMS)研發(fā)����,后授權(quán)給Pharmacopeia(該公司于2008年被Ligand公司收購)�����,后又授權(quán)給Retrophin公司(即現(xiàn)在的Travere Therapeutics公司)開發(fā)�����。
IgA腎?����。↖gAN)是一種罕見的腎臟疾病�����,其特征是免疫球蛋白A(IgA)在腎臟中蓄積�����,IgA的沉積引起腎臟正常濾過機制的破壞��,導致血尿和蛋白尿��。IgA腎病的其他癥狀可能包括腎痛��、水腫和高血壓��。IgA腎病也是終末期腎?�。‥SKD)和急性腎炎的主要原因之一�����。目前尚無非免疫抑制的療法獲批治療IgA腎病��。
FDA于2022年5月接受了sparsentan的NDA申請并授予其優(yōu)先審評資格��,PDUFA日期后來重新設定為2023年2月17日��。這一NDA申請是基于3期臨床試驗的積極研究結(jié)果����。試驗結(jié)果顯示,sparsentan達到了預定的中期分析主要療效終點��。在治療36周后�����,sparsentan組(n=280)蛋白尿較基線平均減少49.8%��,活性對照組平均減少15.1%(p<0.0001)�����。
藥物名稱:Fezolinetant
公司名稱:安斯泰來(Astellas Pharma)
適應癥:中重度停經(jīng)血管舒縮癥狀(VMS)
Fezolinetant是一種在研口服�����、選擇性神經(jīng)激肽3(NK3)受體拮抗劑��,可阻斷神經(jīng)激肽B(NKB)的信號通路����,調(diào)控下視丘溫度調(diào)節(jié)中心的神經(jīng)活動����,進而降低中重度停經(jīng)血管舒縮癥狀的頻率與嚴重程度。血管舒縮癥狀以潮熱�����、夜間盜汗為人所知����,是典型婦女停經(jīng)后癥狀����。對于患有中重度停經(jīng)血管舒縮癥狀的婦女,癥狀可以持續(xù)平均長達7-10年�����。然而目前為止�����,主要療法為內(nèi)分泌療法,患者具有非常有限的非內(nèi)分泌類療法選擇��。
FDA于2022年8月受理了該藥物的NDA申請�����,PDUFA日期設定為2023年2月22日��。這一NDA申請是基于名為BRIGHT SKY項目結(jié)果所支持����。BRIGHT SKY項目包含三項3期臨床試驗����。SKYLIGHT 1與SKYLIGHT 2試驗為雙盲�����、安慰劑為對照組、為期12周����,再加上40周治療延伸期的試驗�����,檢視了fezolinetant在治療中重度停經(jīng)VMS的療效與安全性��。該試驗達到了評估子宮內(nèi)膜健康的主要終點。SKYLIGHT 4試驗則是為期52周的雙盲、安慰劑為對照組試驗�����,進一步檢驗此藥物的長期安全性�����。
藥物名稱:Efanesoctocog alfa
公司名稱:賽諾菲(Sanofi)/Sobi
適應癥:血友病A
賽諾菲(Sanofi)與Sobi公司共同開發(fā)的efanesoctocog alfa是一款創(chuàng)新凝血因子VIII重組蛋白療法�����。該藥品設計用于以一周一次的頻率對血友病A患者進行預防性治療。其將凝血因子VIII(FVIII)��,血管性血友病因子(vWF)部分區(qū)域��、XTEN多肽與新式的Fc融合蛋白結(jié)合成復合體��,延長藥品存在血液循環(huán)內(nèi)的時間��。
血友病A是由于編碼FVIII的基因出現(xiàn)突變��,導致凝血因子VIII缺失的遺傳性疾病�����。血友病患者會有反復出血的情形����,使得其感到疼痛、出現(xiàn)無法復原的關節(jié)損傷以及有危及生命出血的可能�����。目前常見的血友病A治療方法是每周接受3-4次定期輸注FVIII。
FDA于2022年8月接收了該藥物的生物制品許可申請(BLA)并授予優(yōu)先審評資格�����,PDUFA日期設定為2023年2月28日����。這一BLA是基于名為XTEND-1的3期臨床試驗結(jié)果。試驗結(jié)果顯示��,每周一次efanesoctocog alfa預防性治療,顯著降低嚴重血友病A患者中的年出血率����。與此前接受的凝血因子VIII預防性治療相比�����,efanesoctocog alfa在預防出血方面亦表現(xiàn)出優(yōu)效性����。
藥物名稱:Omaveloxolone
公司名稱:Reata Pharmaceuticals
適應癥:弗里德賴希共濟失調(diào)癥(Friedreich’s Ataxia�����,F(xiàn)A)
Reata Pharmaceuticals的omaveloxolone是一種口服的Nrf2激動劑��。Nrf2是一種誘導多個分子通路的轉(zhuǎn)錄因子����,這些分子通路能夠通過恢復線粒體功能、降低氧化應激����、抑制促炎信號而減輕炎癥反應。FA是一種最常見的遺傳性共濟失調(diào)類型��。在全球范圍內(nèi)����,約有2.2萬名FA患者�����。大多數(shù)患者在青少年時期被確診����,在確診后的10到15年內(nèi)�����,便需要輪椅輔助生活,且通常只能活到30歲左右����。目前,尚未有獲批的療法��。
FDA于2022年5月接收了該藥物的NDA申請�����,后將PDUFA日期延長3個月至2023年2月28日��。這一NDA申請基于名為MOXIe的2期臨床試驗結(jié)果����。此前��,F(xiàn)DA曾授予omaveloxolone用于治療弗里德賴希共濟失調(diào)的孤兒藥資格、快速通道資格和罕見兒科疾病認定(RPDD)����。2019年10月,Reata Pharmaceuticals公布MOXIe的第二部分研究����。研究結(jié)果顯示��,48周后����,接受omaveloxolone治療的患者在共濟失調(diào)神經(jīng)系統(tǒng)評定量表(mFARS)得分方面得到顯著的改善,達到了試驗的主要終點��。與安慰劑組相比����,治療組中患者的mFARS得分改善了2.4個點��。
參考資料:
[1] US Food and Drug Administration accepts New Drug Application for daprodustat. Retrieved Jan 31, 2023, from https://www.gsk.com/en-gb/media/press-releases/us-food-and-drug-administration-accepts-new-drug-application-for-daprodustat/
[2] Travere Therapeutics Reports Third Quarter 2022 Financial Results. Retrieved Jan 31, 2023, from https://www.globenewswire.com/news-release/2022/10/27/2543344/0/en/Travere-Therapeutics-Reports-Third-Quarter-2022-Financial-Results.html
[3] U.S. FDA Accepts Astellas’ New Drug Application for Fezolinetant. Retrieved Jan 31, 2023, from https://www.astellas.com/en/news/26126
[4] FDA grants priority review to efanesoctocog alfa for people with hemophilia A. Retrieved Jan 31, 2023, from https://www.news.sanofi.us/press-releases?item=137377
[5] Reata Pharmaceuticals Announces Three Month Extension of the Review Period for New Drug Application for Omaveloxolone for the Treatment of Friedreich’s Ataxia. Retrieved Jan 31, 2023, from https://www.businesswire.com/news/home/20220809005508/en/Reata-Pharmaceuticals-Announces-Three-Month-Extension-of-the-Review-Period-for-New-Drug-Application-for-Omaveloxolone-for-the-Treatment-of-Friedreich%E2%80%99s-Ataxia