FDA器械與輻射健康中心(CDRH)發(fā)布2022年年度報(bào)告�,以突出該中心截至2022年12月31日的成就���,其中包括:應(yīng)對(duì)突發(fā)傳染病大流行���、醫(yī)療器械用戶(hù)費(fèi)用修正案(Medical Device User Fee Amendment MDUFA)、器械創(chuàng)新(DEVICE INNOVATION)�、OTC助聽(tīng)器最終規(guī)則和器械安全(Device Safety)。1
截至到2022年12月31日�,CDRH已將 135 臺(tái)設(shè)備納入了“突破性設(shè)備計(jì)劃”(自2015年計(jì)劃成立以來(lái),總共 752 個(gè)設(shè)備被納入“突破性設(shè)備計(jì)劃”)����,并授予19個(gè)“突破性設(shè)備”的市場(chǎng)授權(quán)。
什么是“突破性設(shè)備計(jì)劃”�?
突破性設(shè)備計(jì)劃(Breakthrough Devices Program) 是美國(guó)食品藥品監(jiān)督管理局(FDA)于2015年4月啟動(dòng)的一種加快醫(yī)療器械開(kāi)發(fā)和審查過(guò)程的“綠色通道”,讓患者能盡快獲得有效診斷或可治療危及生命疾病的醫(yī)療器械�。
被FDA納入“突破性設(shè)備計(jì)劃”有什么好處?
FDA將被授予“突破性醫(yī)療器械”稱(chēng)號(hào)的產(chǎn)品提供有關(guān)設(shè)備開(kāi)發(fā)�、臨床試驗(yàn)方案的優(yōu)先權(quán)審查、FDA審核團(tuán)隊(duì)支持以及產(chǎn)品商業(yè)化決策的交流服務(wù)���。此舉可以大大推動(dòng)創(chuàng)新醫(yī)療器械的上市過(guò)程�。
FDA是否會(huì)公布設(shè)備何時(shí)被授予突破性設(shè)備稱(chēng)號(hào)?
在獲得上市許可證之前�,除非申辦者決定向公眾提供該信息,否則FDA不能公開(kāi)披露申辦者是否已提交器械突破性器械請(qǐng)求���。此外�,F(xiàn)DA計(jì)劃在官網(wǎng)上定期更新獲得突破性設(shè)備稱(chēng)號(hào)的設(shè)備列表�,一旦設(shè)備獲得營(yíng)銷(xiāo)授權(quán),就會(huì)將設(shè)備添加到列表中����。
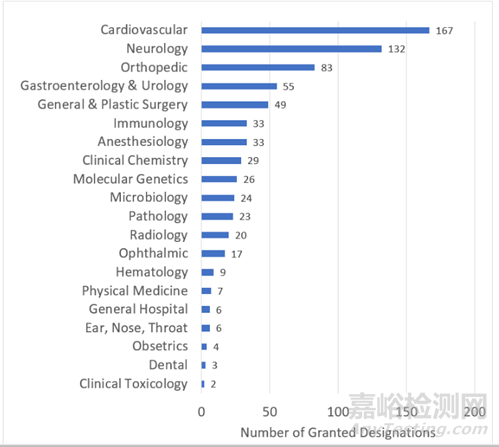
圖 獲得突破性設(shè)備的類(lèi)別
FDA目前公布了哪些獲得營(yíng)銷(xiāo)授權(quán)的突破性產(chǎn)品�?
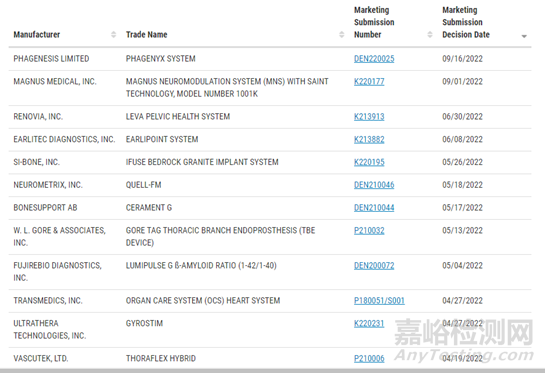
下表為截至到2022年9月30日,已獲得上市許可的CDRH和CBER突破性設(shè)備列表���。(此表為截至發(fā)文時(shí)間�,F(xiàn)DA官網(wǎng)所公布的突破性設(shè)備列表�,文末已附突破性設(shè)備列表原文鏈接)
產(chǎn)品1:Phagenyx System
制造商:Phagenesis Limited
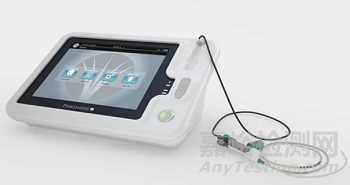
產(chǎn)品介紹:
Phagenyx System是一種先進(jìn)的治療系統(tǒng),通過(guò)咽部電刺激(PES)對(duì)吞咽協(xié)調(diào)的神經(jīng)組分進(jìn)行刺激�,來(lái)治療由神經(jīng)系統(tǒng)的破壞而產(chǎn)生的神經(jīng)源性吞咽困難。該系統(tǒng)適用于治療常常會(huì)遇到吞咽難題的中風(fēng)病人����、老年病人以及那些在加護(hù)病房?jī)?nèi)需要依靠機(jī)械通氣設(shè)備的病人���。
產(chǎn)品2:MAGNUS NEUROMODULATION SYSTEM (MNS) WITH SAINT TECHNOLOGY, MODEL NUMBER 1001K
制造商:MAGNUS MEDICAL, INC.
產(chǎn)品介紹:
SAINT神經(jīng)調(diào)節(jié)系統(tǒng)可以用于治療重度抑郁癥。SAINT具有作用快速���、非侵入性等特點(diǎn)���。它結(jié)合了先進(jìn)的成像技術(shù)、個(gè)性化瞄準(zhǔn)和新穎的神經(jīng)刺激模式����,通過(guò)使用突破性算法,SAINT可以對(duì)腦神經(jīng)進(jìn)行結(jié)構(gòu)定位和功能性層面的MRI成像�,從而確定重度抑郁癥患者接收神經(jīng)刺激的最佳靶點(diǎn)。
產(chǎn)品3:Leva Pelvic Health system
制造商:RENOVIA, INC.
產(chǎn)品介紹:
leva骨盆健康系統(tǒng)是一種非侵入性數(shù)字療法���,旨在康復(fù)和訓(xùn)練弱骨盆底肌肉����。它允許患者通過(guò)專(zhuān)用的移動(dòng)應(yīng)用程序無(wú)線(xiàn)實(shí)時(shí)性能數(shù)據(jù)來(lái)監(jiān)控他們?cè)谂璧准∪庥?xùn)練期間的進(jìn)展����。
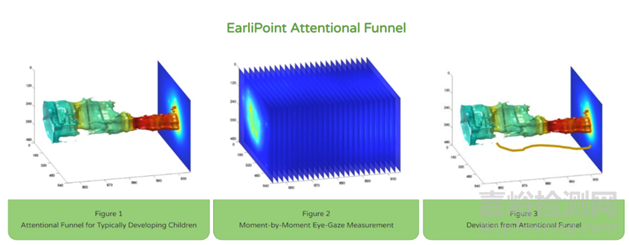
產(chǎn)品4:EARLIPOINT SYSTEM
制造商:EARLITEC DIAGNOSTICS, INC.
產(chǎn)品介紹:
EARLIPOINT SYSTEM是一種幫助臨床醫(yī)生診斷和評(píng)估兒童自閉癥譜系障礙(ASD)的客觀測(cè)量工具。 EarliPoint評(píng)估可以幫助早期識(shí)別ASD,并提供與社會(huì)殘疾水平���、語(yǔ)言和非語(yǔ)言能力相關(guān)的服務(wù)EarliPoint嚴(yán)重指數(shù)���。
產(chǎn)品5:IFUSE BEDROCK GRANITE IMPLANT SYSTEM
制造商:SI-BONE, INC.
產(chǎn)品介紹:
IFUSE BEDROCK GRANITE IMPLANT SYSTEM旨在提供骶髂融合術(shù)和骶骨固定,作為節(jié)段性脊柱融合的基礎(chǔ)要素����。
產(chǎn)品6:QUELL-FM
制造商:NEUROMETRIX, INC.
產(chǎn)品介紹:
Quell-FM裝置是一種經(jīng)皮神經(jīng)電刺激器,用于治療纖維肌痛癥狀�。Quell產(chǎn)品是一種完全自動(dòng)化的可穿戴神經(jīng)刺激技術(shù),可與智能手機(jī)或Apple Watch無(wú)線(xiàn)協(xié)作�。
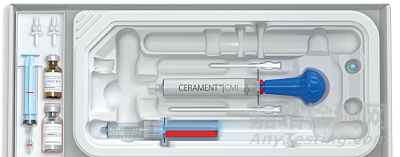
產(chǎn)品7:CERAMENT G
制造商:BONESUPPORT AB
產(chǎn)品介紹:
Cerament G是全身性抗生素治療和清創(chuàng)手術(shù)的輔助手段,可作為骨髓炎手術(shù)治療的一部分����,旨在促進(jìn)骨愈合并降低再感染和截肢的風(fēng)險(xiǎn)���。
產(chǎn)品8:GORE TAG THORACIC BRANCH ENDOPROSTHESIS (TBE DEVICE)
制造商:W. L. GORE & ASSOCIATES, INC.
產(chǎn)品介紹:
GORE TAG胸支內(nèi)假體旨在修復(fù)位于胸部最大動(dòng)脈(降主動(dòng)脈)的損傷���。胸支內(nèi)假體由三根鎳鈦諾骨架(支架移植物)支撐的植入式織物管組成。每個(gè)支架移植物都有一個(gè)基于導(dǎo)管的輸送系統(tǒng)���。
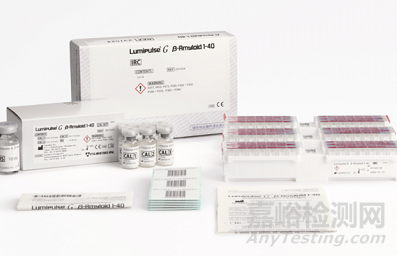
產(chǎn)品9:LUMIPULSE G ß-AMYLOID RATIO (1-42/1-40)
制造商:FUJIREBIO DIAGNOSTICS, INC.
產(chǎn)品介紹:
Lumipulse G β-淀粉樣蛋白比值 (1-42/1-40) 測(cè)試適用于 55 歲及以上�、患有認(rèn)知障礙的成年患者。Lumipulse測(cè)試旨在測(cè)量人腦脊液(CSF)中發(fā)現(xiàn)的β-淀粉樣蛋白1-42和β-淀粉樣蛋白1-40(可以積聚并形成斑塊的特定蛋白質(zhì))濃度的比例����,這可以幫助醫(yī)生確定患者是否有阿爾茨海默病的標(biāo)志即淀粉樣斑塊。
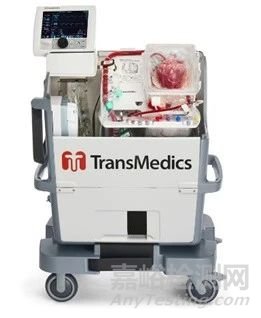
產(chǎn)品10:ORGAN CARE SYSTEM (OCS) HEART SYSTEM
制造商:TRANSMEDICS, INC.
產(chǎn)品介紹:
TransMedics器官護(hù)理系統(tǒng)(OCS)心臟系統(tǒng)旨在移植前保存供體心臟����。該系統(tǒng)包括一個(gè)便攜式外殼,可以保溫供體心臟����,為其提供氧氣和營(yíng)養(yǎng),以及提供心臟保存解決方案���。
產(chǎn)品11:GYROSTIM
制造商:ULTRATHERA TECHNOLOGIES, INC.
產(chǎn)品介紹:
GyroStim是一款計(jì)算機(jī)控制的自動(dòng)化多軸旋轉(zhuǎn)椅���,它能夠通過(guò)預(yù)先編程的動(dòng)作使患者在空中移動(dòng)身體,從而對(duì)感覺(jué)運(yùn)動(dòng)系統(tǒng)造成刺激���。GyroStim已被FDA批準(zhǔn)為用于治療平衡障礙和前庭功能障礙的突破性醫(yī)療設(shè)備���。
產(chǎn)品12:THORAFLEX HYBRID
制造商:VASCUTEK, LTD.
產(chǎn)品介紹:
Thoraflex Hybrid是一種一次性醫(yī)療設(shè)備,結(jié)合了Gelweave聚酯移植物和鎳鈦?zhàn)耘蛎浿Ъ芤浦参铮m用于主動(dòng)脈弓和降主動(dòng)脈受損或病變血管的開(kāi)放式手術(shù)修復(fù)或置換�。
產(chǎn)品13:AGILI-C
制造商:CARTIHEAL, LTD.
產(chǎn)品介紹:
Agili-C是一種植入物,旨在治療膝關(guān)節(jié)骨骼周?chē)浌侵邪l(fā)生的缺陷或病變����。植入物是多孔的,生物相容的和可吸收的雙相支架����,由相互連接的天然無(wú)機(jī)碳酸鈣組成。
怎么才能被納入突破性項(xiàng)目計(jì)劃�?
申請(qǐng)上市前批準(zhǔn)(PMA)、上市前通告 (510(k)) 或 De Novo指定的器械產(chǎn)品����,需同時(shí)符合以下兩個(gè)條件:一是該器械可治療或診斷危害生命的疾病。二是該器械應(yīng)滿(mǎn)足以下至少一項(xiàng):a.代表突破性技術(shù)b.無(wú)已批上市替代產(chǎn)品c.與現(xiàn)有或已批準(zhǔn)的替代產(chǎn)品相比具有顯著優(yōu)勢(shì)d.器械可及性符合患者最大利益����。
圖 符合突破性器械項(xiàng)目的條件
除此之外�,F(xiàn)DA認(rèn)為一些不符合“突破性設(shè)備計(jì)劃“,但在治療或診斷不太嚴(yán)重疾病方面具有顯著安全優(yōu)勢(shì)的醫(yī)療器械也能夠提供公共衛(wèi)生利益����。因此,F(xiàn)DA建立了醫(yī)療器械安全技術(shù)計(jì)劃(Safer Technologies Program,STeP)以鼓勵(lì)醫(yī)療器械廠(chǎng)商開(kāi)發(fā)創(chuàng)新的����、比現(xiàn)有產(chǎn)品更安全的替代品設(shè)備。根據(jù)FDA2022年年報(bào)指出���,2022年收到了30多項(xiàng)納入該計(jì)劃的請(qǐng)求����,并通過(guò)了14項(xiàng)目批準(zhǔn)����。
FDA網(wǎng)頁(yè)原文及產(chǎn)品介紹原文:
[1] CDRH2022年年報(bào)
https://www.fda.gov/about-fda/cdrh-reports/cdrh-2022-annual-report
[2] 產(chǎn)品1 Phagenyx System詳細(xì)介紹原文
https://www.fdanews.com/articles/209517-fda-authorizes-phagenesis-phagenyx-system
[3]產(chǎn)品2 Magnus Medical Receives FDA Clearance for the SAINT Neuromodulation System for Non-Invasive, Individualized and Precise Treatment of Severe Depression. 詳細(xì)介紹原文
https://www.magnusmed.com/press-releases/magnus-medical-receives-fda-clearance-for-the-saint-neuromodulation-system/
[4] 產(chǎn)品3 Leva Pelvic Health system詳細(xì)介紹原文
https://www.urologytimes.com/view/fda-grants-clearance-to-leva-pelvic-health-system-for-chronic-fecal-incontinence
[5] 產(chǎn)品4 EARLIPOINT SYSTEM 詳細(xì)介紹原文
https://www.earlitecdx.com/solutions/
[6] 產(chǎn)品5 IFUSE BEDROCK GRANITE IMPLANT SYSTEM詳細(xì)介紹原文
https://www.nsmedicaldevices.com/news/si-bone-secures-fda-approval-for-ifuse-bedrock-granite-implant-system/
[7] 產(chǎn)品6 QUELL-FM詳細(xì)介紹原文
https://www.myhealthyapple.com/nuerometrix-clears-denovo-on-its-quell-fm-wearable-that-works-with-apple-watch/
[8] 產(chǎn)品7 CERAMENT G 詳細(xì)介紹原文
https://www.ceramentgusa.com/#join
[9] 產(chǎn)品8 GORE TAG THORACIC BRANCH ENDOPROSTHESIS (TBE DEVICE) 詳細(xì)介紹原文
https://www.fda.gov/medical-devices/recently-approved-devices/gore-tag-thoracic-branch-endoprosthesis-p210032
[10] 產(chǎn)品9 LUMIPULSE G ß-AMYLOID RATIO (1-42/1-40) 詳細(xì)介紹原文
https://www.fda.gov/news-events/press-announcements/fda-permits-marketing-new-test-improve-diagnosis-alzheimers-disease
[11] 產(chǎn)品10 ORGAN CARE SYSTEM (OCS) HEART SYSTEM詳細(xì)介紹原文
https://www.fda.gov/medical-devices/recently-approved-devices/organ-care-system-ocs-heart-system-p180051
[12] 產(chǎn)品11 GYROSTIM詳細(xì)介紹原文
https://www.gyrostim.com/gyrostim-about
[13] 產(chǎn)品12 THORAFLEX HYBRID詳細(xì)介紹原文
https://www.fda.gov/medical-devices/recently-approved-devices/agili-c-p210034
[14] 產(chǎn)品13 AGILI-C詳細(xì)介紹原文
https://www.fda.gov/medical-devices/recently-approved-devices/agili-c-p210034
[15] 突破性器械項(xiàng)目的原則和優(yōu)勢(shì),F(xiàn)DA原文
https://www.fda.gov/media/108135/download