合適的細胞微環(huán)境是組織工程和再生醫(yī)學的關(guān)鍵。細胞微環(huán)境不僅包括細胞周圍的可溶性因子和其他細胞,還包括細胞外基質(zhì)和參與組織工程或再生過程中的任何生物材料。細胞微環(huán)境影響細胞在細胞外基質(zhì)或生物材料表面/內(nèi)部的黏附、遷移���、分化、增殖和通信���。因此��,對細胞微環(huán)境的研究可以指導(dǎo)新一代組織工程材料的設(shè)計���。
中國工程院院刊《Engineering》2022年第6期刊發(fā)復(fù)旦大學丁建東教授研究團隊的《組織工程與再生醫(yī)學中與生物材料相關(guān)的細胞微環(huán)境》一文���。文章綜述了與生物材料相關(guān)的細胞微環(huán)境���,主要從材料的化學成分��、材料的尺寸和結(jié)構(gòu)、材料控制的細胞幾何形狀��、材料的電荷對細胞的影響��、材料基體剛度和生物力學微環(huán)境��、材料的表面改性6個方面進行了梳理和介紹,并對未來發(fā)展方向進行了展望�����。
一���、引言
過去30年見證了再生醫(yī)學的出現(xiàn)和進步,其中,組織工程是再生醫(yī)學最有效的策略之一��。“組織工程”一詞于20世紀80年代由美籍華裔科學家和生物力學先驅(qū)馮元楨教授所提出�����。1985年��,他向美國國家科學基金會(NSF)提交了一份名為“活體組織工程中心”的研究提案��,并創(chuàng)造了“組織工程”一詞�����。此后���,各界科學家逐漸意識到“組織工程”這一概念的重要性��。1993年��,麻省理工學院的Robert Langer教授和哈佛醫(yī)學院的Joseph Vacanti教授在《科學》雜志上共同發(fā)表了一篇文章��,標志著組織工程學科的正式誕生��。根據(jù)國際生物材料科學與工程學會聯(lián)合會于2018年組織的“生物材料定義研討會”��,組織工程是指“使用細胞��、生物材料和合適的分子或物理因素���,單獨或組合��,修復(fù)或替換組織以改善臨床結(jié)果�����。”此外��,再生醫(yī)學是指“通過功能性組織或器官結(jié)構(gòu)的再生來治療疾病���、先天性疾病和損傷的療法”。
無論是對于具有材料和細胞的組織工程��,還是在沒有外部細胞的情況下植入支架進行原位修復(fù)的組織再生���,核心科學問題之一是細胞微環(huán)境�����。例如,骨髓基質(zhì)細胞或者稱間充質(zhì)干細胞(MSC)在復(fù)合多孔聚丙交酯-乙交酯(PLGA)支架植入正常關(guān)節(jié)腔后分化為軟骨細胞��,而皮下植入僅導(dǎo)致偏離軟骨形成的疤痕樣組織��。
細胞微環(huán)境不僅包括器官或組織本身的微環(huán)境,還包括植入材料影響的微環(huán)境?����,F(xiàn)代生物材料不再是生物惰性材料���;相反�����,生物活性已經(jīng)被認為是生物材料越來越重要的特性�����。根據(jù)最新的共識定義�����,生物材料是“一種旨在通過與生命系統(tǒng)的相互作用來指導(dǎo)治療或診斷過程的材料”�����。因此��,組織工程和再生醫(yī)學中的細胞微環(huán)境與細胞-材料相互作用的基礎(chǔ)科學密切相關(guān)��。本文就生物材料相關(guān)的細胞微環(huán)境作一介紹綜述�����。
細胞微環(huán)境影響細胞在細胞外基質(zhì)(ECM)或生物材料表面/內(nèi)部的黏附���、遷移�����、分化��、增殖和通信�����。在大多數(shù)情況下��,理想的組織工程和再生醫(yī)學生物材料的目標是模仿相應(yīng)的細胞外基質(zhì)�����,為細胞提供合適的微環(huán)境。因此��,對細胞微環(huán)境的研究可以指導(dǎo)新一代組織工程材料的設(shè)計。
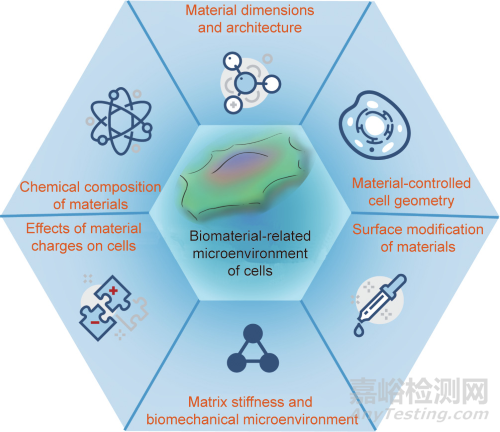
本文綜述了筆者對生物材料相關(guān)細胞微環(huán)境的一些關(guān)鍵方面的理解���,如圖1所示�����。下文將從以下6個方面介紹:①材料的化學成分���;②材料尺寸和結(jié)構(gòu);③材料控制的細胞幾何形狀�����;④材料的電荷對細胞的影響�����;⑤材料基體剛度和生物力學微環(huán)境���;⑥材料的表面改性���。
圖1. 與材料相關(guān)的細胞微環(huán)境的關(guān)鍵因素。
二、材料的化學成分
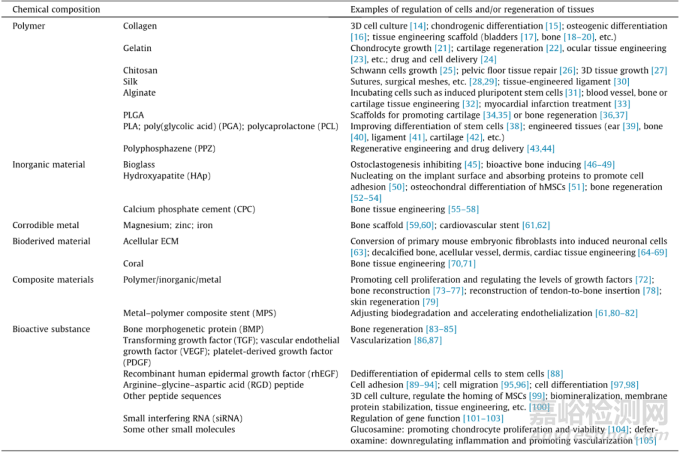
組織工程中使用的生物材料包括聚合物��、無機材料�����、金屬��、生物衍生材料以及由上述材料組成的復(fù)合材料�����。此外���,許多生物活性物質(zhì)可以促進組織修復(fù)和再生���。主要組織工程生物材料的分類如表1所示。
人體是由細胞和細胞外基質(zhì)組成的�����。在去除組織中的細胞以后�����,剩余的脫細胞基質(zhì)代表了組織再生的理想多孔支架,不僅提供了組織的形態(tài)���,而且為細胞提供了良好的微環(huán)境。然而���,由于脫細胞基質(zhì)的局限性��,由聚合物���、無機非金屬材料、金屬和復(fù)合材料組成的生物材料能滿足一些“仿生”的要求�����。一般來說���,金屬和無機非金屬材料因其強度高而更適合于硬組織修復(fù)�����,而水凝膠等一些聚合物材料則更適合于軟組織再生���。一些多肽和生物活性分子在細胞支持和組織再生中發(fā)揮著重要作用���。所有用于組織工程的生物材料原則上都應(yīng)當是生物相容、可生物降解和可制造的�����。
由于本文主要研究的是組織工程材料�����,一些重要但不可降解的材料并未列出��。
表1 用于組織工程和再生醫(yī)學的生物材料的化學成分
三�����、材料幾何尺寸和空間結(jié)構(gòu)
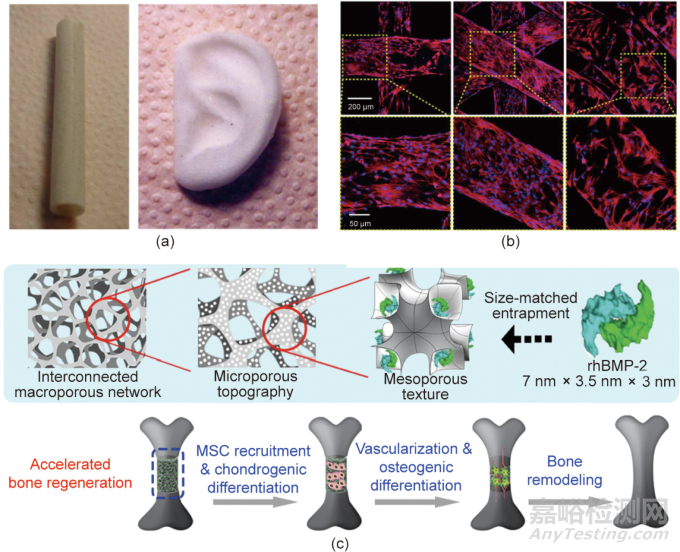
用于組織工程和組織再生的材料通常是三維(3D)多孔支架的形式���,以支持細胞的黏附���、遷移和生長。多孔支架的制備方法包括發(fā)泡法���、靜電紡絲�����、冷凍干燥���、模壓結(jié)合粒子浸出���。復(fù)旦大學丁建東團隊開發(fā)了一種結(jié)合室溫注射和顆粒浸出(RTIM/PL)的成型方法來制造由可生物降解聚酯組成的3D多孔支架��,用于組織工程�����,其中一些結(jié)果如圖2(a)所示�����。近年來��,3D打印和增材制造已成為定制具有不同外部形狀和內(nèi)部孔結(jié)構(gòu)的支架的理想方法���。具有不同3D打印結(jié)構(gòu)的支架的典型細胞圖像如圖2(b)所示���,不同尺度(宏觀/微觀/納米)的孔結(jié)構(gòu)會影響組織修復(fù)和再生��。
圖2. 組織工程支架研究的部分典型進展���。(a)室溫注射/顆粒浸出法(RTIM/PL)制備的管狀和耳狀PLGA多孔支架的全局視圖;(b)骨髓間充質(zhì)干細胞在3D打印的聚乳酸支架上培養(yǎng)7天后的熒光顯微圖像��,支架結(jié)構(gòu)從左到右依次為四方�����、六方和車輪狀結(jié)構(gòu)���;(c)負載了重組人骨形態(tài)發(fā)生蛋白rhBMP-2的多孔支架加速骨再生的示意圖���。
組織工程多孔支架的制備主要涉及兩個方面:獲得相互連通的多孔結(jié)構(gòu)及制備合適的支架形狀和尺寸?��?讖胶涂紫堵时徽J為是組織工程支架的重要幾何特征�����。例如��,為產(chǎn)生更好的骨軟骨修復(fù)效果���,軟骨層的孔徑應(yīng)為100~200 µm�����,軟骨下骨的孔徑以300~450 µm為宜���。孔徑過小會阻礙營養(yǎng)物質(zhì)的運輸��,而孔徑過大會導(dǎo)致細胞滲漏���。
高孔隙率和孔連通性也是組織形成的關(guān)鍵。高孔隙率促進支架內(nèi)骨組織的形成�����。Kruyt等研究了孔隙率分別為60%和70%的羥基磷灰石復(fù)合材料復(fù)合山羊骨髓基質(zhì)干細胞后的成骨效果�����。他們發(fā)現(xiàn)��,70%的孔隙率實現(xiàn)了更多的新骨形成��;這歸因于高孔率材料的表面積更大,從而對骨誘導(dǎo)因子和離子交換有更好的吸附���。
只有相互連通的孔結(jié)構(gòu)才有利于新組織的生長和組織界面的支撐���。Lu等發(fā)現(xiàn)孔隙的連通通道在20~50 µm的范圍內(nèi)只能形成軟骨或類骨樣組織,只有在大于50 µm的范圍內(nèi)才可形成礦化骨���,閉孔結(jié)構(gòu)阻礙了新生骨和血管的相互連接��,導(dǎo)致骨修復(fù)效果不理想��。
在滲流理論的基礎(chǔ)上���,丁建東等報道稱,具有球形孔的組織工程支架可能比具有立方孔的組織工程支架具有更好的內(nèi)部連通性��,這有利于細胞和組織的向內(nèi)生長�����。2001年�����,Ma和Choi提出了一種制備球形石蠟造孔劑的策略,成功地制備了具有球形氣孔和相互連接的內(nèi)部孔網(wǎng)結(jié)構(gòu)的聚乳酸多孔支架�����。丁建東團隊開發(fā)了一種將鹽微粒黏合在一起的水溶性致孔劑���,并將室溫模壓和粒子浸出相結(jié)合制備了球形PLGA多孔支架��。與傳統(tǒng)的由大顆粒氯化鈉制備的立方體大孔聚合物支架相比�����,球形大孔改性支架具有更好的內(nèi)孔連通性和更少的造孔劑殘留��。此外,在這種糖粘鹽內(nèi)孔壁中觀察到了良好的細胞黏附和成骨分化��,這可能是由于在致孔劑表面分布了許多微小的氯化鈉顆粒�����,從而在所得到的支架的孔壁上形成了粗糙的內(nèi)表面�����。
層次化的孔結(jié)構(gòu)在細胞微環(huán)境中對組織修復(fù)和再生發(fā)揮不同的功能,如圖2(c)所示��。大孔結(jié)構(gòu)有利于營養(yǎng)物質(zhì)的交換�����,而微孔結(jié)構(gòu)可以負載生物活性因子��。另外�����,支架的通道結(jié)構(gòu)和取向排列可誘導(dǎo)細胞的定向招募��,并最終影響軟骨內(nèi)成骨���。
除了多孔支架外�����,可注射水凝膠具有高含水率和與天然脫細胞基質(zhì)相似的特性�����,為組織工程中的種子細胞負載提供了一種替代方法���?�?勺⑸湫运z還具有顯著的優(yōu)點��,因為它們可以用微創(chuàng)注射取代傳統(tǒng)手術(shù)��,能夠適合缺陷部位的形狀�����,在要修復(fù)或再生的不規(guī)則形狀的受損組織部位的情況下尤其有用���。近年來,人們已經(jīng)開發(fā)了各種可注射水凝膠���,包括化學交聯(lián)水凝膠和物理交聯(lián)水凝膠�����,用于組織工程、藥物釋放和其他醫(yī)療應(yīng)用��。
從組織工程的角度來看,種子細胞被水凝膠網(wǎng)絡(luò)緊密包圍�����。水凝膠中相應(yīng)的細胞微環(huán)境不同于多孔支架內(nèi)表面的微環(huán)境�����。這種材料也可能影響細胞的行為���,通?����?梢愿玫胤从臣毎?D特性��。
四���、材料控制的細胞幾何形狀
細胞的形狀會受到該細胞附著的材料的圖案的影響。哈佛大學Ingber和Whiteside首次構(gòu)想了使用表面圖案化對單個細胞進行幾何控制���。它們的圖案是由抗污背景上的黏附性微島組成的��。隨后��,一系列圖案化材料被開發(fā)出來用于細胞研究�����,特別是用于控制細胞黏附�����。進一步的研究表明��,即使是單個細胞的分化也可以受到細胞幾何形狀的顯著調(diào)節(jié)�����。然而��,用于研究細胞分化的圖案化技術(shù)比細胞黏附技術(shù)更困難�����,因為它很難長期保持細胞的形狀��。事實上���,大多數(shù)非黏附性背景在充滿血清的培養(yǎng)液中不能保持長久地抵抗蛋白質(zhì)吸附和非特異性細胞黏附�����。
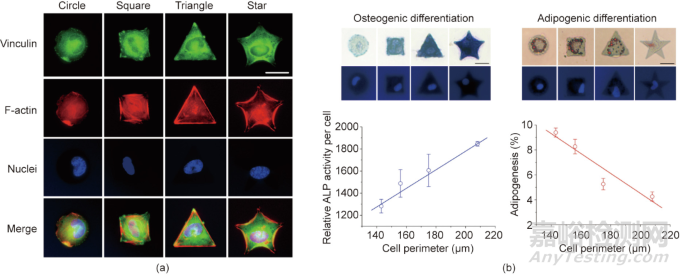
復(fù)旦大學丁建東團隊開發(fā)了一種具有持久的細胞黏附反差的微圖案��,這使得在微圖案表面上廣泛研究干細胞分化成為可能�����。將光刻技術(shù)���、大分子單體技術(shù)和轉(zhuǎn)移光刻等技術(shù)相結(jié)合,在聚乙二醇水凝膠上制備了精氨酸-甘氨酸-天冬氨酸(RGD)多肽微圖形��。在這種強烈且持久的無污染背景下�����,大鼠單個MSC可以很好地定位在RGD微島上��,通過保持適合單細胞大小的不同形狀的黏附微島黏附力���,研究發(fā)現(xiàn)細胞形狀會影響MSC的分化��,如圖3所示��。
圖3. 利用材料表面微圖案控制單細胞形狀和研究細胞形狀對干細胞分化的影響�����。(a)接枝RGD的不同形狀的微米島上的單細胞熒光顯微圖�����;(b)通過材料表面圖案化控制單細胞黏附研究其對干細胞分化的影響�����。ALP為堿性磷酸酶�����,比例尺為25 μm�����。
利用獨特的微圖案化技術(shù)�����,丁建東課題組研究表明細胞大?����。ㄤ佌姑娣e)和細胞-細胞接觸是調(diào)節(jié)干細胞分化的兩個潛在因素。圓形形態(tài)有利于細胞的成脂分化�����,而成骨分化趨勢與細胞受到的圖案張力呈正相關(guān)���。除了分化,細胞的形態(tài)���、遷移和轉(zhuǎn)錄也受到不同表面結(jié)構(gòu)材料的影響��。
借助于獨到的表面圖案化技術(shù)�����,研究表明��,除了細胞鋪展的大小外���,細胞-細胞接觸的程度、細胞命運和其他細胞行為可以很好地控制��,并顯著地受到材料圖案化的調(diào)節(jié)。
五��、材料的電荷對細胞的影響
官能團作為關(guān)鍵的化學線索��,已知會影響細胞的行為��。據(jù)報道��,羥基(—OH)和氨基(—NH2)端基表面比羧基(—COOH)和甲基(—CH3)端基表面更有利于成骨���。Curran等發(fā)現(xiàn)經(jīng)甲基(—CH3)�����、氨基(—NH2)�����、巰基(—SH)���、羥基(—OH)和羧基(—COOH)基團修飾的細胞培養(yǎng)板上可見不同程度的MSC分化。至于引入到聚乙二醇水凝膠中的官能團��,磷酸功能化的凝膠促進了MSC的成骨,而叔丁基功能化的凝膠促進了成脂分化��。
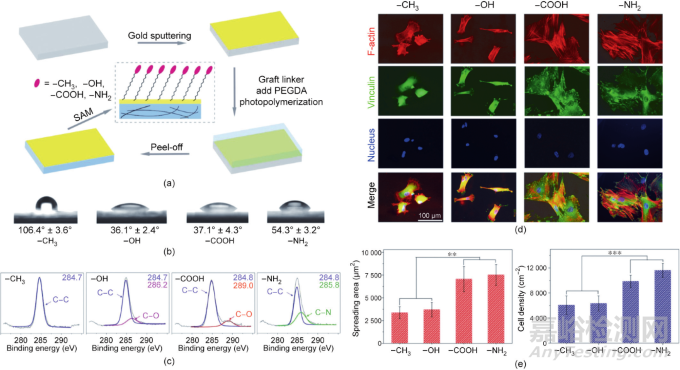
細胞培養(yǎng)液中的蛋白質(zhì)可以吸附在材料表面��。根據(jù)耗散石英晶體微天平的測量���,中性基團如—CH3和—OH表面的吸附蛋白質(zhì)比帶電的—COOH和—NH2表面的吸附蛋白質(zhì)少�����。基于化學生物學的研究��,丁建東團隊揭示了官能團通過調(diào)節(jié)蛋白質(zhì)吸附來調(diào)節(jié)干細胞分化�����,從而影響非特異性細胞黏附和干細胞的分化(圖4)�����。
圖4. 材料表面官能團影響細胞黏附和干細胞分化��。(a)制備具有4種官能團的聚乙二醇表面�����,以考察官能團對骨髓間充質(zhì)干細胞的影響。末端官能團分別為—CH3��、—OH�����、—COOH和—NH2�����;SAM為自組裝單分子膜���;PEGDA為聚乙二醇二丙烯酸酯�����。(b)不同官能團修飾的水凝膠上的接觸角��。(c)X射線光電子能譜(XPS)檢測修飾了不同官能團的材料表面上的C1s�����。(d)骨髓間充質(zhì)干細胞在具有不同官能團的表面上誘導(dǎo)成軟骨9天后��,F(xiàn)-肌動蛋白��、黏著斑蛋白和細胞核的熒光顯微圖�����。(e)統(tǒng)計骨髓間充質(zhì)干細胞誘導(dǎo)成軟骨后在不同功能基團表面的鋪展面積和細胞密度(n = 4)��。數(shù)據(jù)以均值±標準差表示��,用單因素方差分析處理��,**表示0.001 < P < 0.01���,***表示P < 0.001。
六�����、材料基體剛度和生物力學微環(huán)境
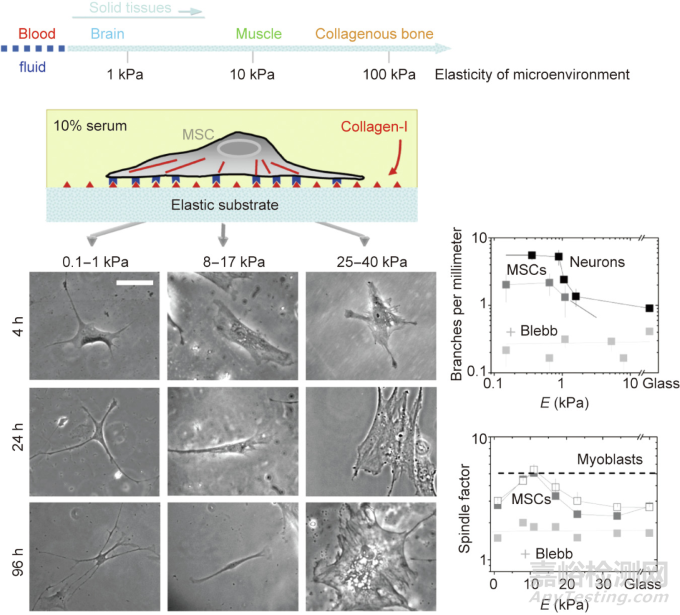
基質(zhì)硬度(stiffness效應(yīng))為干細胞分化提供了一種關(guān)鍵的物理因素���。美國賓州大學Discher等首次報道了基質(zhì)材料的硬度會顯著影響MSC的分化���。如圖5所示,MSC在柔軟的基質(zhì)上進行神經(jīng)分化,在中等硬度的基質(zhì)上進行肌源性分化�����,在硬質(zhì)表面進行成骨分化�����。類似的實驗結(jié)果后來在其他研究中也有報道���,包括Schaffer等的研究�����。
圖5. 基質(zhì)軟硬度調(diào)控干細胞分化的提出��。干細胞在不同模量的基質(zhì)上會有不同的分化趨勢���。+Blebb指加入Blebbistatin(一種選擇性的非肌球蛋白的細胞滲透性抑制劑),以在一定程度上破壞細胞骨架���。
雖然stiffness效應(yīng)可以被認為是材料相關(guān)細胞微環(huán)境歷史上的一個里程碑���,但它曾經(jīng)受到其他人員的質(zhì)疑���。當Discher的團隊改變聚丙烯酰胺(PAAM)的模量,然后使用生物大分子進行表面修飾以增強細胞黏附時�����,他們試圖保持相同數(shù)量的表面接枝和蛋白質(zhì)的吸附���。然而��,歐洲的一些研究小組認為�����,考慮到細胞的敏感性��,這是不可能的,他們聲稱可能是潛在的表面化學而不是基質(zhì)硬度導(dǎo)致了細胞反應(yīng)的差異��。這個“表面化學因素”的論點后來被Discher教授曾經(jīng)的弟子��、美國加州大學圣地亞哥分校的Engler等所反駁��。但是��,在歐美雙方各自的實驗中,基質(zhì)剛性和表面化學是耦合的��,因此��,很難彼此說服對方���。顯然���,很有必要開發(fā)一種能夠嚴格解耦基質(zhì)剛性和表面化學的模型材料系統(tǒng),以設(shè)計決定性的實驗��。
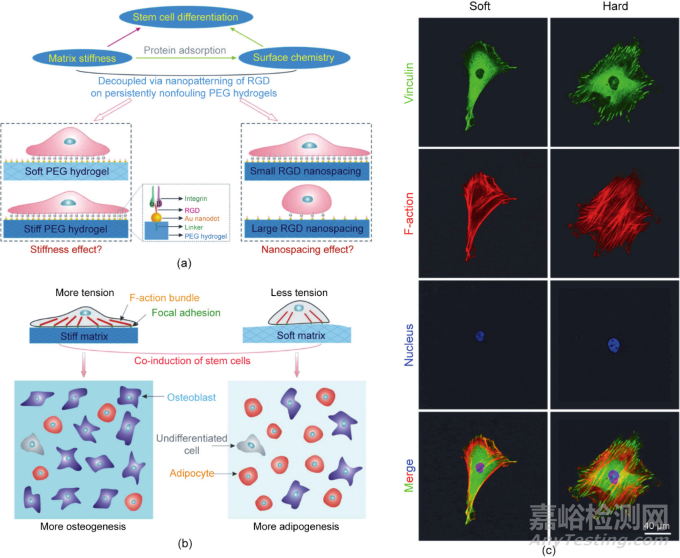
復(fù)旦大學丁建東課題組開發(fā)了一種獨特的表面納米技術(shù)�����,用于在強烈抗污的聚乙二醇水凝膠上通過轉(zhuǎn)移光刻技術(shù)制備牢固固定的規(guī)整的細胞黏附多肽RGD的納米陣列�����。這些納米點最初是通過嵌段共聚物膠束納米光刻生成���,并且得到了良好控制��。如果將相同的納米圖案轉(zhuǎn)移到具有不同大單體長度或不同濃度的交聯(lián)型聚乙二醇水凝膠上���,則有可能獲得具有相同表面化學和可調(diào)基質(zhì)剛性的材料�����。在這種嚴格的條件下�����,觀察到了不同的干細胞分化程度��,這種確定性實驗為stiffness效應(yīng)提供了堅實的證據(jù)�����。
此外�����,盡管成骨是正常的��,但在基質(zhì)硬度的情況下觀察到脂肪生成的“異常”程度。最終�����,丁建東團隊用細胞-細胞接觸和細胞-基質(zhì)接觸統(tǒng)一在基質(zhì)剛性效應(yīng)下解釋了這些有趣的行為。來自硬質(zhì)水凝膠的強烈機械反饋導(dǎo)致F-肌動蛋白復(fù)合體的激活增加和更強的細胞張力���。相應(yīng)的內(nèi)-外-內(nèi)感覺導(dǎo)致成骨增加[圖6(a)和(b)]���。細胞通常在硬質(zhì)水凝膠表面更為鋪展。在硬質(zhì)水凝膠上觀察到紐蛋白密集分布在細胞周圍以及顯著的肌動蛋白細絲�����,這表明細胞張力更高���,如圖6(c)所示�����。有趣的是���,美國的Chen等使用不同高度的微陣列來調(diào)整基礎(chǔ)材料的硬度。他們發(fā)現(xiàn)�����,軟質(zhì)微柱有利于成脂分化��,而硬質(zhì)微柱有利于成骨分化。
圖6. 基質(zhì)軟硬度調(diào)控干細胞分化的決定性實驗���。(a)研究基質(zhì)硬度對干細胞黏附和分化的影響的示意圖���。(b)細胞黏附配體的基質(zhì)硬度和納米級空間效應(yīng)直接決定干細胞的命運。(c)RGD納米圖案化的PEG水凝膠上的細胞黏附熒光顯微照片��。干細胞在基質(zhì)上黏附24 h���,然后免疫熒光染色顯示黏著斑蛋白(綠色)���、F-肌動蛋白(紅色)和細胞核(藍色)。
生物材料的軟硬度影響細胞分化�����,也影響組織再生���。例如��,一些金屬植入物超過了骨的硬度��,從而形成應(yīng)力屏蔽�����,阻礙了成骨和破骨的正常過程�����,而軟支架可能無法承受組織的力學要求��。此外��,stiffness效應(yīng)也會影響神經(jīng)組織��。據(jù)報道���,在中樞神經(jīng)系統(tǒng)植入剛性材料后,免疫反應(yīng)增加���。因此�����,在組織工程中必須考慮組織硬度和材料硬度的匹配��。值得注意的是��,有報道稱植入水凝膠后的脊髓可以通過超聲彈性成像作為一種非侵入性臨床建立的工具在犬模型中進行半定量��。期待關(guān)于基質(zhì)軟硬度和生物力學微環(huán)境的全面研究��。
七�����、材料的表面改性
復(fù)旦大學丁建東團隊基于其獨特的納米顆粒技術(shù)和精心的實驗設(shè)計所進行的一系列嚴格實驗不僅支持了美國Discher等最初提出的stiffness效應(yīng)���,而且還驗證了歐洲Watt等提出的表面化學效應(yīng)��。在聚乙二醇水凝膠上的RGD納米涂層技術(shù)可以將基質(zhì)剛性和表面化學的影響解耦�����,也可以通過將不同納米尺寸的納米顆粒轉(zhuǎn)移到具有相同基質(zhì)剛性的水凝膠上來簡單地檢測表面化學���。進一步,丁建東團隊揭示了調(diào)控細胞行為的重要納米因素��。
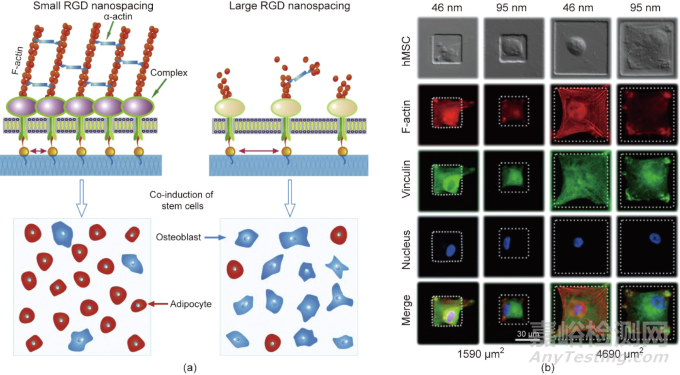
RGD納米點是干細胞分化的內(nèi)在調(diào)節(jié)因子���,適合于研究表面修飾和結(jié)構(gòu)對細胞的影響�����。只有當RGD在ECM或材料襯底上的納米間距小于約70 nm的臨界值時�����,才能很好地形成生物學意義上的焦點黏附�����,如圖7所示���。到目前為止,RGD修飾已被發(fā)現(xiàn)影響細胞的黏附��、遷移��、增殖��、分化和去分化�����。
圖7. 基于微納米圖案化表面技術(shù)發(fā)現(xiàn)材料表面RGD黏附多肽的納米間距可以調(diào)控干細胞的特異性黏附和分化。(a)RGD納米間距對干細胞分化的影響���;(b)RGD微/納米復(fù)合模式的制備及其干細胞分化的研究���。
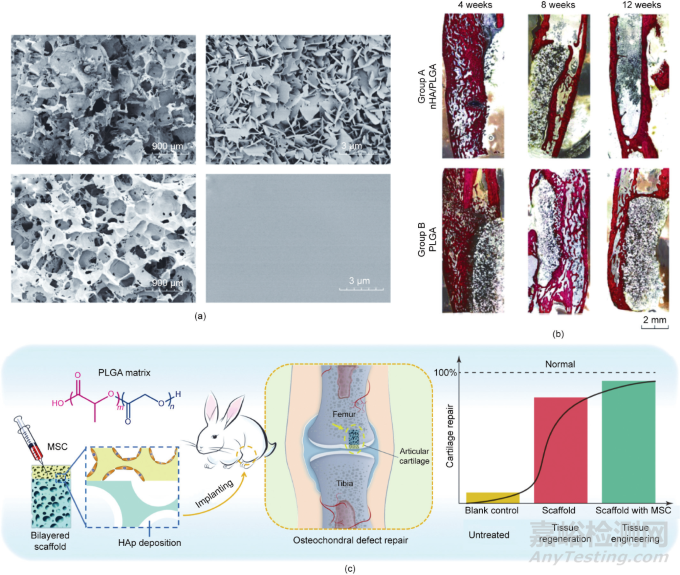
生物材料表面改性是在不改變材料本體性能的前提下,提高生物材料的生物相容性和調(diào)節(jié)生物活性的有效途徑��。材料表面改性包括化學改性和物理改性���,表面改性的方法通常包括浸漬法��、涂層法、接枝法和等離子體處理等�����。例如�����,羥基磷灰石(HAp)是骨的一種天然成分�����,經(jīng)常用于改性骨修復(fù)材料的表面。羥基磷灰石存在于自然骨中���,可以促進成骨細胞的增殖和代謝��。如圖8所示��,納米羥基磷灰石(nHA)修飾的PLGA支架比純PLGA支架有更好的再生效果�����。物理修飾通常是通過調(diào)節(jié)支架表面的拓撲形態(tài)或粗糙度來實現(xiàn)的,從而控制細胞的黏附���、增殖和分化��。已有研究證實�����,微米級粗糙度支架有利于骨髓間充質(zhì)干細胞的黏附��,不妨礙骨髓間充質(zhì)干細胞的增殖和成骨分化��。Kim等揭示了具有不同和合適的拓撲表面的三維多孔支架可以同時刺激成骨和軟骨生成�����,從而為雙層骨軟骨修復(fù)提供了一種設(shè)計策略���。
圖8. 基于具有改性內(nèi)表面的多孔支架的組織工程和原位組織再生���。(a)含羥基磷灰石涂層的PLGA支架的孔表面的場發(fā)射掃描電子顯微鏡(FE-SEM)圖像(上圖);未經(jīng)處理的PLGA支架的孔表面的FE-SEM圖像(下圖)�����。(b)骨修復(fù)再生的組織學圖像顯示納米羥基磷灰石涂層的PLGA支架具有較好的成骨能力���。(c)PLGA多孔支架再生關(guān)節(jié)軟骨和軟骨下骨的示意圖�����。
對于牙齒或骨組織再生材料��,通常采用表面改性來改善骨整合���。關(guān)于植入物與軟組織的生物黏合�����,聚多巴胺的良好多功能黏附性為生物大分子與甚至化學惰性表面的共價結(jié)合提供了一個很好的選擇,被廣泛用于增強材料表面的生物活性�����。使用肝素或其他生物活性分子對血管移植物進行表面修飾可以有效地提高血液相容性���,從而防止人工血管移植物中的血栓形成。Swartz等在用肝素和血管內(nèi)皮生長因子依次功能化的小腸黏膜下層的基礎(chǔ)上���,研制了一種無細胞組織工程血管���。一些生物活性成分可以促進血管形成和成骨�����。例如���,Qi等報道去鐵胺促進骨髓間充質(zhì)干細胞的骨再生和內(nèi)皮細胞的血管生成���。
八���、展望
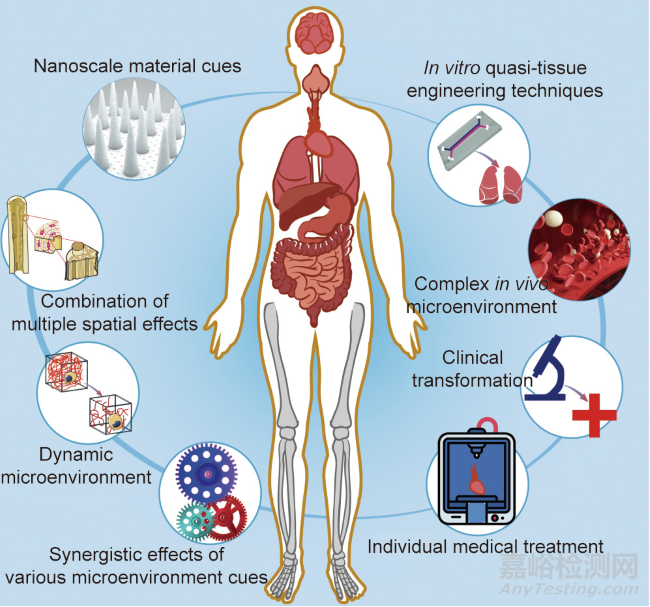
近年來�����,組織工程和組織再生技術(shù)有了長足發(fā)展。細胞與材料相互作用的基礎(chǔ)研究豐富了生物醫(yī)學材料的設(shè)計��,并提出了利用生物活性因子來改善生物材料的相容性和活性的策略��。模塊化自組裝和生物3D打印在組織工程以及再生支架的設(shè)計和制造方面提供了前所未有的靈活性和潛力���。雖然以上方面已經(jīng)取得了很大進展,但仍有一些關(guān)鍵問題需要關(guān)注�����,如圖9所示���。
圖9. 組織工程與細胞微環(huán)境需要關(guān)注的研究方向��。
(1)納米因素對各種細胞行為的影響���。最近發(fā)現(xiàn)��,細胞可以微妙地感知和響應(yīng)復(fù)雜的生命系統(tǒng)的納米級特征���。細胞黏附配體的納米尺度空間排列為細胞分化提供了一種新的獨立調(diào)節(jié)因子,在再生醫(yī)學的生物材料設(shè)計中應(yīng)予以考慮���。在不久的將來��,我們相信研究人員將揭示更多的材料納米因素來影響各種細胞行為��。
(2)組織工程多孔支架的多重空間效應(yīng)組合�����。雖然已經(jīng)對影響細胞的生物材料的各種幾何特征在宏觀�����、介觀和微觀水平上進行了研究,但生物體的結(jié)構(gòu)是復(fù)雜的且梯度變化的�����。為了更好地模擬生物的層次性,制備具有多尺度響應(yīng)的多孔支架成為一種途徑��。
(3)體內(nèi)復(fù)雜的微環(huán)境���,如植入生物材料后的免疫反應(yīng)等�����。異物免疫反應(yīng)可以由巨噬細胞或異體細胞所引起��,是植入醫(yī)療器械���、假體或生物材料后的終末期炎癥反應(yīng)。由生物材料支架驅(qū)動的免疫介導(dǎo)的組織再生正在成為一種修復(fù)受損組織的創(chuàng)新再生策略���。使用生物材料調(diào)控適應(yīng)性免疫系統(tǒng)可能會促進局部或全身免疫反應(yīng)的療法�����,最終刺激組織的修復(fù)再生。
(4)材料降解和動態(tài)微環(huán)境�����。理想的組織工程和再生材料應(yīng)該是可生物降解的,研究者已經(jīng)做出了努力來調(diào)整各種材料的生物降解性���。此外�����,生物成像技術(shù)促進了對這一生物降解過程的檢測���。
脫細胞基質(zhì)是動態(tài)的,植入體內(nèi)的生物材料受到物理���、化學和生物信號以及應(yīng)力載荷的影響���。為了概括細胞外基質(zhì)的動態(tài)性質(zhì),許多可逆的化學物質(zhì)已經(jīng)被結(jié)合到生物材料中��,以調(diào)節(jié)細胞擴散�����、生化配體呈遞和基質(zhì)力學��。在這種長期而復(fù)雜的作用下��,支架材料可能會出現(xiàn)復(fù)雜的結(jié)構(gòu)破壞或分子斷裂���,因此�����,生物材料的設(shè)計應(yīng)慎重���。除了降解產(chǎn)物的影響,最近發(fā)現(xiàn)降解速率提供了一個動態(tài)因素來調(diào)節(jié)細胞在設(shè)計良好的水凝膠上的黏附和分化��。材料降解過程中不可避免地伴隨著材料與細胞接觸的變化��,從而為細胞創(chuàng)造了動態(tài)的材料微環(huán)境�����?��?焖俳到猸h(huán)境中的細胞可能會感受到材料變化的影響�����,導(dǎo)致細胞活化以及細胞骨架重建和更高的牽引力�����。動態(tài)微環(huán)境正成為組織工程和組織再生領(lǐng)域的研究熱點���。
(5)各種微環(huán)境因素的協(xié)同效應(yīng)��。細胞微環(huán)境包括與材料因素和非材料因素相關(guān)的綜合考量�����。這些因素之間錯綜復(fù)雜的關(guān)系決定了與生物材料相關(guān)的細胞微環(huán)境���。今后應(yīng)更加重視不同因素之間的協(xié)同作用,以調(diào)節(jié)細胞微環(huán)境�����。
(6)體外準組織工程技術(shù)的發(fā)展與應(yīng)用�����。體外組織工程技術(shù)的發(fā)展��,如器官芯片或類器官(organoid),幫助我們更好地了解組織的再生過程��。這種體外構(gòu)建設(shè)備和技術(shù)也可以用于大規(guī)模藥物篩選��。此外���,利用水凝膠或其他材料幫助多個細胞形成有序細胞簇的類器官是準組織工程的一個很有前途的趨勢。
(7)體內(nèi)組織工程的精密生物材料制造和個性化醫(yī)療�����。隨著精準醫(yī)療和個性化醫(yī)療的出現(xiàn)�����,支架結(jié)構(gòu)的定制和設(shè)計變得越來越重要��。3D打印是構(gòu)建定制組織工程支架的前沿技術(shù)�����,但仍有一些關(guān)鍵技術(shù)需要改進�����,特別是在準確性和可靠性方面存有改進空間。
(8)生物材料和組織工程的臨床轉(zhuǎn)化���。工程化組織和再生組織的長期轉(zhuǎn)歸仍然沒有定論��。此外�����,目前尚不清楚早期移植細胞在原位組織再生中的作用和最終命運�����。臨床轉(zhuǎn)化中應(yīng)更加重視生物材料的標準化���。隨著工業(yè)化需求的增加,批量制造和檢測的標準化問題變得突出���。
總而言之�����,組織工程學已經(jīng)為修復(fù)受損組織或構(gòu)建新組織來治療多種疾病鋪平了道路�����。植入生物活性材料支架后的原位誘導(dǎo)也可用于體內(nèi)組織再生���。盡管組織工程和再生醫(yī)學在體外和小動物研究方面取得了快速進展�����,但在實現(xiàn)臨床和商業(yè)轉(zhuǎn)化方面的進展低于預(yù)期。隨著多學科的融合���,特別是與材料相關(guān)的微環(huán)境的研究深入���,人們希望在組織工程和組織再生方面取得更大的進展,造福人類��。組織工程中細胞微環(huán)境的未來研究有望促進生物活性材料的模塊化集成和精準醫(yī)學的逐步實現(xiàn)���。