Scrip Pharma Intelligence日前展望了2023年10項(xiàng)最值得關(guān)注的臨床III 期試驗(yàn)。[1]在臨床方面看起來(lái)特別強(qiáng)勁的是阿斯利康 ,諾和諾德和諾華����,它們今年的峰值潛力讀數(shù)都在 50 億美元至 60 億美元之間。羅氏����、輝瑞、禮來(lái)��、葛蘭素史克����、賽諾菲、默克和拜耳旗下的III期臨床研究也上榜����。以下的排名按照預(yù)計(jì)的臨床完成的時(shí)間順序排列。
1、Tusamitamab Ravtansine (CARMEN-LC03研究)
·開發(fā)商:賽諾菲/ ImmunoGen, Inc聯(lián)合開發(fā)
·藥物:tusamitamab ravtansine
·藥物類型:ADC(抗體-藥物偶聯(lián)物)
·適應(yīng)癥:NSCLC(非小細(xì)胞肺癌)
·階段: III期
·時(shí)間:2023年上半年
·背景:賽諾菲的Tusamitamab Ravtansine是處于后期開發(fā)階段的眾多抗體-藥物偶聯(lián)物 (ADC) 之一,是靶向 CEACAM5 的最先進(jìn)藥物����。
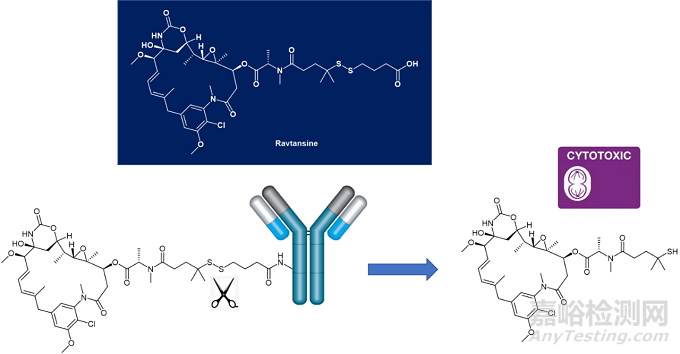
·機(jī)制:CEACAM5(Carcinoembryonic antigen-related cell adhesion molecule 5�,癌胚抗原相關(guān)細(xì)胞粘附分子5����,亦稱CD66e),是 CEA (Carcinoembryonic antigen,癌胚抗原)蛋白家族的成員���,在細(xì)胞遷移��、細(xì)胞侵襲和細(xì)胞粘附中起著關(guān)鍵作用����,并被多種癌細(xì)胞類型過(guò)度表達(dá)。在給予抗體-藥物偶聯(lián)物tusamitamab ravtansine 后�,其抗體部分將靶向腫瘤細(xì)胞上的 CEACAM5�����。在抗體/抗原結(jié)合以及內(nèi)化后����,ADC偶聯(lián)物將釋放細(xì)胞毒劑�����,導(dǎo)致腫瘤細(xì)胞死亡(圖1)��。
圖1. ravtansine化學(xué)結(jié)構(gòu)以及細(xì)胞毒素釋放過(guò)程
·臨床研究狀態(tài):來(lái)自 CEACAM5 陽(yáng)性二線和三線非小細(xì)胞肺癌 (NSCLC) 患者的 III 期 CARMEN-LC03 研究的頂線數(shù)據(jù)將于上半年到期�����。它有兩個(gè)主要終點(diǎn):與多西他賽docetaxel相比��,無(wú)進(jìn)展生存期 (PFS) 提高長(zhǎng)達(dá) 15 個(gè)月�����,總生存期 (OS) 與多西他賽相比提高長(zhǎng)達(dá)兩年��。
2���、Datopotamab Deruxtecan(TROPION-LUNG01研究)
·開發(fā)商:AstraZeneca/Daiichi Sankyo聯(lián)合開發(fā)
·藥物:Datopotamab Deruxtecan
·藥物類型:ADC(抗體-藥物偶聯(lián)物)
·適應(yīng)癥:NSCLC(非小細(xì)胞肺癌)
·階段: III期
·時(shí)間:2023年上半年
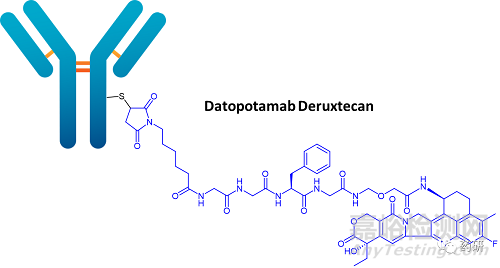
·背景:Datopotamab deruxtecan 正在臨床試驗(yàn)TROPION-LUNG01中進(jìn)行研究(Datopotamab與多西紫杉醇在既往治療過(guò)的晚期或轉(zhuǎn)移性非小細(xì)胞肺癌中無(wú)可操作基因組改變的研究 。
·機(jī)制:Datopotamab Deruxtecan以TROP2(trophoblast cell-surface antigen 2�����,滋養(yǎng)層細(xì)胞表面抗原 2)蛋白為靶點(diǎn)。TROP2是一種跨膜糖蛋白��,在多種類型的實(shí)體瘤中廣泛表達(dá)�����,包括非小細(xì)胞肺癌NSCLC�。[2]
·臨床研究狀態(tài):目前尚沒(méi)有 TROP2 定向療法被批準(zhǔn)用于治療 NSCLC 患者��。[3]但Gilead已在市場(chǎng)上推出首個(gè)靶向TROP2 的ADC Trodelvy (sacituzumab govitecan),用于二線或之后的局部晚期或轉(zhuǎn)移性三陰性乳腺癌 (TNBC)���,以及作為局部晚期或轉(zhuǎn)移性尿路上皮癌的后期治療�����。TROPION-LUNG01將評(píng)估Datopotamab vs多西紫杉醇��,對(duì)于先前接受過(guò)治療的晚期或轉(zhuǎn)移性非小細(xì)胞肺癌 (NSCLC) 患者中的療效����、安全性和藥代動(dòng)力學(xué)表現(xiàn)�。
3��、Belantamab mafodotin(DREAMM-8和DREAMM-7研究)
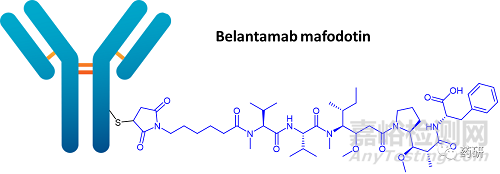
·開發(fā)商:葛蘭素史克
·藥物:Belantamab mafodotin(商品名:Blenrep)
·藥物類型:ADC
·適應(yīng)癥:二線多發(fā)性骨髓瘤
·時(shí)間:2023年上半年
·背景:葛蘭素史克的靶向 BCMA (B細(xì)胞成熟抗原����,B-cell maturation antigen)的重磅藥物Blenrep® (belantamab mafodotin) 的去年遭受打擊�,因?yàn)樵撍幬镂茨茉?III 期 DREAMM-3 驗(yàn)證性研究中顯示出顯著的 PFS(無(wú)進(jìn)展生存期) 益處�,去年年底應(yīng)FDA的要求從美國(guó)市場(chǎng)撤出該產(chǎn)品�。
Blenrep® 之前于 2020 年 8 月在美國(guó)被有條件地批準(zhǔn)用于復(fù)發(fā)/難治性多發(fā)性骨髓瘤。該藥物是第一個(gè)獲得批準(zhǔn)用于治療骨髓瘤的 BCMA 靶向藥物���,但對(duì)眼睛毒性的擔(dān)憂已經(jīng)導(dǎo)致其上市表現(xiàn)不佳����,它在 2022 年第三季度的收入僅達(dá)到 4280 萬(wàn)美元�。
·臨床研究狀態(tài):該產(chǎn)品的未來(lái)主要取決于 DREAMM-7 和 DREAMM-8 的數(shù)據(jù)��,這兩個(gè)數(shù)據(jù)都將在2023年上半年發(fā)布����。DREAMM-7 正在評(píng)估 belantamab mafodotin 聯(lián)合硼替佐米和地塞米松vs daratumumab 聯(lián)合硼替佐米和地塞米松的安全性和有效性。DREAMM-8 正在評(píng)估 belantamab mafodotin 聯(lián)合泊馬度胺和地塞米松vs泊馬度胺、硼替佐米和地塞米松聯(lián)合治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者的療效和安全性�。
4、Ribociclib(NATALEE研究)
·開發(fā)商:諾華
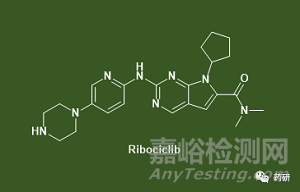
·藥物:Ribociclib (商品名Kisqali®)
·藥物類型:小分子
·適應(yīng)癥:乳腺癌
·時(shí)間: 2023年下半年
·背景:Kisqali 經(jīng) FDA 2017年批準(zhǔn)�,與芳香酶抑制劑或氟維司群聯(lián)合,作為初始內(nèi)分泌治療���,用于治療 HR+/HER2- 晚期或轉(zhuǎn)移性乳腺癌����。諾華希望通過(guò)NATALEE 研究�,將 Kisqali 用于早期患者�。諾華公司正在測(cè)試它作為 HR+/HER2- 早期乳腺癌的輔助療法�,可能為該產(chǎn)品開辟新的患者群體�。
·機(jī)制:Ribociclib 是一種選擇性細(xì)胞周期蛋白依賴性激酶抑制劑 (cyclin-dependent kinase inhibitor)�����,是一類通過(guò)抑制細(xì)胞周期蛋白依賴性激酶 4 和 6 (CDK4/6, cyclin-dependent kinase 4 and 6) ,來(lái)減緩癌癥進(jìn)展的藥物����。這些激酶在過(guò)度激活時(shí),會(huì)使癌細(xì)胞生長(zhǎng)和分裂過(guò)快�。靶向 CDK4/6 可能確保癌細(xì)胞不會(huì)繼續(xù)不受控制地復(fù)制��。Ribociclib 于 2017 年 3 月被美國(guó) FDA 批準(zhǔn)。目前是唯一一種在一線 HR+/HER2- 晚期乳腺癌中具有總體生存獲益的 CDK4/6 抑制劑����。
·臨床研究狀態(tài):諾華的目標(biāo)是通過(guò)其 CDK4/6 抑制劑 Kisqali (ribociclib) 獲得同類藥物最佳地位�,它瞄準(zhǔn)了輝瑞市場(chǎng)領(lǐng)先的 Ibrance (palbociclib)��,并尋求在早期乳腺癌中趕上禮來(lái) (Lilly) 的 Verzenio (abemaciclib)�。
諾華正在測(cè)試Ribociclib作為 HR+/HER2- 早期乳腺癌的輔助療法�,該研究(NATALEE)已經(jīng)通過(guò)了對(duì) 70% 事件的第一次中期分析,預(yù)計(jì)將在上半年進(jìn)行第二次中期分析(對(duì) 85%事件)��。最終分析將在2023年下半年給出����。分析師認(rèn)為該藥物的總銷售額預(yù)測(cè)為 100 億美元�����。
5�����、Semaglutide (SELECT CVOT研究)
·開發(fā)商:諾和諾德
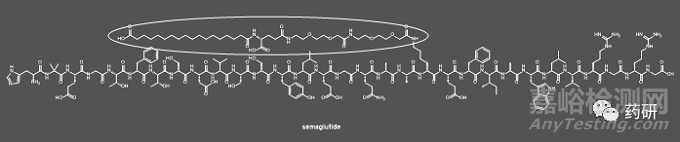
·藥物:Semaglutide(商品名Wegovy®)
·藥物類型:多肽
·適應(yīng)癥:肥胖癥
·時(shí)間: 2023年中
·機(jī)制:Semaglutide屬于胰高血糖素樣肽-1類似物(GLP-1)����,是GLP-1受體的激動(dòng)劑�����。GLP-1可以誘發(fā)分泌胰島素,從而降低血糖��,是II型糖尿病的治療劑�。Semaglutide的另一個(gè)功效是針對(duì)肥胖癥患者�����,它對(duì)于GLP-1受體的激動(dòng)劑作用�,可以降低食欲,增加飽腹感�����,從而實(shí)現(xiàn)體重管理的目標(biāo)����。
·背景:禮來(lái)的 GLP1/GIP 雙重受體激動(dòng)劑 Mounjaro®(tirzepatide)在肥胖癥(臨床III期中)追趕諾和諾德的 GLP1多肽 Wegovy®(semaglutide 注射液 2.4mg)。在此前的頭對(duì)頭研究中�,Mounjaro® 已經(jīng)在II糖尿病治療中取得了對(duì) semaglutide (Ozempic®) 的勝利,禮來(lái)公司也提出要在肥胖癥中進(jìn)行類似的比較試驗(yàn)�����。諾和諾德Wegovy的肥胖癥研究SELECT CVOT正在進(jìn)行中���,預(yù)計(jì)于今年年中取得結(jié)果�����。諾和諾德在 Wegovy 的 17500 名患者參加的 SELECT 研究中,進(jìn)行心血管方面的分析�,加上口服semaglutide的 OASIS 1 研究,這些結(jié)果對(duì)于鞏固其 semaglutide 特許經(jīng)營(yíng)權(quán)意義重大����。分析師非常相信 SELECT-CVOT 最終將在年中進(jìn)行的最終分析中取得成功�。他們將 Wegovy 的最高銷售額定在 114 億美元左右����。
6�����、Donanemab(RAILBLAZER-ALZ2研究)
·開發(fā)商:禮來(lái)
·藥物:Donanemab
·藥物類型:?jiǎn)慰寺】贵w
·適應(yīng)癥:阿爾茨海默病
·階段:III期
·時(shí)間: 2023年中
·機(jī)制:Donanemab (LY3002813) 是一種人源化 IgG1 單克隆抗體,靶向特定類型淀粉樣蛋白 β (Aβ) ����,即焦谷氨酸 Aβ (pyroglutamate Aβ)的N 末端的表位 �,這種靶標(biāo)為僅存在于與阿爾茨海默病相關(guān)的腦淀粉樣蛋白斑塊中�����。[4]它的作用是誘導(dǎo)小膠質(zhì)細(xì)胞介導(dǎo)的現(xiàn)有 Aβ 斑塊的清除,目的是減緩與阿爾茨海默病相關(guān)的認(rèn)知功能的進(jìn)行性下降���。
·背景:禮來(lái)公司2022 年底向 FDA 發(fā)起了Donanemab生物制劑許可申請(qǐng) (BLA)�����,但由于在 II 期 TRAILBLAZER-ALZ 臨床試驗(yàn)中,至少12 個(gè)月的藥物暴露數(shù)據(jù)的患者數(shù)量有限���,F(xiàn)DA剛剛發(fā)布了一份完整的回復(fù)函��。
·臨床研究狀態(tài):2021 年 3 月,禮來(lái)公司宣布了一項(xiàng)名為 TRAILBLAZER-ALZ 2 的擴(kuò)展III期試驗(yàn)�,該試驗(yàn)將尋求在擴(kuò)大的患者群體中確認(rèn)之前試驗(yàn)的結(jié)果�,以解決原始試驗(yàn)的一些缺陷�。[5]禮來(lái)目前正在準(zhǔn)備針對(duì)早期疾病 的III期RAILBLAZER-ALZ2研究�,以應(yīng)對(duì)這一問(wèn)題����,并計(jì)劃2023年中公布頂線結(jié)果��。分析師指出,這些數(shù)據(jù)對(duì)禮來(lái)的未來(lái)很重要���。
7��、mRNA 流感疫苗PF-07252220
·開發(fā)商:輝瑞
·藥物:PF-07252220
·藥物類型:疫苗
·適應(yīng)癥:流感
·階段:III期
·時(shí)間:2023年下半年
·背景與臨床研究狀態(tài):輝瑞公司于去年 9 月開始了基于 mRNA 的流感疫苗 PF-07252220 的第一個(gè) III 期功效研究�,美國(guó) 25000 名患者的試驗(yàn)結(jié)果預(yù)計(jì)將于2023年中公布�。 四價(jià)修飾 RNA (modRNA) 候選流感疫苗是 2018 年與 BioNTech SE 達(dá)成的全球合作和許可協(xié)議的一部分。
輝瑞估計(jì)其 mRNA 疫苗產(chǎn)品組合的年收入潛力在 100 億美元至 150 億美元之間���。他們表示���,針對(duì) COVID-19 的 mRNA 疫苗已顯示出與傳統(tǒng)重組蛋白疫苗相當(dāng)或更好的功效�,而且 PF-07252220 的初始數(shù)據(jù)顯示出令人樂(lè)觀的結(jié)果�。
8�、SRP-9001(EMBARK研究)
·開發(fā)商:羅氏/Sarepta
·藥物:SRP-9001 (delandistrogene moxeparvovec)
·藥物類型:基因療法
·適應(yīng)癥:杜氏肌營(yíng)養(yǎng)不良癥
·階段:III期
·時(shí)間:2023年下半年
·背景:SRP-9001正在開發(fā)用于治療罕見病杜氏肌營(yíng)養(yǎng)不良癥。它通過(guò)肌肉內(nèi)和靜脈內(nèi)途徑給藥�����。該療法通過(guò)重組腺相關(guān)病毒載體血清型 74 (AAV74)�����, 攜帶微抗肌萎縮蛋白基因?qū)崿F(xiàn)治療目的���。
·臨床研究狀態(tài):來(lái)自羅氏和 Sarepta Therapeutics, Inc. 的 Duchenne 肌營(yíng)養(yǎng)不良基因療法 SRP-9001 (delandistrogene moxeparvovec) 的 EMBARK III 期研究數(shù)據(jù)將于 10 月到期�,但FDA 已決定 通過(guò)優(yōu)先審查盡早審查藥物數(shù)據(jù)���,并將 PDUFA 日期定為 5 月 29 日�����。該研究納入了 125 名年齡在 4-7 歲之間的患者�����,該年齡組的肌肉已經(jīng)開始退化�,但仍然能夠行走。其主要終點(diǎn)是北極星動(dòng)態(tài)評(píng)估總分相對(duì)于基線的變化���,以衡量在第 52 周時(shí)的進(jìn)展情況����。
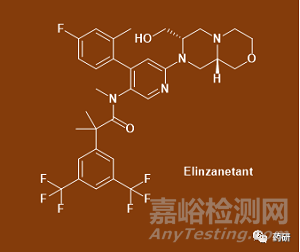
9、Elinzanetant(OASIS研究)
·開發(fā)商:拜耳
·藥物:Elinzanetant
·藥物類型:小分子藥物
·適應(yīng)癥:更年期血管舒縮癥狀
·階段:III期
·機(jī)制:Elinzanetant是一種口服活性小分子神經(jīng)激肽 NK1 受體和 NK3 受體拮抗劑,這種雙重作用機(jī)制可能會(huì)降低參與體溫調(diào)節(jié)的 kisspeptin(調(diào)控女性生殖內(nèi)分泌功能的重要肽激素)�、神經(jīng)激肽 B 和強(qiáng)啡肽神經(jīng)元回路的過(guò)度活躍。已發(fā)現(xiàn)它可以緩解絕經(jīng)后婦女的潮熱����,并以劑量依賴性方式抑制絕經(jīng)前婦女的黃體生成素����、雌二醇和黃體酮水平����。[6]
·時(shí)間: 2023 年下半年
·背景:拜耳的 OASIS 研究 Elinzanetant 治療更年期血管舒縮癥狀。護(hù)理標(biāo)準(zhǔn)���,激素療法����,由于禁忌癥或個(gè)人偏好,對(duì)于更年期癥狀的治療的選擇是有限的����。相比之下����,Elinzanetant 在 II 期研究中顯示出顯著且快速的血管舒縮癥狀改善,并且耐受性良好��。數(shù)據(jù)結(jié)果顯示,Elinzanetant可能比 競(jìng)爭(zhēng)對(duì)手 Astellas Pharma, Inc.的fezolinetant(一種口服神經(jīng)激肽 3 受體拮抗劑)更具優(yōu)勢(shì)�����。
·臨床研究狀態(tài):Elinzanetant III 期 OASIS 研究計(jì)劃的第一批結(jié)果預(yù)計(jì)將于 2023 年下半年公布。FDA正在對(duì)其進(jìn)行優(yōu)先審查����,預(yù)計(jì)將于 2 月 22 日做出決定�。拜耳寄希望于在峰值銷售額中帶來(lái)總計(jì) 120 億歐元銷售額��。
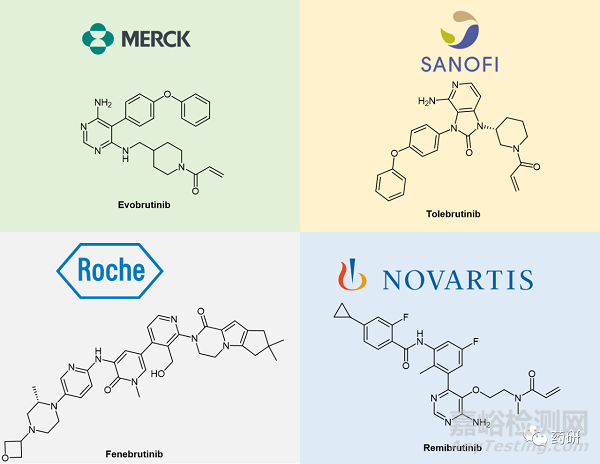
10、Evobrutinib(EVOLUTION RMS 1 和2研究)
·開發(fā)商:默克
·藥物:Evobrutinib
·藥物類型:小分子藥物
·適應(yīng)癥:復(fù)發(fā)性多發(fā)性硬化癥
·階段:III期
·機(jī)制:Evobrutinib是一款酪氨酸激酶小分子抑制劑��,靶向BTK (布魯頓氏酪氨酸激酶, Bruton tyrosine kinase) �。BTK 在 B 細(xì)胞發(fā)育中起著至關(guān)重要的作用,它們的激活是抗原受體信號(hào)傳導(dǎo)的第一步����。BTK 由 B 細(xì)胞和骨髓細(xì)胞表達(dá)�,這兩種細(xì)胞都被認(rèn)為是 多發(fā)性硬化癥的驅(qū)動(dòng)因素。
·時(shí)間: 2023 年第4季度
·背景:BTK 抑制劑將成為多發(fā)性硬化癥的下一個(gè)大戰(zhàn)場(chǎng),許多候選藥物處于后期開發(fā)階段��。目前領(lǐng)先的是默克的 evobrutinib 和賽諾菲的 tolebrutinib�,緊隨其后的是羅氏的fenebrutinib和諾華remibrutinib。
BTK 抑制劑具有高選擇性�,僅針對(duì)某些 B 細(xì)胞,與靶向 CD20 的單克隆抗體相比,例如羅氏的Ocrevus(ocrelizumab)和諾華的Kesimpta(ofatumumab)���,具有更高的安全性�����。此外���,BTK 抑制劑可以穿過(guò)血腦屏障�����,因此它們可以抑制驅(qū)動(dòng)多發(fā)性硬化癥發(fā)展的 B 細(xì)胞和小膠質(zhì)細(xì)胞�����。
·臨床研究狀態(tài): 默克公司的 evobrutinib 在復(fù)發(fā)性多發(fā)性硬化癥中的 EVOLUTION RMS 1 和 2 III 期試驗(yàn),可能會(huì)在 2023 年最后一個(gè)季度的某個(gè)時(shí)候首先報(bào)告��,其結(jié)果可能與賽諾菲的 tolebrutinib 的 III 期讀數(shù)不相上下�。