今日頭條
和鉑CCR8靶向抗體獲批臨床。和鉑醫(yī)藥自主開發(fā)的針對G蛋白偶聯(lián)受體(GPCR)CCR8的單抗藥物HBM1022獲FDA臨床批件���。HBM1022可通過抑制CCR8陽性的調(diào)節(jié)T細胞,啟動腫瘤微環(huán)境中效應(yīng)性T細胞的腫瘤特異性殺傷���,從而起到治療腫瘤的作用�����。HBM1022有望為包括乳腺癌,結(jié)腸癌�����,胃癌���,非小細胞肺癌,頭頸癌等實體瘤患者提供新的治療選擇�����。
國內(nèi)藥訊
1.禮來減重新藥中國III期研究成功��。禮來宣布其每周注射1次的GIP/GLP-1雙重激動劑Tirzepatide(替爾泊肽)�����,在用于肥胖或超重中國患者的III期SURMOUNT-CN研究達到主要終點和所有關(guān)鍵次要終點��。臨床中未出現(xiàn)新的安全性信號��,具體數(shù)據(jù)正在整理當中���。去年10月,F(xiàn)DA已授予tirzepatide用于成人肥胖或超重的快速通道資格�����,禮來目前已向FDA滾動提交減重適應(yīng)癥上市申請���。
2.樂普/康諾亞CLDN18.2-ADC早期臨床積極。樂普生物與康諾亞合作開發(fā)的靶向Claudin 18.2的ADC創(chuàng)新藥CMG901在ASCO GI2023年會上公布治療晚期實體瘤的Ia期臨床積極數(shù)據(jù)�����。結(jié)果顯示��,CMG901在Claudin 18.2陽性胃癌或胃食管結(jié)合部腺癌患者中的客觀緩解率達到75%�����,疾病控制率為100%��。中位無進展生存時間(mPFS)和中位總生存時間(mOS)均尚未達到���。此外,藥物總體耐受性良好��。
3.默沙東新型抗凝藥在華啟動臨床���。默沙東新型凝血因子XI抑制劑MK-2060在國內(nèi)首次登記啟動一項I期臨床,擬評估MK-2060在中國健康成年男性受試者中的安全性��、藥代動力學(xué)和初步療效��。MK-2060既可阻斷凝血因子XI的活化���,又能抑制XI所介導(dǎo)的下游級聯(lián)凝血反應(yīng)�����。此前��,F(xiàn)DA已授予MK-2060快速通道資格��,用于降低終末期腎病(ESRD)患者發(fā)生重大血栓性心血管事件的風(fēng)險��。
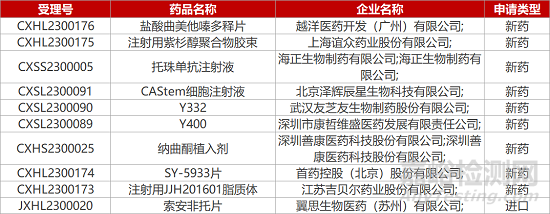
4.再鼎引進TF靶向ADC報IND�����。再鼎醫(yī)藥與Seagen公司合作開發(fā)的3.1類新藥“注射用tisotumab vedotin”臨床試驗申請獲CDE受理(JXSL2300032)。tisotumab vedotin是一款靶向組織因子(TF)的抗體偶聯(lián)物藥物(ADC)�����,也是首個靶向TF的宮頸癌新藥��,已在2021年獲FDA加速批準上市��。去年年底��,該新藥在中國登記啟動一項國際Ⅲ期臨床�����,旨在復(fù)發(fā)性或轉(zhuǎn)移性宮頸癌患者中比較tisotumab vedotin與化療方案的臨床療效改善���。
5.武漢友芝友兩款雙抗報IND��。武漢友芝友開發(fā)的兩款1類生物制品Y332和Y400的臨床試驗申請獲CDE受理。Y332是一款重組抗VEGF/TGF-β雙抗�����,通過同時靶向VEGF和TGF-β���,在協(xié)同效應(yīng)下改變癌癥患者的免疫抑制性TME��,恢復(fù)患者失調(diào)的抗腫瘤免疫力。Y400是一種抗VEGF/ANG2雙抗��,武漢友芝友已于2022年7月將Y400的所有權(quán)利及資產(chǎn)轉(zhuǎn)讓給康哲眼科��。
國際藥訊
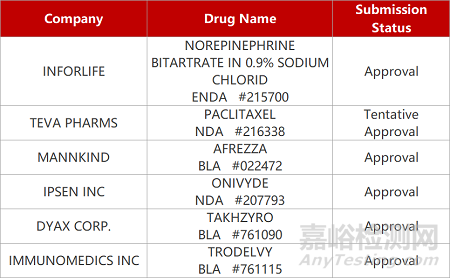
1.武田HAE單抗獲批用于兒童�����。FDA批準武田Takhzyro(lanadelumab)的補充生物制品許可(sBLA)申請���,用以預(yù)防2歲至12歲以下兒童患者遺傳性血管性水腫(HAE)發(fā)作。Takhzyro是一款靶向HAE的抗體藥物�����,可特異性結(jié)合并抑制HAE患者體內(nèi)不受控制的血漿激肽釋放酶�����,從而達到預(yù)防發(fā)病的效果���。2018年8月,Takhzyro已獲FDA批準上市���,用于預(yù)防12歲及以上患者的HAE發(fā)作��。
2.阿片類藥物過量搶救療法報NDA���。Orexo公司開發(fā)的鼻內(nèi)搶救藥物OX124向FDA遞交新藥上市申請(NDA)���,用于阿片類藥物使用過量的搶救���。OX124含有高劑量納洛酮���,旨在逆轉(zhuǎn)強效的合成阿片類藥物(如芬太尼)的作用��。在關(guān)鍵研究(OX124-002)中�����,與肌肉注射的活性對照組相比���,OX124中納洛酮的吸收速度更快、程度更高�����。
3.楊森FcRn抗體Ⅱ期臨床積極���。強生旗下楊森(Janssen)靶向新生兒Fc受體(FcRn)的潛在“best-in-class“抗體nipocalimab,在用于治療高風(fēng)險出現(xiàn)嚴重新生兒溶血病(HDFN)孕婦的Ⅱ期臨床中達到主要終點。大部分接受nipocalimab治療的孕婦成功在孕期32周后生下活著的嬰兒��,并且在整個懷孕期間未接受宮腔內(nèi)輸血(IUT)�����。此前���,該新藥已獲FDA授予的預(yù)防胎兒和新生兒溶血病的孤兒藥資格���,并已在治療重癥肌無力的Ⅱ期臨床中獲得積極結(jié)果���。
4.渤健抑郁癥新藥獲FDA優(yōu)先審評。渤健與Sage開發(fā)的新一代GABAA變構(gòu)調(diào)節(jié)劑Zuranolone的上市申請獲FDA受理��,用于治療重度抑郁癥(MDD)和產(chǎn)后抑郁癥(PPD)��。FDA同時授予其優(yōu)先審評資格���,PDUFA日期為8月5日。在CORAL研究中���,Zuranolone聯(lián)合標準治療使MDD患者的17項漢密爾頓抑郁量表(HAMD-17)評分較安慰劑顯著改善(-8.9±0.39vs-7.0±0.38��,p=0.0004)���。在SKYLARK研究中�����,與安慰劑相比��,50mg zuranolone治療組第15天時HAMD-17評分較基線顯著降低(-15.6vs-11.6���,p=0.0007)。
5.Idorsia公司腦出血藥物歐美Ⅲ期臨床失敗���。Idorsia公司在日本獲批上市的腦出血藥物Clzosentan,日前在一項歐美開展的Ⅲ期臨床中未能達到預(yù)期結(jié)果���。該項研究評估Clzosentan用于預(yù)防動脈瘤性蛛網(wǎng)膜下腔出血(aSAH)后延遲性腦缺血引起的并發(fā)癥的能力���。結(jié)果顯示,在aSAH中���,大腦血管變窄��,導(dǎo)致血液聚集在大腦表面���,從而增加對大腦的壓迫。詳細數(shù)據(jù)將在科學(xué)文獻中公布�����。
6.安斯泰來更換總裁兼CEO���。安斯泰來日前宣布���,執(zhí)行副總裁Naoki Okamura被任命為公司新總裁兼CEO��,繼續(xù)推進CSP 2021(2021-2025財年)戰(zhàn)略計劃��。前總裁兼CEO Kenji Yasukawa升任公司董事會主席。同日�����,安斯泰來還公布2022年業(yè)績報告,2022自然年全年營收112.45億美元��,其中Xtandi(48.60億美元)��、Prograf(15億美元)��、Betanis/Myrbetriq/Betmiga(14.28億美元)業(yè)績耀眼���。
醫(yī)藥熱點
1.廣東非免疫規(guī)劃疫苗接種有新方案。廣東省衛(wèi)健委發(fā)布《廣東省非免疫規(guī)劃疫苗接種方案(2023年版)》��。新版方案對接種原則���、接種方案��、其他事項等作出規(guī)定��,對重組乙型肝炎疫苗等22類疫苗的疫苗作用�����、推薦接種人群、免疫程序等提出詳細的指導(dǎo)意見���。據(jù)新版方案���,2023年���,廣東新增一款疫苗,該疫苗為2022年新上市的ACYW135群腦膜炎球菌多糖結(jié)合疫苗(CRM197載體)���。該疫苗可預(yù)防A群、C群��、Y群和W135群腦膜炎球菌引起的流行性腦脊髓膜炎��,推薦適用人群為3月齡至3歲兒童�����。
2.電子科技大學(xué)新添附屬醫(yī)院。四川省腫瘤醫(yī)院5日舉行電子科技大學(xué)附屬腫瘤醫(yī)院揭牌儀式�����。據(jù)悉���,四川省腫瘤醫(yī)院與電子科技大學(xué)已長期保持良好深度合作關(guān)系���。未來���,雙方將在臨床醫(yī)學(xué)博士點申報、學(xué)科建設(shè)��、重大科研項目申請與轉(zhuǎn)化等方面��,充分發(fā)揮電子科技大學(xué)與四川省腫瘤醫(yī)院各自的優(yōu)勢���,整合醫(yī)、工的各類資源�����,催生新技術(shù)���,產(chǎn)出大成果�����,實現(xiàn)新突破��。
3.輔助生殖技術(shù)將逐步納入醫(yī)保范圍��。針對建議將不孕不育治療納入免費醫(yī)療的提案���,國家醫(yī)保局近日答復(fù),醫(yī)保部門始終高度重視人口問題��,已將符合條件的生育支持藥物如溴隱亭�����、曲普瑞林��、氯米芬等促排卵藥品納入醫(yī)保支付范國�����;下一步�����,國家醫(yī)保局將逐步把適宜的分娩鎮(zhèn)痛和輔助生殖技術(shù)項目納入基金支付范圍�����,減輕不孕不育患者醫(yī)療負擔(dān)��。
評審動態(tài)
1. CDE新藥受理情況(02月07日)
2. FDA新藥獲批情況(北美02月06日)