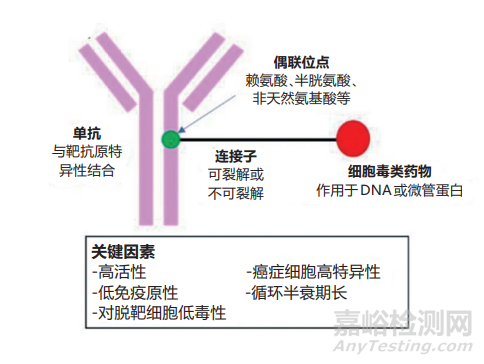
抗體偶聯(lián)藥物(ADC)由抗體��、細(xì)胞毒素和連接子組成(如圖1[1])��,被認(rèn)為是一種靶向治療各種類型腫瘤和癌癥的創(chuàng)新治療方法,能夠提高細(xì)胞毒素的治療參數(shù)��,降低全身細(xì)胞毒性的可能性��。ADC依靠高度靶向的腫瘤抗原識(shí)別和有效的內(nèi)吞,在細(xì)胞表面識(shí)別并結(jié)合特定的腫瘤抗原��,然后通過內(nèi)吞作用進(jìn)入腫瘤細(xì)胞��,連接子或抗體在核內(nèi)體或溶酶體內(nèi)被消解,從而釋放細(xì)胞毒素殺傷腫瘤細(xì)胞[2]��,同時(shí)��,能夠起到延長(zhǎng)細(xì)胞毒素的半衰期和降低其劑量限制性毒性的作用[3-5]。
圖1 ADC結(jié)構(gòu)示意圖[1]
2��、ADC的一般生物分析策略
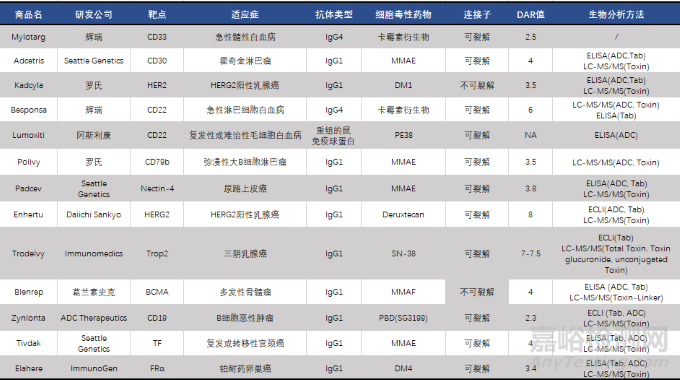
ADC藥物的生物分析數(shù)據(jù)對(duì)于臨床前以及臨床研究的藥物代謝��,毒性評(píng)價(jià)的起著重要的作用。由于ADC藥物結(jié)構(gòu)的復(fù)雜性以及DAR值隨著藥物代謝不斷變化,通常需要對(duì)其幾種主要的存在形式進(jìn)行定量分析��,包括總抗體(DAR≥0)��、偶聯(lián)抗體(DAR≥1)和非偶聯(lián)藥物[6-10]��。基于配體結(jié)合分析(LBA��,Ligand binding assay)和液相色譜-串聯(lián)質(zhì)譜檢測(cè)(LC-MS/MS, Liquid chromatography-tandem mass spectrometry)的生物分析方法已被用于分析各種ADC分析物[9,11]��。其中LBA的分析方法通常用于檢測(cè)總抗體、偶聯(lián)抗體��,LC-MS/MS的分析方法主要用于抗體結(jié)合的細(xì)胞毒素和非結(jié)合細(xì)胞毒素的分析��,F(xiàn)DA已批準(zhǔn)上市的藥物相關(guān)生物分析策略如表2所示��。
表2 FDA批準(zhǔn)上市的ADC藥物匯總
備注:ELISA: Enzyme-Linked Immunosorbnent Assay, 酶聯(lián)免疫吸附法; ECLI: Electrochemiluminescence, 電化學(xué)發(fā)光法; LC-MS/MS: Liquid chromatography-tandem mass spectrometer, 液相色譜-串聯(lián)質(zhì)譜;
ADC: 抗體偶聯(lián)物Tab: Total Antibody, 總抗體;Toxin: 細(xì)胞毒素;
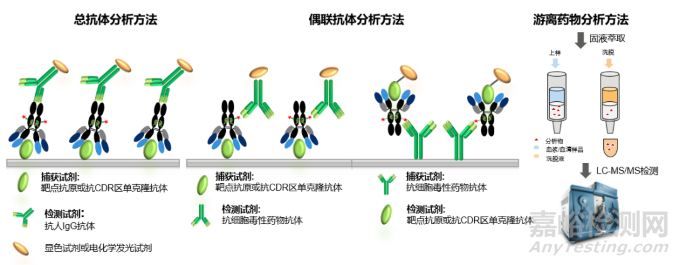
對(duì)于總抗體和偶聯(lián)抗體的測(cè)定��,最為廣泛使用的是ELISA(Enzyme-Linked Immunosorbnent Assay, 酶聯(lián)免疫吸附法)和ECL(Electrochemiluminescence immunoassay , 電化學(xué)發(fā)光免疫測(cè)定),如圖2所示��,對(duì)于總抗體的檢測(cè),通常包被靶點(diǎn)抗原或抗CDR區(qū)(ADC抗體的互補(bǔ)決定區(qū))單克隆抗體方式進(jìn)行捕獲,通過抗ADC藥物的抗體部分進(jìn)行檢測(cè)��。對(duì)于偶聯(lián)抗體的檢測(cè)則有兩種方式��,一種采用的與總抗體檢測(cè)相同的捕獲試劑��,檢測(cè)試劑則采用的是抗細(xì)胞毒素的抗體;另一種采用的捕獲試劑為抗細(xì)胞毒性藥物的抗體��,檢測(cè)試劑則是靶點(diǎn)抗原或抗CDR區(qū)單克隆抗體��。游離細(xì)胞毒素的檢測(cè)是通過蛋白沉淀,液液萃取或固相萃取等小分子生物分析常用的前處理方法提取細(xì)胞毒素后直接進(jìn)行LC-MS/MS的檢測(cè)��。
圖2: ADC生物分析的常用策略
但當(dāng)面臨特異性試劑制備周期過長(zhǎng)或者試劑的特異性��、親和力不滿足測(cè)試需求時(shí)��,LC-MS/MS平臺(tái)則能夠提供一個(gè)速度快��、成本低��、一份樣品分析ADC全部檢測(cè)組分的優(yōu)質(zhì)解決方案��。
3��、LC-MS/MS:一份樣品完成ADC藥物的全組分分析
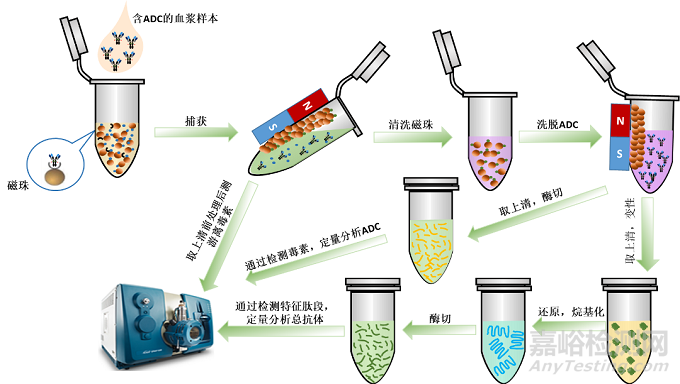
隨著LC-MS/MS方法檢測(cè)抗體等蛋白物質(zhì)的技術(shù)逐漸成熟��,也因其具有良好特異性��,在ADC藥物的生物分析中除了將其應(yīng)用于游離小分子細(xì)胞毒素和偶聯(lián)在抗體上的小分子細(xì)胞毒素的定量分析��,還能在合適的免疫捕獲及酶解處理后��,通過特征肽段對(duì)抗體部分進(jìn)行定量分析��。這就意味著��,我們可以使用同一份樣品在LS-MS/MS平臺(tái)同時(shí)進(jìn)行總抗體,偶聯(lián)抗體��,以及偶聯(lián)藥物和非偶聯(lián)藥物的檢測(cè)��。具體流程如圖3所示,一份樣品經(jīng)過免疫捕獲之后��,得到上清直接用于游離細(xì)胞毒素的檢測(cè),捕獲下來的抗體部分��,分成兩部分,分別進(jìn)行處理��,檢測(cè)偶聯(lián)抗體和總抗體��。
圖3 ADC的LC-MS/MS平臺(tái)分析流
3.1 游離細(xì)胞毒素的藥物分析
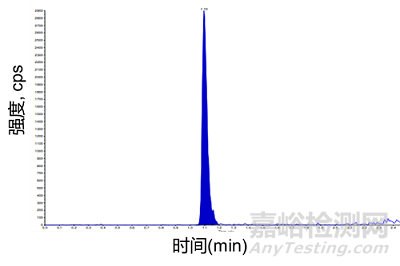
游離細(xì)胞毒素的藥物分析有兩大注意事項(xiàng)��,分別為靈敏度和穩(wěn)定性��。由于ADC的靶向性��,以及臨床前安評(píng)試驗(yàn)都用健康動(dòng)物��,缺少釋放毒素的腫瘤微環(huán)境��,使得血漿中游離的毒素濃度極低,因此��,定量下限需要做到皮克級(jí)��。圖4為含10pg/mL MMAE大鼠血漿樣品的LC-MS/MS色譜圖��。此外��,由于最常用的蛋白沉淀方法處理樣本如果不夠干凈��,可能會(huì)對(duì)檢測(cè)帶來干擾��,可以通過液液萃取或是固相萃取的方法��,使樣本前處理更加干凈��,還能夠濃縮樣本��,提高靈敏度��。
為了得到樣本中真實(shí)的游離毒素濃度��,連接抗體和毒素的連接子的血漿穩(wěn)定性也需要考察。在穩(wěn)定性考察實(shí)驗(yàn)中,不僅要考察毒素本身在生物基質(zhì)中的穩(wěn)定性��,還需考察ADC在樣品儲(chǔ)存過程中以及處理過程中是否釋放游離毒素。
圖4. 含10pg/mL MMAE的大鼠血漿樣品的LC-MS/MS色譜圖
3.2 偶聯(lián)抗體分析
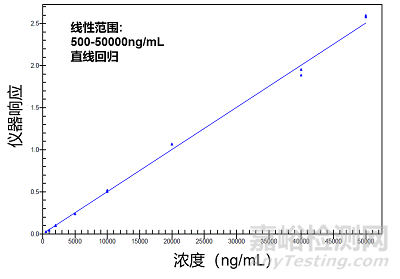
分析偶聯(lián)抗體��,需要針對(duì)不同的連接子選擇不同的解離條件��。如果是采用酶來斷開毒素,酶的種類選擇��,酶切的條件需進(jìn)行細(xì)致的打磨��,以得到盡可能高的酶切回收率��。如圖5所示,通過這種方式��,標(biāo)準(zhǔn)曲線可以在100倍左右的濃度范圍內(nèi)呈現(xiàn)良好的線性回歸。對(duì)于可裂解的連接子��,我們可以選用對(duì)應(yīng)的酶��,將其斷裂��,然后直接測(cè)毒素的濃度即可��。對(duì)于不可裂解的連接子��,我們可以選擇Trypsin將其酶切,然后測(cè)毒素-連接子連接抗體的部分��。
圖5.大鼠血漿中ADC藥物的標(biāo)準(zhǔn)曲線
3.3 總抗體藥物分析
和偶聯(lián)抗體相似��,總抗體的測(cè)定需要經(jīng)過捕獲��、酶切等步驟��,其中每一步在試劑選擇、反應(yīng)時(shí)間��、用量等方面都需要進(jìn)行細(xì)致的探索��,以達(dá)到理想的回收率。
3.4 DAR值測(cè)定
隨著ADC藥物在體內(nèi)代謝��,抗體上小分子藥物的載量會(huì)逐漸減少��,對(duì)應(yīng)著DAR的變化,而DAR的變化趨勢(shì)可以輔助闡釋ADC安全性和有效性��。一個(gè)理想的ADC藥物應(yīng)該是在血液循環(huán)中不釋放細(xì)胞毒素��,到了靶向器官,再釋放��,起到減小生物毒性��,增加藥效的作用��。由于不同DAR的ADC的絕對(duì)分子質(zhì)量不同,高分辨率質(zhì)譜四極桿-飛行時(shí)間分析器(HRMS-Q-TOF, High resolution mass spectrometry quadrupole - Time of Flight analyzer)因其高的分辨率��,特異性和準(zhǔn)確性的特性��,在DAR的分析方面較普通質(zhì)譜例如三重四極桿更有優(yōu)勢(shì),但其在靈敏度方面的表現(xiàn)乏善可陳��,其定量下限往往只能做到ug/mL級(jí)別��。
DAR值測(cè)定分為幾種情況��,可直接檢測(cè)完整ADC分子的DAR,這種情況需要經(jīng)過免疫捕獲��,然后經(jīng)過去糖基化等步驟��,再進(jìn)入高分辨質(zhì)譜進(jìn)行完整分子的測(cè)定,這樣可以直接反映出ADC分子上連接毒素的情況��。而對(duì)于一些毒素只連接在輕鏈或者重鏈上��,且連接情況比較簡(jiǎn)單的情況下,也可以考慮用特定的試劑還原或者酶解��,��,然后測(cè)ADC的亞單位��,這樣做的優(yōu)勢(shì)是可以提高靈敏度。這部分的方案需根據(jù)具體的案例來特殊定制��。
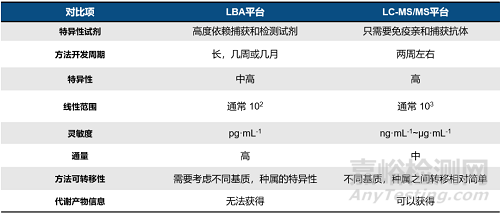
4��、ADC抗體部分檢測(cè)的分析平臺(tái)對(duì)比
綜合來說��, LBA和LC-MS/MS分析ADC藥物的總抗體和偶聯(lián)抗體��,在特異性試劑的需求��,特異性��,靈敏度,通量等方面各有優(yōu)勢(shì)��。如表2所示��,LBA平臺(tái)高度依賴于特異性試劑的質(zhì)量和制備��,那么其制備的質(zhì)量和時(shí)間也影響著方法的特異性和開發(fā)周期��,但是它的優(yōu)勢(shì)在于靈敏度好��,可以達(dá)到皮克級(jí)水平��。
LC-MS/MS平臺(tái)分析抗體是通過特征肽段來進(jìn)行分析的��,不依賴于特異性試劑��,因此方法開發(fā)的周期較LBA平臺(tái)更短��,成本更低��。這一優(yōu)勢(shì)在不斷涌現(xiàn)的雙抗ADC藥物的生物分析中更加突出。同時(shí)��,一份樣品可以進(jìn)行ADC多種形態(tài)的測(cè)定��,定量下限可以做到10ng/mL��,能夠很好的滿足一般檢測(cè)需求��。因此��,可以根據(jù)檢測(cè)需求選擇分析平臺(tái)��。當(dāng)特異性試劑的制備周期過長(zhǎng)��,或特異性試劑的特異性不理想時(shí)��,選擇LC-MS/MS平臺(tái)進(jìn)行ADC藥物的檢測(cè)可以實(shí)現(xiàn)6周快速完成方法的開發(fā)和驗(yàn)證以及樣品分析��,同時(shí)因?yàn)椴恍枰苽涓叱杀镜奶禺愋栽噭?�,方法和分析的費(fèi)用也會(huì)有所降低��。加上LC-MS/MS平臺(tái)可以做到同一份樣品得到所有組分的濃度結(jié)果這一獨(dú)特優(yōu)勢(shì)��,數(shù)據(jù)也具有更好的可比性��。
當(dāng)然,隨著質(zhì)譜技術(shù)的不斷發(fā)展��,LC-MS/MS分析的靈敏度在未來還會(huì)有更多的進(jìn)步空間��,來滿足更多的應(yīng)用場(chǎng)景。
表2 LBA和LC-MS/MS平臺(tái)分析抗體組分的對(duì)比
參考文獻(xiàn):
[1] 抗體偶聯(lián)藥物在胃癌治療中的研究與思考. 肖禮海, 夏鋼, 王堅(jiān)成等, 生物醫(yī)學(xué)轉(zhuǎn)化[J] 2022��,3(1).
[2] Lu J; Jiang, F; Lu, A.; Zhang, G. Linkers Having a Crucial Role in Antibody–Drug Conjugates. Int. J. Mol. Sci. 2016, 17(4), 561.
[3]. Chari, R.V.J. Targeted cancer therapy: Conferring specificity to cytotoxic drugs. Acc. Chem. Res. 2008, 41, 98–107.
[4] Senter, P.D. Potent antibody drug conjugates for cancer therapy. Curr. Opin. Chem. Biol. 2009, 13, 235–244.
[5] Senter, P.D. Potent antibody drug conjugates for cancer therapy. Curr. Opin. Chem. Biol. 2009, 13, 235–244.
[6] Stephan JP, Chan P, Lee C et al. Anti-CD22-MCC-DM1 and MC-MMAF conjugates: impact of assay format on pharmacokinetic parameters determination. Bioconjug. Chem. 19(8), 1673–1683 (2008)
[7] Buckwalter M, Dowell JA, Korth-Bradley J et al. Pharmacokinetics of gemtuzumab ozogamicin as a signal-agent treatment of pediatric patients with refractory or released acute myeloid leukemia. J. Clin. Pharmacol. 44(8), 873-880(2004)
[8] Hussain A, Gorovits B, Leal M et al. Pharmacokinetics of immunoconjugate anti-cancer agent CMD-193 in rats: ligand binding assay based approach to determine in vivo immunoconjugate stability. Bioanalysis 6(1), 21-32(2013)
[9] Kaur S, Xu K, Saad Om, Dere RC et al. Bioanalytical assay strategies for the development of antibody drug conjugate biotherapeutics. Bioanalysis 5(2), 201–226 (2013)
[10] Alley SC, Benjamin DR, Jeffrey SC et al. Contribution of linker stability to the activities of anticancer immunoconjugate Bioconjug. Chem. 19(3), 759-765(2008).
[11] Gorovits B, Alley S, Bilic S et al. Bioanalysis of antibody–drug conjugates. AAPS ADC working group position paper. Bioanalysis 5(9), 997–1006 (2013).