今日頭條
杭州壹瑞Kv1.3抑制劑獲批臨床�����。杭州壹瑞醫(yī)藥自研創(chuàng)新藥YR-001獲FDA批準(zhǔn)開展臨床試驗(yàn)(NCT05718921)��。YR-001是一款高選擇性鉀離子通道Kv1.3小分子抑制劑���,已在數(shù)種自身免疫性疾病的臨床前模型中顯示出治療潛力�����。去年6月,禮來從D. E. Shaw Research (DESRES)公司引進(jìn)一款臨床早期的小分子Kv1.3抑制劑DES-7114的全球開發(fā)權(quán)益���,擬開發(fā)用于潰瘍性結(jié)腸炎、克羅恩病和特應(yīng)性皮
炎等自身免疫性疾病的治療�����。
國內(nèi)藥訊
1.瑞科新佐劑帶狀皰疹疫苗上I期臨床���。瑞科生物開發(fā)的新佐劑重組帶狀皰疹疫苗REC610在I期臨床中完成首批受試者入組��。臨床前研究顯示���,REC610具有較好的免疫原性,可誘導(dǎo)產(chǎn)生高水平的gE抗原特異性CD4+T細(xì)胞反應(yīng)和IgG抗體�����,其免疫反應(yīng)非劣于對照疫苗Shingrix®(葛蘭素史克)�����。瑞科生物計(jì)劃評價(jià)REC610在40歲及以上健康成人受試者中的安全性和免疫原性�����,Shingrix®為陽性對照藥物���。
2.亙喜雙靶點(diǎn)CAR-T國內(nèi)獲批臨床�����。亙喜生物靶向BCMA/CD19雙靶點(diǎn)自體CAR-T產(chǎn)品GC012F獲國家藥監(jiān)局批準(zhǔn)�����,擬開展Ⅰ/Ⅱ期臨床評估用于治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(RRMM)的安全性與有效性���。值得一提的是,本月初���,該新藥已獲得FDA的臨床批件���。公布于ASH 2022年會上的中國Ⅰ期臨床長期隨訪數(shù)據(jù)顯示,GC012F達(dá)到100%的總體應(yīng)答率(ORR)��,100%受試者達(dá)到微小殘留病灶(MRD)陰性�����。
3.必貝特PPAR激動劑獲批PBC臨床��。必貝特醫(yī)藥1類化藥BEBT-503膠囊獲國家藥監(jiān)局批準(zhǔn),即將開展用于治療原發(fā)性膽汁性膽管炎(PBC)的II期臨床試驗(yàn)���。BEBT-503是一款高活性泛PPAR激動劑�����,此前已獲批開展治療2型糖尿病合并非酒精性脂肪肝病的II期臨床試驗(yàn)��。來自澳大利亞I期臨床結(jié)果顯示��,BEBT-503具有良好的安全性���,有望為原發(fā)性膽汁性膽管炎尤其是對熊去氧膽酸應(yīng)答不佳或無應(yīng)答的PBC患者提供新的治療選擇。
4.億騰景昂CDK7抑制劑報(bào)IND���。億騰景昂1類新藥EOC237膠囊的臨床試驗(yàn)申請獲CDE受理。這是億騰景昂首個自主研發(fā)的項(xiàng)目��,是一款高選擇性CDK7抑制劑�����,擬開發(fā)用于晚期實(shí)體瘤���。CDK7是細(xì)胞周期調(diào)控和轉(zhuǎn)錄調(diào)節(jié)的關(guān)鍵靶點(diǎn)�����,與乳腺癌�����、前列腺癌���、小細(xì)胞肺癌��、卵巢癌�����、胰腺癌���、結(jié)直腸癌、胃癌���、神經(jīng)母細(xì)胞瘤及白血病等多種腫瘤的發(fā)生��、進(jìn)展及耐藥密切相關(guān)��。
5.合肥天港PVRIG單抗報(bào)IND��。合肥天港免疫1類生物制品NM1F注射液的臨床試驗(yàn)申請獲CDE受理��。NM1F是一款基于IgG1亞型的PVRIG單抗�����。臨床前研究顯示���,該抗體具有更長的半衰期和高耐受劑量�����。同時(shí)���,體內(nèi)藥效實(shí)驗(yàn)顯示該抗體單用就具有顯著的抗癌功能,與抗PD-1單抗聯(lián)用�����,能夠進(jìn)一步增強(qiáng)抗癌免疫力��。NM1F為國內(nèi)繼君實(shí)生物之后第2款PVRIG單抗�����。
6.藥明生物2022年總收入增長48.4%���。2月13日�����,藥明生物公布2022年業(yè)績預(yù)告�����。根據(jù)初步評估�����,公司年度所收益較去年同期增長約48.4%��;利潤及歸屬于公司權(quán)益股東的利潤相比于去年同期分別增長約29%及約30%���;經(jīng)調(diào)整股份為基礎(chǔ)的薪酬開支、外匯損益及股權(quán)投資損益后��,非國際財(cái)務(wù)報(bào)告準(zhǔn)則經(jīng)調(diào)整純利將增長約47%��。
國際藥訊
1.阿柏西普再獲FDA批準(zhǔn)新適應(yīng)癥。再生元眼科明星產(chǎn)品VEGF抑制劑Eylea(aflibercept)獲FDA批準(zhǔn)用于治療早產(chǎn)兒視網(wǎng)膜病變��。Aflibercept通過阻斷參與血管生成的生長因子VEGF-A與胎盤生長因子(PLGF)���,進(jìn)而阻斷新生血管生成�����,并降低眼內(nèi)血管通透性�����。此前���,Eylea已被批準(zhǔn)用于治療濕性年齡相關(guān)性黃斑變性(AMD)、視網(wǎng)膜靜脈阻塞(RVO)后黃斑水腫���、糖尿病性黃斑水腫(DME)和糖尿病視網(wǎng)膜病變(DR)�����。
2.Ironwood公司便秘藥獲優(yōu)先審評資格��。Ironwood公司鳥苷酸環(huán)化酶-C(GC-C)激動劑Linzess(linaclotide)的補(bǔ)充新藥申請(sNDA)獲FDA受理���,用于治療6-17歲兒童功能性便秘(FC)。FDA同時(shí)授予其優(yōu)先審評資格�����,預(yù)計(jì)今年6月14日前完成審查��。在Ⅲ期臨床中�����,linaclotide較安慰劑顯著改善患者的自發(fā)腸道運(yùn)動頻率(SBMs/周)���,該治療組患者12周時(shí)自發(fā)腸道運(yùn)動頻率從基線起最小二乘均值改變(2.220)與安慰劑組(1.050)相較超過2倍(p<0.0001)���。
3.溶瘤病毒聯(lián)合治療三陰性乳腺癌臨床積極。安進(jìn)基于改良的1型單純皰疹病毒(HSV-1)的溶瘤病毒療法talimogene laherparepvec(T-VEC)��,聯(lián)合標(biāo)準(zhǔn)化療用于三陰性乳腺癌患者術(shù)前治療的Ⅱ期臨床最新結(jié)果發(fā)布在 Nature Medicine期刊上��。37例患者在手術(shù)前接受T-VEC溶瘤病毒聯(lián)合標(biāo)準(zhǔn)化療�����。治療后使用殘余腫瘤負(fù)荷(RCB)來評估治療效果,45.9%的患者(17/37)在治療后獲得完全緩解���,治療后兩年內(nèi)���,89%的患者(33/37)沒有疾病復(fù)發(fā)。
4.輝瑞/BioNTech帶狀皰疹疫苗上I/II期臨床�����。輝瑞與BioNTech公司聯(lián)合開發(fā)的帶狀皰疹mRNA候選疫苗啟動一項(xiàng)I/II期臨床(NCT05703607)��。該項(xiàng)研究將招募900例50歲至69歲的健康志愿者��。I期階段旨在為II期研究選擇最佳的mRNA疫苗候選物��、劑量水平��、接種時(shí)間以及疫苗配方���。該研究的陽性對照組為GSK的Shingrix���,該疫苗2022年全球銷售額達(dá)29.58億美元。
5.曲拉西利一線結(jié)直腸癌III期臨床失敗。G1 Therapeutics公布CDK 4/6抑制劑曲拉西利+FOLFOXIRI+貝伐珠單抗三聯(lián)療法治療轉(zhuǎn)移性結(jié)直腸癌(CRC)的III期PRESERVE 1試驗(yàn)關(guān)鍵結(jié)果��。與安慰劑相比�����,trilaciclib顯著降低患者嚴(yán)重中性粒細(xì)胞減少癥的發(fā)生率(1%vs20%)和嚴(yán)重中性粒細(xì)胞減少癥平均持續(xù)時(shí)間(0.1天vs1.3天)��。不過早期抗腫瘤療效數(shù)據(jù)顯示安慰劑組的客觀緩解率更高(61%vs50%)�����。鑒于安慰劑的療效優(yōu)于trilaciclib�����,該公司決定終止該項(xiàng)試驗(yàn)���。
6.賽諾菲全球研發(fā)主管辭職。賽諾菲宣布公司全球研發(fā)主管John Reed博士將辭職���,首席醫(yī)療官和全球開發(fā)負(fù)責(zé)人Dietmar Berger將臨時(shí)接替John���,管理研發(fā)團(tuán)隊(duì)。自2018年加入賽諾菲以來,John為公司的研發(fā)轉(zhuǎn)型奠定了基礎(chǔ)���。他幫助賽諾菲重新定位了新療法的發(fā)現(xiàn)和開發(fā)��,并對治療領(lǐng)域做了嚴(yán)格的優(yōu)先排序和資源重新分配���。2023年,賽諾菲將推出兩款首創(chuàng)或同類最佳藥物���,以滿足血友病和呼吸道合胞病毒的主要需求��。
醫(yī)藥熱點(diǎn)
1.遼寧向省屬醫(yī)院預(yù)撥補(bǔ)助資金10.4億元��。近日��,遼寧省財(cái)政部門預(yù)撥2023年省屬醫(yī)院取消藥品加成��、重點(diǎn)?�?平ㄔO(shè)等補(bǔ)助資金���,以及一季度基本公共衛(wèi)生服務(wù)和基本藥物制度補(bǔ)助資金10.4億元,幫助公立醫(yī)院和基層醫(yī)療衛(wèi)生機(jī)構(gòu)及時(shí)緩解階段性運(yùn)行壓力���。此外��,遼寧采取年初先行預(yù)撥�����、年底結(jié)算的方式�����,撥付省財(cái)政專項(xiàng)獎補(bǔ)資金1億元��,激勵縣級公立醫(yī)院和基層醫(yī)療衛(wèi)生機(jī)構(gòu)有效保障醫(yī)務(wù)人員工資薪金�����。
2.2027年全球藥品市場預(yù)測總規(guī)模1.9萬億美元�����。2月9日���,發(fā)表在Nature Reviews Drug Discovery上的IQVIA年度《The Global Use of Medicines 2023》報(bào)告顯示,全球藥品市場規(guī)模未來5年將以每年3%–6%的速度增長���,2027年預(yù)計(jì)將達(dá)到1.9萬億美元���。從不同治療領(lǐng)域來看��,預(yù)測2027年銷售收入“名列前茅”的領(lǐng)域依次是腫瘤��、免疫疾病�����、糖尿病和心血管疾病�����。
3.北京最大制藥CDMO基地正式投產(chǎn)��。2月14日�����,北京昭衍生物宣布��,其位于北京經(jīng)濟(jì)技術(shù)開發(fā)區(qū)的“北京亦昭生物醫(yī)藥中試研發(fā)生產(chǎn)基地”正式竣工投產(chǎn)��。據(jù)悉��,該項(xiàng)目占地120余畝��,預(yù)計(jì)總投資將超30億元�����,是北京目前最大的制藥CDMO服務(wù)基地��。該項(xiàng)目分三期實(shí)施���,其中一期建筑面積14.25萬平方米�����,規(guī)劃有17棟生產(chǎn)設(shè)施及輔助設(shè)施,已于2023年2月竣工投產(chǎn)��,一期首批10條2000L規(guī)模原液生產(chǎn)線已投入使用�����。
評審動態(tài)
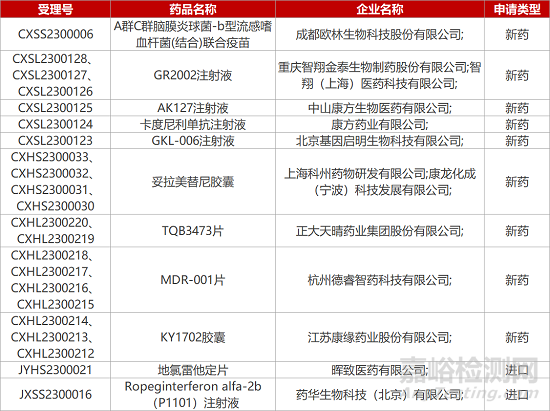
1. CDE新藥受理情況(02月14日)
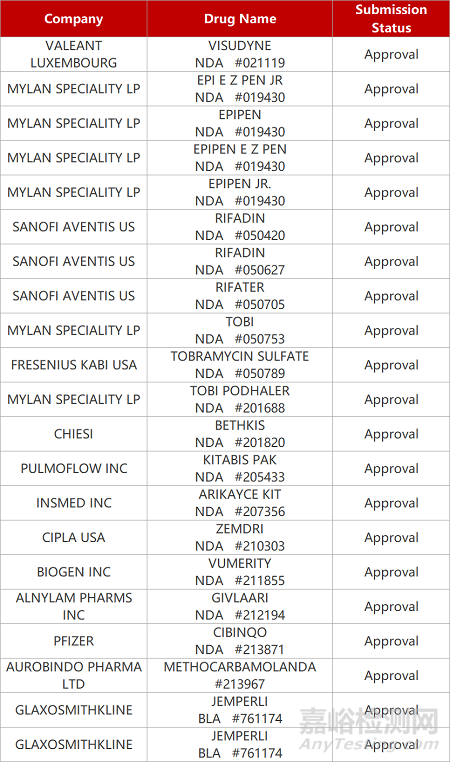
2. FDA新藥獲批情況(北美02月12日)