隨著法規(guī) MDR(2017/745) 的生效����,新的標(biāo)簽要求也開始實施。與 MDD指令( 93/42/EEC )相比��, MDR的標(biāo)簽需要更多信息�����。MDR 法規(guī)在標(biāo)簽方面引入了兩個重要問題:
1. 生產(chǎn)商必須在自己的公司網(wǎng)站上公布標(biāo)簽和說明書
2. 引入了醫(yī)療器械唯一標(biāo)識(UDI)系統(tǒng)
醫(yī)療器械標(biāo)簽標(biāo)識盡管簡單��,但因為及其重要��,也最直觀,也是最容易被監(jiān)管到的錯誤事項��,因此��,了解并正常使用符合MDR法規(guī)的標(biāo)簽標(biāo)識����,對醫(yī)療器械CE認(rèn)證企業(yè)來說非常重要��。
一、MDR 附錄I中第III章23.2對于產(chǎn)品標(biāo)簽要求進(jìn)行了規(guī)定:
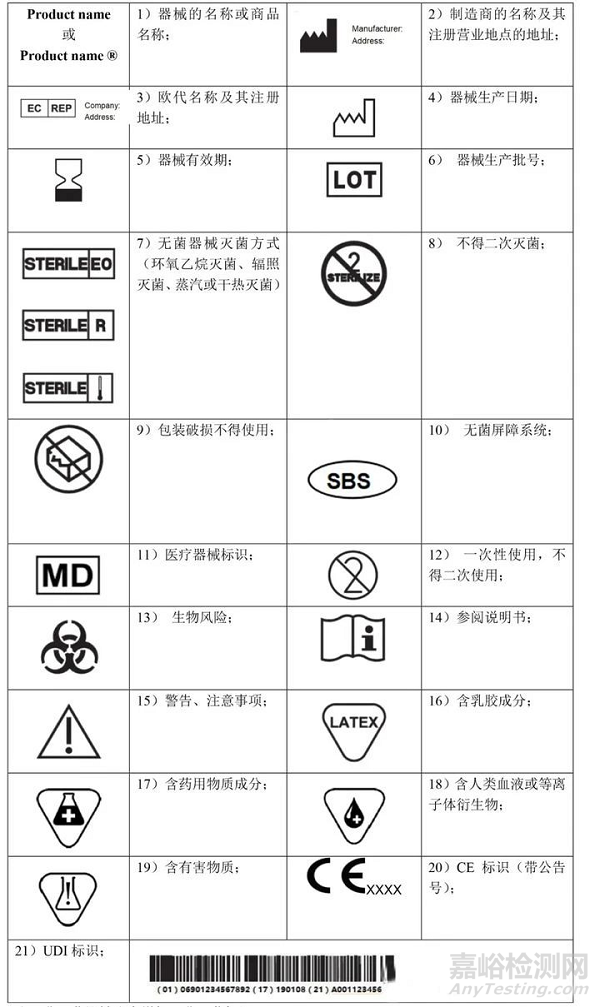
1. 器械的名稱或商品名稱��;
2. 使用者識別器械所必需的詳細(xì)信息、包裝內(nèi)容以及對于使用者不明顯的器械預(yù)期用途�����;
3. 制造商的名稱、注冊商號商標(biāo)及其注冊營業(yè)地點(diǎn)的地址;
4. 授權(quán)代表的姓名和注冊營業(yè)地點(diǎn)地址(若制造商在歐盟以外有其注冊營業(yè)地點(diǎn))
5. 若沒有指明可安全使用的日期����,則指明制造日期。若日期清晰可辨��,制造日期可作為批號或序列號的一部分��。
6. 指明適用的任何特殊儲存和/或處理條件��;
7. 若以無菌方式提供器械��,還應(yīng)指示其無菌狀態(tài)和滅菌方法����;
8. 需要立即引起器械使用者和任何其他人的注意�����、需要采取的警戒或預(yù)防措施��。
9. 若器械用于一次性使用,則相應(yīng)指明�����。制造商的一次性使用指示應(yīng)在整個歐盟內(nèi)保持一致;
10. UDI 載體應(yīng)添加在該器械標(biāo)簽和所有更大包裝上�����;
11. 標(biāo)簽應(yīng)明顯��、清晰和不可磨滅地添加在器械或其無菌包裝上��?����?紤]到器械性質(zhì),無法或不適合將標(biāo)簽添加到器械上時�����,應(yīng)將 CE 標(biāo)識添加在包裝上�����。CE 標(biāo)識也應(yīng)加貼在有使用說明和任何銷售包裝中����;
12. 應(yīng)采用器械上市國(同時也是成員國)指定的歐盟官方語言編寫,也可以采用預(yù)銷往國的當(dāng)?shù)卣Z言����;
13. 標(biāo)簽上所需的信息應(yīng)在器械本身上提供��。若不可行或不適當(dāng)�����,則某些或所有信息可顯示在各單元的包裝上和/或多個器械的包裝上。
二����、對于無菌產(chǎn)品,其獨(dú)有的要求也在MDR 附錄I中第III章23.3中有所規(guī)定:
1. 識別無菌包裝的指示
2. 器械處于無菌狀態(tài)的聲明
3. 滅菌方法
4. 設(shè)備描述
5. 注明“專用于臨床研究”��。(如適用)
6. 注明“定制設(shè)備”。(如適用)
7. 制造的月份和年份
8. 安全使用或植入設(shè)備的期限(至少包含年份和月份)
9. 在使用說明中檢查的信息��,如果無菌包裝在使用前損壞或打開��,該怎么辦��。
三����、MDR標(biāo)簽要求會遇到的問題和注意事項
嘗試遵守歐盟 MDR 標(biāo)簽要求時可能會遇到兩個問題:
1.確保涵蓋所有必要的符號和信息
2.標(biāo)簽的大小
由于需要更多的符號和數(shù)據(jù),最大的挑戰(zhàn)將是如何將它們?nèi)糠旁跇?biāo)簽上����。在標(biāo)簽設(shè)計過程中,請記住以下幾點(diǎn):
標(biāo)簽和說明的媒介、格式����、內(nèi)容、易讀性和位置必須與預(yù)期用戶的技術(shù)知識����、經(jīng)驗、教育或培訓(xùn)相匹配
此外�����,使用說明必須以預(yù)期用戶易于理解的術(shù)語編寫��,并在適當(dāng)?shù)那闆r下補(bǔ)充附圖和圖表�����。
標(biāo)簽可以以人類可讀的格式提供,并且可以用機(jī)器可讀的信息來補(bǔ)充����。
四、常用器械標(biāo)識一覽
A.常用無源器械標(biāo)識
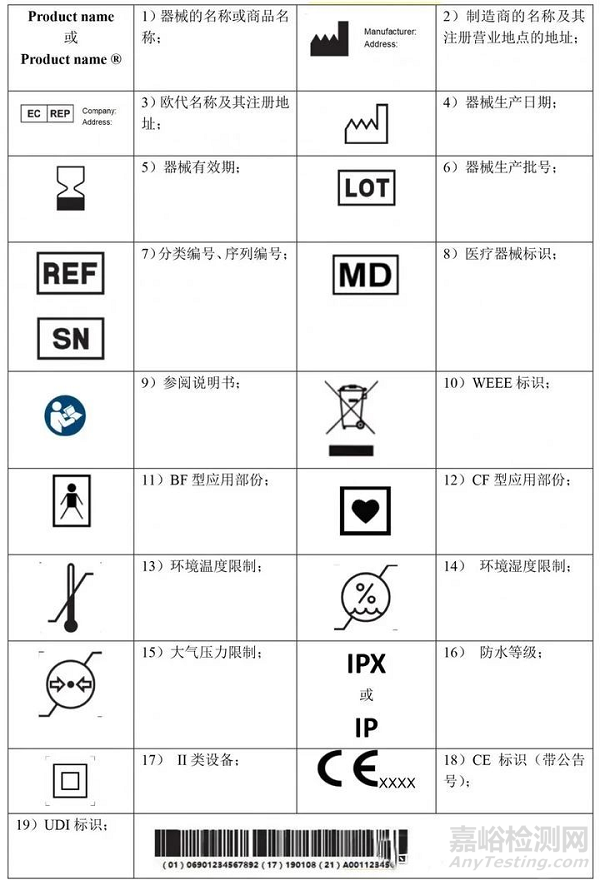
B.常用有源器械標(biāo)識
五��、引申知識學(xué)習(xí)
常用的標(biāo)識就是這些��,但是醫(yī)療器械的標(biāo)識涉及范圍很廣,無法一一列舉��,可根據(jù)產(chǎn)品專標(biāo)或其他標(biāo)準(zhǔn)來涉及產(chǎn)品標(biāo)簽。
更多的標(biāo)識要求可以參考以下標(biāo)準(zhǔn):
ISO 15223-1:2021 Medical devices — Symbols to be used with information to be supplied by the manufacturer — Part 1: General requirements
ISO 20417 :2021 Medical devices — Information to be supplied by the manufacturer
ISO 7000 :2019 Graphical symbols for use on equipment — Index and synopsis
IEC 60417 :2020 Graphical symbols for use on equipment
IEC TR 60878 :2022 Graphical symbols for electrical equipment in medical practice