近日,歐洲藥典(Ph. Eur.)在藥典論壇(Pharmeuropa)35.1中公布了關(guān)于兔熱原檢查(Rabbit Pyrogen Test,RPT)替代策略相關(guān)的59篇草案�����,包括新增通則5.1.13.【熱原性(Pyrogenicity)】以及修訂其他58個(gè)文本�����,這些文本涵蓋了多種產(chǎn)品�����,包括人用疫苗、血液制品�����、抗生素、放射性藥物等�����,公開(kāi)征求意見(jiàn)�����,征求意見(jiàn)截止日期為2023年3月31日�����。
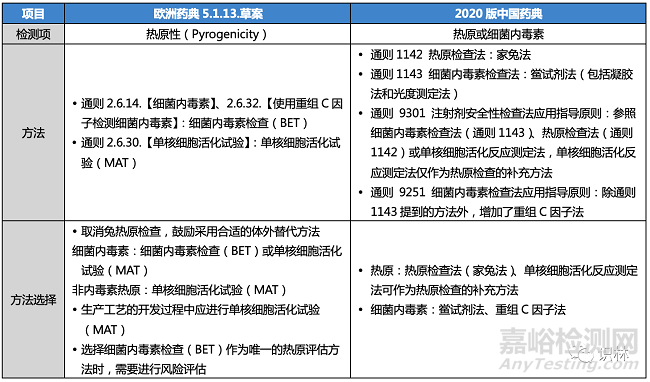
歐洲藥典關(guān)于熱原�����、細(xì)菌內(nèi)毒素檢查的策略
歐洲藥典通則2.6.8.【熱原(Pyrogens)】于1986年首次發(fā)表�����,兔熱原檢查(RPT)廣泛用于檢測(cè)致熱物質(zhì),通過(guò)將一定劑量的供試品靜脈注入家兔體內(nèi)�����,在規(guī)定的時(shí)間內(nèi)觀察家兔體溫升高的情況,以判定供試品中所含熱原的限度是否符合規(guī)定�����。大多數(shù)熱原是細(xì)菌內(nèi)毒素�����,可以采用歐洲藥典通則2.6.14.【細(xì)菌內(nèi)毒素】和2.6.32.【使用重組C因子檢測(cè)細(xì)菌內(nèi)毒素】中描述的細(xì)菌內(nèi)毒素檢查(Bacterial Endotoxin Test�����,BET)來(lái)檢測(cè)�����。但細(xì)菌內(nèi)毒素檢查(BET)不能檢測(cè)非內(nèi)毒素?zé)嵩?009年通則2.6.30.【單核細(xì)胞活化試驗(yàn)(Monocyte-activation Test�����,MAT)】引入歐洲藥典�����,提供了一種體外替代兔熱原檢查(RPT)并能夠同時(shí)檢測(cè)內(nèi)毒素和非內(nèi)毒素?zé)嵩姆椒ā?/span>
2021年6月歐洲藥典委員會(huì)提出了一項(xiàng)戰(zhàn)略計(jì)劃�����,該戰(zhàn)略致力于替代、減少和優(yōu)化(3R)動(dòng)物實(shí)驗(yàn),并計(jì)劃在未來(lái)五年內(nèi)完全替代并最終取消兔熱原檢查(RPT)。2022年9月發(fā)表的移除或替換兔熱原檢查的策略文件中�����,公布了一系列新的熱原性(Pyrogenicity)檢測(cè)策略:
引入新的通則5.1.13.【熱原性(Pyrogenicity)】,以指導(dǎo)企業(yè)選擇和實(shí)施適當(dāng)?shù)臋z查方法:細(xì)菌內(nèi)毒素檢查(BET)或單核細(xì)胞活化試驗(yàn)(MAT)�����。新增的通則將涵蓋風(fēng)險(xiǎn)評(píng)估�����,以支持使用細(xì)菌內(nèi)毒素檢查(BET)作為唯一的熱原檢查方法,同時(shí)考慮可能導(dǎo)致BET未檢測(cè)到熱原的因素�����。
修訂涉及兔熱原檢查(RPT)的歐洲藥典文本�����,包括:總論藥用物質(zhì)(2034);藥用物質(zhì)各論�����;劑型各論注射用制劑(0520)�����、膀胱內(nèi)制劑(2811)、用于沖洗的制劑(1116)和用于器官保存的溶液(1264)�����;各論人用疫苗(0153)�����;各論人用動(dòng)物免疫血清(0084)�����;以及與血液制品�����、大容量注射劑、容器�����、放射性藥物相關(guān)的各論和通則等。修訂的文本引入了新通則“熱原性(Pyrogenicity)”�����,取代了“細(xì)菌內(nèi)毒素(Bacterial endotoxins)”和“熱原(Pyrogens)”的要求�����,并提供了如何選擇和實(shí)施細(xì)菌內(nèi)毒素檢查(BET)或單核細(xì)胞活化試驗(yàn)(MAT)的具體指導(dǎo)。
修訂通則2.6.30.【單核細(xì)胞活化試驗(yàn)】和5.1.10. 【細(xì)菌內(nèi)毒素檢查使用指南】�����,并將信息提取和納入到新的通則5.1.13.中�����。主要的變化包括靈敏度的描述�����、內(nèi)毒素標(biāo)準(zhǔn)曲線的可靠性標(biāo)準(zhǔn)以及含量可接受標(biāo)準(zhǔn)等�����。
新通則5.1.13. 草案的主要內(nèi)容
新通則5.1.13. 草案目前已經(jīng)發(fā)表在藥典論壇35.1中�����,該草案旨在從歐洲藥典中完全取消兔熱原檢查,并取消通則2.6.8.【熱原(Pyrogens)】�����,鼓勵(lì)采用合適的體外替代方法進(jìn)行檢測(cè)。主要的內(nèi)容包括:
來(lái)自革蘭氏陰性菌的內(nèi)毒素是受污染藥品引起熱原反應(yīng)的最常見(jiàn)原因�����,通常使用細(xì)菌內(nèi)毒素檢查(BET)來(lái)檢測(cè)內(nèi)毒素�����。但非內(nèi)毒素?zé)嵩ㄈ鐏?lái)自革蘭氏陽(yáng)性菌�����、真菌�����、病毒和顆粒)的檢測(cè)需要進(jìn)行單核細(xì)胞活化試驗(yàn)(MAT)�����。單核細(xì)胞活化試驗(yàn)?zāi)軌驒z測(cè)內(nèi)毒素和非內(nèi)毒素?zé)嵩?/span>
在生產(chǎn)工藝的開(kāi)發(fā)過(guò)程中應(yīng)進(jìn)行單核細(xì)胞活化試驗(yàn)(MAT),以排除非內(nèi)毒素?zé)嵩拇嬖?����,生產(chǎn)工藝中進(jìn)行的任何可能改變產(chǎn)品熱原性的變更�����,建議重復(fù)單核細(xì)胞活化試驗(yàn)�����。如果不能排除非內(nèi)毒素?zé)嵩拇嬖?����,則必須對(duì)所有注射劑產(chǎn)品進(jìn)行單核細(xì)胞活化試驗(yàn)。
通則2.6.14.【細(xì)菌內(nèi)毒素】�����、2.6.32.【使用重組C因子檢測(cè)細(xì)菌內(nèi)毒素】和2.6.30.【單核細(xì)胞活化試驗(yàn)】中所描述的方法已經(jīng)過(guò)驗(yàn)證�����,不需要重新驗(yàn)證�����,除非用于特定分析環(huán)境中的特定物質(zhì)或產(chǎn)品。
如果選擇細(xì)菌內(nèi)毒素檢查(BET)作為唯一的熱原評(píng)估方法�����,則需要進(jìn)行風(fēng)險(xiǎn)評(píng)估。如果重要的工藝參數(shù)發(fā)生變更�����,則應(yīng)重新進(jìn)行風(fēng)險(xiǎn)評(píng)估�����,因?yàn)椴荒芘懦莾?nèi)毒素?zé)嵩臐撛谖廴?����。進(jìn)行風(fēng)險(xiǎn)評(píng)估時(shí)應(yīng)考慮的因素包括:生產(chǎn)工藝(化學(xué)合成、發(fā)酵�����、生物技術(shù)方法)、生物負(fù)荷(微生物污染水平�����,Bioburden)�����、下游工藝的去除能力和安全性(如目標(biāo)人群和給藥途徑)等�����。
為支持風(fēng)險(xiǎn)評(píng)估,建議使用相同的3個(gè)批次進(jìn)行單核細(xì)胞活化試驗(yàn)(MAT)和細(xì)菌內(nèi)毒素檢查(BET)的驗(yàn)證試驗(yàn)�����。
歐洲藥典新通則5.1.13. 草案與2020版中國(guó)藥典的區(qū)別