一、概述
工藝信息表是監(jiān)管機構對已上市產(chǎn)品實施上市后監(jiān)管的主要依據(jù)���,隨著藥品批準文號一并核發(fā)���,其重要性不言而喻。本文以筆者多年的注冊經(jīng)驗來復盤化藥制劑生產(chǎn)工藝信息表的撰寫規(guī)范�����,對注冊過程中常出現(xiàn)的問題進行匯總并加以批注���,以期對各位同仁有所啟示和幫助���,助力大家更好更規(guī)范地撰寫化藥制劑生產(chǎn)工藝信息表。
二、化藥制劑生產(chǎn)工藝信息表復盤

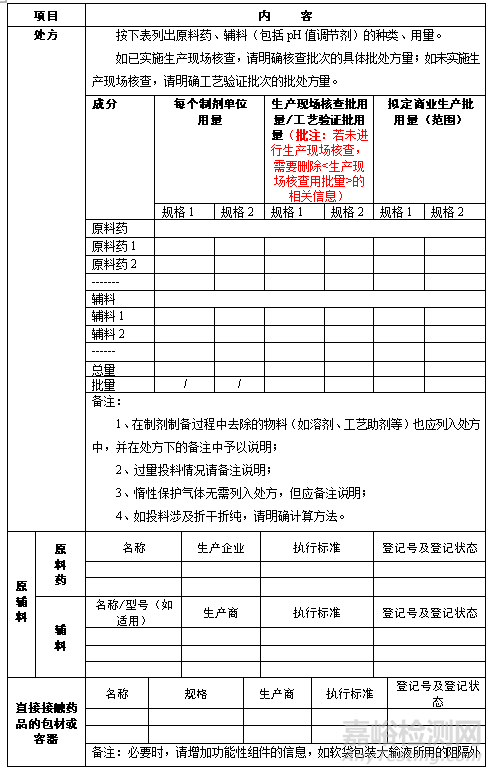

注:
1)列表明確關鍵工藝步驟及工藝參數(shù)的信息�����,作為生產(chǎn)工藝信息表附件���。
批注:此部分內(nèi)容需結合首輪申報資料及發(fā)補完善要求進行撰寫���,同時要與申報資料保持一致��,不可隨意修改�����。
2)原輔料的內(nèi)控標準和分析方法作為生產(chǎn)工藝信息表附件�����。
對于原料藥的內(nèi)控標準�����,請按現(xiàn)行版中國藥典格式規(guī)范整理���。如原料藥關聯(lián)申報或已有文號�����,請明確本文件中的內(nèi)控標準與原料藥注冊標準的異同�����,如有差異���,請列表對比說明�����,對比內(nèi)容應包括項目��、方法(類型)及限度��,突出顯示不一致之處���,并給出不一致項目(包括分析方法及增訂項目)的規(guī)范文字描述。
對于輔料的內(nèi)控標準���,如執(zhí)行現(xiàn)行版中國藥典標準�����,僅需在表格的執(zhí)行標準中說明即可���,無需列出詳細內(nèi)容��;如與現(xiàn)行版中國藥典標準不完全一致��,請列表對比輔料內(nèi)控標準與現(xiàn)行版中國藥典標準的異同��,對比內(nèi)容應包括項目��、方法(類型)及限度��,突出顯示不一致之處,對于不同于現(xiàn)行版中國藥典標準的項目(包括分析方法及增訂項目)���,請按現(xiàn)行版中國藥典格式提供規(guī)范的文字描述�����。
對于進口制劑��,所用原料藥(如不在中國市場單獨銷售)的質量標準及分析方法的格式可與申報資料保持一致��。所用輔料的質量標準如與現(xiàn)行版USP/EP等一致�����,僅需在表格的執(zhí)行標準中說明即可�����,無需提供標準全文���;如不完全一致�����,請列表對比異同���,對比內(nèi)容應包括項目、方法(類型)及限度���,突出顯示不一致之處�����,并給出不一致項目(包括分析方法及增訂項目)的規(guī)范文字描述��。
批注:原輔包內(nèi)控標準書寫示例如下所示:
示例1
|
原輔包名稱
|
內(nèi)控標準
|
|
原料藥
|
與原料藥注冊標準
|
|
輔料A
|
執(zhí)行現(xiàn)行版中國藥典
|
|
輔料B
|
執(zhí)行現(xiàn)行版中國藥典
|
|
輔料C
|
執(zhí)行現(xiàn)行版中國藥典
|
示例1中所示的是處方中所用原料藥與輔料內(nèi)控標準均與注冊標準或中國藥典一致的情況�����,此種情況下�����,可以只列上述表格就行���,無需再進一步贅述其詳細的內(nèi)控標準�����。這樣生產(chǎn)工藝信息表就會更加簡潔明了��。
示例2
|
原輔包名稱
|
內(nèi)控標準
|
|
原料藥
|
與原料藥注冊標準不完全一致
|
|
輔料A
|
與現(xiàn)行版中國藥典不完全一致
|
|
輔料B
|
與現(xiàn)行版中國藥典不完全一致
|
|
輔料C
|
與現(xiàn)行版中國藥典不完全一致
|
示例2中所示的是處方中所用原料藥與輔料內(nèi)控標準與注冊標準或中國藥典不完全一致的情況���,此種情況下���,只需詳細描述不一致項目的內(nèi)控標準即可��,按照現(xiàn)行版中國藥典的格式進行規(guī)范撰寫���。
示例3(針對進口制劑)
|
原輔包名稱
|
內(nèi)控標準
|
|
原料藥
|
與原料藥注冊標準一致或詳細規(guī)范描述原料藥內(nèi)控標準
|
|
輔料A
|
執(zhí)行USP或EP
|
|
輔料B
|
執(zhí)行USP或EP
|
|
輔料C
|
執(zhí)行USP或EP
|
對于進口制劑���,所用原料藥如不在中國市場單獨銷售,需詳細規(guī)范描述原料藥的內(nèi)控標準�����;如原料藥與制劑關聯(lián)審評��,且關聯(lián)審評已通過�����,此時原料藥內(nèi)控標準執(zhí)行注冊標準的話�����,僅需在表格的內(nèi)控標準中說明即可��,無需提供標準全文��。
對于進口制劑�����,所用輔料的質量標準如與現(xiàn)行版USP/EP等一致,僅需在表格的內(nèi)控標準中說明即可�����,無需提供標準全文���;如不完全一致��,需列表對比異同���,并給出不一致項目(包括分析方法及增訂項目)的規(guī)范文字描述。
3)關鍵中間產(chǎn)品(如適用)的質量標準和分析方法作為生產(chǎn)工藝信息表附件�����。
批注:對產(chǎn)品質量有顯著影響的中間產(chǎn)品需制定合理的中間體內(nèi)控標準�����,并以中國藥典格式詳細描述中間體質量標準��。
4)制劑的放行標準作為生產(chǎn)工藝信息表附件���。
批注:如放行標準與注冊標準一致���,簡單說明即可;如不完全一致��,需列表對比放行標準與注冊標準的異同���,對比內(nèi)容應包括項目��、方法(類型)及限度��,突出顯示不一致之處���。對于不同于注冊標準的項目(包括分析方法及增訂項目),需按現(xiàn)行版中國藥典格式提供規(guī)范的文字描述���,與注冊標準一致的項目無需贅述���。
三、小結
工藝信息表中的所有信息均需與申報資料保持一致���,不可隨意更改��。以上批注均是筆者的經(jīng)驗之談�����,希望對讀者有一定的借鑒作用��,幫助大家能更好更規(guī)范地撰寫化藥制劑生產(chǎn)工藝信息表���,縮短注冊過程中與監(jiān)管機構來回溝通修改完善所需的時間�����,助力產(chǎn)品快速獲批�����。
參考文獻
1.化藥制劑生產(chǎn)工藝信息表��。




