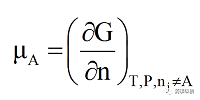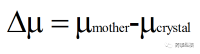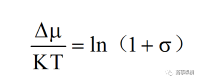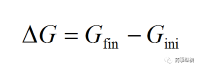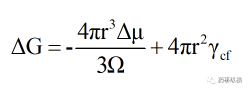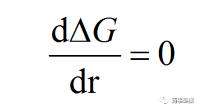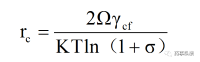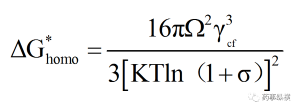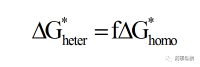晶體的產(chǎn)生是溶液中生長基元聚集的結(jié)果,包括成核與晶體生長兩個過程�。生長基元首先在溶液中聚集形成晶核�,在充足的時間內(nèi)�,晶核生長至特定大小,最終生長形成宏觀的晶體�。成核是通過自組裝形成新的熱力學(xué)相或新結(jié)構(gòu)的第一步,下面簡單介紹下晶體成核的類型與成核熱力學(xué)�。
成核(Nucleation),也被稱形核�,即生成晶核的過程�,是結(jié)晶初始時的“孕育階段”。 在藥物溶液中�,分子首先在溶劑(母相)中形成與擬生長晶體具有相同結(jié)構(gòu),并且在給定的晶體生長條件下熱力學(xué)穩(wěn)定的晶胚(團(tuán)簇�,Cluster),隨后�,當(dāng)團(tuán)簇尺寸大于臨界成核半徑時,形成晶核�,尺寸小于臨界晶核的團(tuán)簇稱為亞晶核。在晶核形成前需要經(jīng)過一段時間的誘導(dǎo)期�,成核誘導(dǎo)時間是指從成核開始到出現(xiàn)可觀測到晶核所需要的時間,與成核速率成反比�。
成核類型
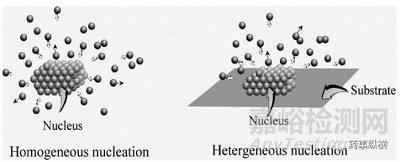
初級成核是指在無晶種條件下,溶質(zhì)過飽和溶液的自發(fā)成核�,又可分為均質(zhì)和異質(zhì)成核兩種方式(圖1)。均質(zhì)成核(Homogeneous nucleation)是指在均勻的母相中成核�,也就是說�,不考慮基底(添加物�、氣泡、容器壁等)對成核的影響�,在體系中空間各點成核的概率是相同的,但均質(zhì)成核很難發(fā)生�;異質(zhì)成核(Hetergeneous nucleation)是指在相界面上(如容器壁、原有晶體表面)成核的過程�,在體系中空間各點成核的概率不同。二次成核是指在已存在晶種的條件下進(jìn)行成核的過程�,因此,二次成核也是異質(zhì)成核的一種�。
圖1 均質(zhì)成核與異質(zhì)成核示意圖
成核熱力學(xué)驅(qū)動力
熱力學(xué)第一、第二定律是針對于均相封閉熱力學(xué)系統(tǒng)(單一物質(zhì)或組成不變)進(jìn)行討論的�,均相體系吉布斯自由能(G)為壓力和溫度的函數(shù),即G=G(P�,T)。然而�,對于有相變的系統(tǒng),除壓力和溫度外還需要考慮各組分物質(zhì)的量的變化對體系吉布斯自由能的影響�,即G=G(P,T�,n1�,n2,n3...)�。在等溫等壓的熱力學(xué)條件下�,在一定濃度的有限量溶液中�,加入dnA的A物質(zhì)所引起的吉布斯自由能隨該組分的量的變化率,稱為化學(xué)勢或偏吉布斯自由能�,可用公式(1)表示:
(1)
結(jié)晶是一級相變的過程�,形成新相(晶體相)的熱力學(xué)驅(qū)動力為溶質(zhì)分子在溶劑(母相)中的化學(xué)勢與在結(jié)晶相中的化學(xué)勢之差Δμ:
(2)
其中,μmother為溶質(zhì)在母相中的化學(xué)勢�,μcrystal為溶質(zhì)在晶體相中的化學(xué)勢�。當(dāng)Δμ > 0時,溶液處于過飽和狀態(tài)�,溶質(zhì)分子可自發(fā)地從化學(xué)勢高的母相中向化學(xué)勢低的晶體相中轉(zhuǎn)移�,因此,Δμ > 0是晶體成核及生長的熱力學(xué)驅(qū)動力�;當(dāng)Δμ < 0時�,溶液處于未飽和狀態(tài),在這種狀態(tài)下�,溶質(zhì)分子將會溶解;當(dāng)Δμ = 0時�,溶質(zhì)分子在兩相中的化學(xué)勢相等,溶解-結(jié)晶達(dá)到平衡狀態(tài)�。另外,Δμ與溶液過飽和度間的關(guān)系可用公式(3)表示:
(3)
其中�,K為玻爾茲曼常數(shù),T為絕對溫度�,σ為溶液過飽和度。
在晶核形成時�,體系吉布斯自由能的變化由兩部分組成:(1)由于體系從液相轉(zhuǎn)變?yōu)樽杂赡芨」滔啵ňw相)而使體系自由能下降,自由能的變化為晶體相形成時的體積自由能的變化�;(2)新形成的晶體相隨尺寸的增大,固-液界面面積相應(yīng)的增加�,使體系具有更高的界面能,自由能的變化為晶體相形成時界面能的變化�。成核勢壘(Nucleation barrier)是指分子或原子在成核過程中基于這兩方面自由能變化所需要跨越的屏障�。在晶核形成時體系自由能變化(△G)為終態(tài)自由能與始態(tài)自由能的差值:
(4)
其中,Gfin�、Gini分別為體系終態(tài)與始態(tài)吉布斯自由能。結(jié)晶是一個有相變�、非體積功不為0的過程,這時就要考慮組分物質(zhì)的量及界面能的變化對系統(tǒng)吉布斯自由能的影響�。在均質(zhì)成核過程中�,假設(shè)團(tuán)簇是半徑為r的球體,Ω為單位體積中的分子數(shù)�,γcf為團(tuán)簇與母相間界面能,則體系吉布斯自由能的變化可由以下公式表示:
(5)
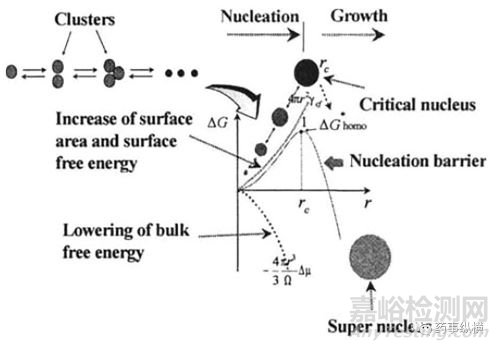
從公式(5)中可以看出ΔG包括按r2比例增加的界面能和按r3比例減小的體積自由能兩部分�。隨著r的增加,ΔG增大,意味著界面能的增加大于體積自由能的下降�,當(dāng)ΔG達(dá)到最大值時�,開始隨r的增加而減小,意味著界面能的增加小于體積自由能的下降�,對應(yīng)ΔG最大值的團(tuán)簇稱為臨界晶核,其半徑為臨界晶核半徑rc�,ΔG最大值處對應(yīng)的自由能的變化稱為均質(zhì)成核勢壘(ΔG*homo)。只有當(dāng)r > rc時�,ΔG下降,晶核才能穩(wěn)定存在(圖2)�。
圖2團(tuán)簇尺寸對成核勢壘的影響
在臨界處�,ΔG對r的導(dǎo)數(shù)為0,即:
(6)
結(jié)合公式(3)�、(5)、(6)�,可得均質(zhì)成核臨界半徑與成核勢壘表達(dá)式:
(7)
(8)
對于異質(zhì)成核而言�,臨界成核半徑與均質(zhì)成核相同�。異質(zhì)成核勢壘(ΔG*heter)與均質(zhì)成核勢壘間的關(guān)系可用公式(9)表示:
(9)
f為界面相關(guān)因子�,0 ≤ f ≤1,由此可見�,在異質(zhì)成核過程中,基底會降低成核勢壘,這是其降低了體系界面自由能的緣故�,因為界面的替換比界面的生成需要更少的能量。
晶核的形成是一系列復(fù)雜過程綜合作用的結(jié)果�,是多相、多組分的傳熱和傳質(zhì)過程�。闡明晶核形成的熱力學(xué)行為�,可比較晶核在不同條件(溶劑類型、溫度�、溶液濃度等)下形成過程中的能量效應(yīng),為優(yōu)化晶體生成及生產(chǎn)提供必要的理論依據(jù)�。
翻譯文獻(xiàn)來源:Liu XY. Generic mechanism of heterogeneous nucleation and molecular interfacial effects [M]. In: Sato K, Furukawa Y, Nakajima K (Eds), Advances in crystal growth research. Elsevier, 2001, New York, pp 42-61.