摘 要 Abstract
目的:對(duì)藥品上市后安全性研究(PASS)政策執(zhí)行情況進(jìn)行分析��,為優(yōu)化PASS 政策提供參考����。方法:基于史密斯模型��,從理想化政策�����、執(zhí)行機(jī)構(gòu)����、目標(biāo)群體���、政策環(huán)境等4 個(gè)影響因素出發(fā),定性分析PASS 政策執(zhí)行情況����。結(jié)果:通過(guò)史密斯模型的4 個(gè)變量對(duì)PASS 政策執(zhí)行影響因素進(jìn)行分析,建議完善PASS 政策��,出臺(tái)PASS 管理規(guī)范和條例�����;加強(qiáng)對(duì)PASS 的監(jiān)管���,加大對(duì)PASS 的投入���;加強(qiáng)藥品上市后風(fēng)險(xiǎn)管理;健全藥品上市后安全性評(píng)價(jià)體系等���。結(jié)論:隨著新政策的出臺(tái)����,我國(guó)對(duì)藥品上市后安全監(jiān)測(cè)愈加重視,加強(qiáng)PASS 有利于促進(jìn)藥品安全監(jiān)管�,更好保障公眾健康及生命安全。
Objective: To analyze the implementation of post-authorisation safety study (PASS) policy and provide reference for optimizing the PASS policy. Methods: Based on the Smith model, the PASS policy implementation is analyzed qualitatively from four influencing factors: idealized policy, implementation agency, target group and policy environment. Results: The analysis of the factors influencing the PASS policy implementation through the four variables of the Smith model, introduce the management norms and regulations of PASS; strengthen the supervision of PASS, increase the investment in PASS; strengthen the risk management after marketing; and improve the safety evaluation system after marketing. Conclusion: With the introduction of the new policy, China pays more and more attention to the safety monitoring of drugs after the market. Strengthening PASS can promote the supervision of drugs, so as to ensure the life safety of patients and public health.
關(guān)鍵詞 Key words
藥品上市后安全性研究�����;政策執(zhí)行�����;史密斯模型���;藥品不良反應(yīng)監(jiān)測(cè);藥物警戒
post-authorisation safety study; policy implementation; Smith model; adverse drug reaction monitoring; pharmacovigilance
藥品上市后安全性研究(post-authorisation safety study�,PASS)是指藥品上市后,為保障用藥安全對(duì)藥品安全風(fēng)險(xiǎn)進(jìn)行識(shí)別和評(píng)價(jià)風(fēng)險(xiǎn)控制措施效果的研究����,是藥物警戒中不可或缺的一環(huán)[1]。2007 年7 月���,原國(guó)家食品藥品監(jiān)督管理局發(fā)布《藥品注冊(cè)管理辦法》[2]���,提出要對(duì)上市后新藥進(jìn)行安全性管理�����。2011年5 月�,原衛(wèi)生部發(fā)布的《藥品不良反應(yīng)報(bào)告和監(jiān)測(cè)管理辦法》[3]規(guī)定�,對(duì)于處于監(jiān)測(cè)期的國(guó)產(chǎn)新藥,應(yīng)監(jiān)測(cè)和報(bào)告此藥上市后的不良反應(yīng)�����,對(duì)于首次進(jìn)口5 年內(nèi)以及可能存在安全隱患的高風(fēng)險(xiǎn)藥品�,應(yīng)開(kāi)展重點(diǎn)監(jiān)測(cè),這在一定程度上推動(dòng)了我國(guó)藥物警戒的發(fā)展和突發(fā)不良反應(yīng)事件預(yù)警制度的建立��。2017 年6 月����,原國(guó)家食品藥品監(jiān)督管理總局加入國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)(ICH),這對(duì)我國(guó)藥品監(jiān)管制度提出了更高層次的要求��。2019 年8 月�����,新修訂《藥品管理法》首次明確提出建立藥物警戒制度[4],我國(guó)藥物警戒的發(fā)展前進(jìn)了一大步��。2020 年1 月�,國(guó)家市場(chǎng)監(jiān)管總局發(fā)布的《藥品注冊(cè)管理辦法》[5] 規(guī)定,藥品上市許可持有人(MAH)應(yīng)當(dāng)主動(dòng)開(kāi)展藥品上市后研究�,加強(qiáng)對(duì)已上市藥品的持續(xù)管理;2021 年5 月��,國(guó)家藥品監(jiān)督管理局(以下簡(jiǎn)稱國(guó)家藥監(jiān)局)發(fā)布的《藥物警戒質(zhì)量管理規(guī)范》[6](GVP) 闡釋了PASS 的定義��,并對(duì)藥品上市后安全性研究有關(guān)細(xì)節(jié)作出詳細(xì)規(guī)定��。為保障公眾用藥安全���,我國(guó)藥品相關(guān)法律法規(guī)不斷完善,藥品安全主體責(zé)任也更加明確��。
本文基于史密斯模型���,分析PASS 政策框架及執(zhí)行過(guò)程中的影響因素��,通過(guò)對(duì)4 個(gè)影響因素進(jìn)行分析并提出相應(yīng)建議��,以期為PASS 政策執(zhí)行的優(yōu)化提供參考�����。
1�����、理論模型
1.1 史密斯政策執(zhí)行過(guò)程的分析框架
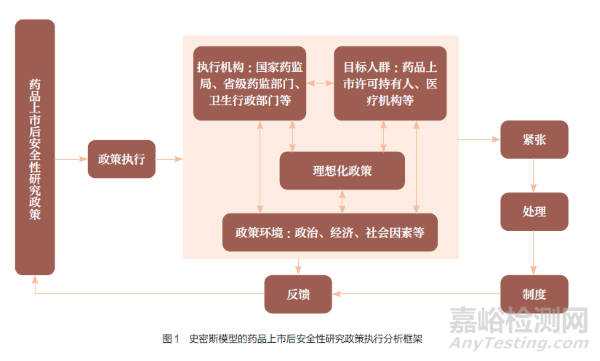
20 世紀(jì)70 年代���,美國(guó)學(xué)者史密斯在《政策執(zhí)行過(guò)程》一文中��,首次提出分析政策執(zhí)行過(guò)程及其影響因素的理論模型�,該模型稱為“史密斯模型”��,又稱“史密斯政策執(zhí)行過(guò)程模型”���。史密斯認(rèn)為����,政策執(zhí)行受多方因素影響�,主要體現(xiàn)在理想化政策、執(zhí)行機(jī)構(gòu)����、目標(biāo)群體、政策環(huán)境等4 個(gè)變量,這4 個(gè)變量緊密相關(guān)�����,彼此互相作用與影響���。史密斯模型通過(guò)分析上述4 個(gè)變量之間的關(guān)系��,使政策分析的脈絡(luò)更加清晰�,能用于更準(zhǔn)確地分析和解決政策執(zhí)行過(guò)程中的問(wèn)題���。首先��,理想化政策是指在毫無(wú)干擾的環(huán)境下達(dá)到的完美狀態(tài)��,現(xiàn)實(shí)中難以實(shí)現(xiàn)����,這是政策執(zhí)行前最重要的一環(huán)���。其次,執(zhí)行機(jī)構(gòu)是指政府中具體負(fù)責(zé)政策執(zhí)行的機(jī)構(gòu)���,涉及執(zhí)行人員的情況以及領(lǐng)導(dǎo)者的領(lǐng)導(dǎo)模式�、技巧等。再次�����,目標(biāo)群體是指政策執(zhí)行的實(shí)施對(duì)象����,即受政策影響最大的群體。最后��,政策環(huán)境是指與政策執(zhí)行有關(guān)聯(lián)的影響因子�����,包括政治���、經(jīng)濟(jì)��、社會(huì)�����、文化因素等�。
1.2 藥品上市后安全性研究政策執(zhí)行分析框架
史密斯認(rèn)為,政策執(zhí)行過(guò)程是上述4 種變量之間互相作用�、互相協(xié)調(diào)的過(guò)程。在此過(guò)程中����,無(wú)論是政策參與者還是執(zhí)行者,都會(huì)受到過(guò)程變量的影響��,這兩者之間的政策張力以及因此帶來(lái)的沖突可能會(huì)引發(fā)“緊張”的政策關(guān)系��。針對(duì)這種“緊張”的政策關(guān)系���,可利用制度化或非制度化的措施處理出現(xiàn)的過(guò)程性問(wèn)題并進(jìn)行問(wèn)題反饋���,通過(guò)協(xié)調(diào)與修正變量之間的關(guān)系,使政策得以有效執(zhí)行�。基于史密斯模型中的4 個(gè)影響因子�����,構(gòu)建PASS 政策執(zhí)行分析框架���,如圖1 所示����,這4 個(gè)影響因子會(huì)對(duì)PASS 政策執(zhí)行產(chǎn)生一定的影響�。
2、藥品上市后安全性研究政策執(zhí)行影響因素分析
2.1 理想化政策
2019 年新修訂《藥品管理法》實(shí)施后����,MAH 制度開(kāi)始在全國(guó)范圍實(shí)施[7]。MAH 制度實(shí)施前�,藥品上市后階段涉及藥品流通質(zhì)量管理、上市后監(jiān)測(cè)�、風(fēng)險(xiǎn)管理、批準(zhǔn)后研究等��,其責(zé)任主體包括藥品生產(chǎn)企業(yè)�����、經(jīng)營(yíng)企業(yè)��、醫(yī)療機(jī)構(gòu)等��,但未規(guī)定研發(fā)者對(duì)上市后藥品的義務(wù)和責(zé)任��。MAH 制度實(shí)施后���,藥品上市后階段的責(zé)任主體為MAH����。根據(jù)《藥品管理法》第七十七條,MAH 應(yīng)當(dāng)制定藥品上市后風(fēng)險(xiǎn)管理計(jì)劃�����,主動(dòng)開(kāi)展藥品上市后研究�,對(duì)藥品的安全性、有效性和質(zhì)量可控性進(jìn)行進(jìn)一步確證��,加強(qiáng)對(duì)已上市藥品的持續(xù)管理[4]��。2020 年新修訂《藥品注冊(cè)管理辦法》進(jìn)一步細(xì)化了MAH 制度的框架����、適用范圍等。MAH 制度的實(shí)施����,降低了藥品研發(fā)機(jī)構(gòu)的成本投入,激發(fā)了藥品研發(fā)積極性�����。然而,MAH 主動(dòng)收集不良反應(yīng)并報(bào)告的意識(shí)仍有待提高���,作為藥品安全“第一責(zé)任人”,部分MAH 未貫徹落實(shí)《藥品管理法》相關(guān)規(guī)定[8]���。
GVP 是我國(guó)建立藥物警戒制度以來(lái)出臺(tái)的第一個(gè)藥物警戒規(guī)范性文件���, 論述了PASS 相關(guān)內(nèi)容。但與美國(guó)��、日本等國(guó)家相比���, 我國(guó)對(duì)于PASS 還沒(méi)有詳細(xì)的規(guī)定����?��!端幤饭芾矸ā返谝话偃臈l規(guī)定�����,MAH未按照規(guī)定開(kāi)展藥品不良反應(yīng)(adverse drug reaction�����,ADR)監(jiān)測(cè)或者報(bào)告疑似ADR的�,責(zé)令限期改正,給予警告�;逾期不改正的,責(zé)令停產(chǎn)停業(yè)整頓�����, 并處十萬(wàn)元以上一百萬(wàn)元以下的罰款���?����?梢?jiàn)�,目前我國(guó)對(duì)MAH 違法行為的處罰措施限于警告和罰款���, 對(duì)MAH 的激勵(lì)��、警示和威懾作用仍有待加強(qiáng)����。
2.2 執(zhí)行機(jī)構(gòu)
PASS 政策的執(zhí)行機(jī)構(gòu)主要是國(guó)家藥監(jiān)局、省級(jí)藥品監(jiān)管部門(mén)以及衛(wèi)生行政部門(mén)等�。藥品監(jiān)管部門(mén)和衛(wèi)生行政部門(mén)的工作職責(zé)包括保障公眾用藥安全,并對(duì)ADR 監(jiān)測(cè)和報(bào)告進(jìn)行監(jiān)督和管理����。藥物警戒貫穿藥物發(fā)展全過(guò)程��,包括上市前和上市后階段�����,其中上市后監(jiān)管包括ADR 監(jiān)測(cè)和報(bào)告����。MAH 制度實(shí)施前,我國(guó)藥物警戒工作存在一些不足�����,如相關(guān)法律法規(guī)不完善���、信息系統(tǒng)不成熟���、藥物警戒體系不健全等[8]����,ADR 報(bào)告和監(jiān)測(cè)以被動(dòng)為主�,對(duì)于新的、嚴(yán)重的ADR 分析能力有限����,藥物警戒相關(guān)法律法規(guī)制定刻不容緩;MAH 制度的實(shí)施為建立健全藥物警戒相關(guān)法律法規(guī)提供了依據(jù)�,促進(jìn)了我國(guó)GVP 的出臺(tái),推動(dòng)我國(guó)藥物警戒發(fā)展進(jìn)入新階段��。同時(shí)��,MAH 在ADR 監(jiān)測(cè)和報(bào)告方面的主動(dòng)性也有所提高�,但其主動(dòng)性意識(shí)仍需進(jìn)一步加強(qiáng)。
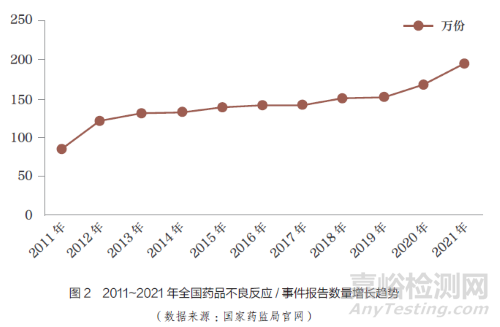
隨著MAH�����、醫(yī)療機(jī)構(gòu)以及患者對(duì)ADR 的重視�,ADR 事件報(bào)告的數(shù)量逐年增加。藥品不良事件是指在藥物治療過(guò)程中發(fā)生的任何不幸的醫(yī)療衛(wèi)生事件��,而這種事件不一定與藥物治療存在因果關(guān)系[9]。根據(jù)國(guó)家藥監(jiān)局統(tǒng)計(jì)��,1999~2021 年��, 全國(guó)ADR監(jiān)測(cè)網(wǎng)絡(luò)累計(jì)收到《藥品不良反應(yīng)/ 事件報(bào)告表》1883 萬(wàn)份[10]�����,且每年ADR 事件數(shù)量不減反增��,2011~2021 年全國(guó)不良反應(yīng)/ 事件報(bào)告數(shù)量增長(zhǎng)趨勢(shì)如圖2 所示����。2021 年����,全國(guó)不良反應(yīng)/ 事件共196.2 萬(wàn)份,較2020 年增長(zhǎng)17.1%�����,但來(lái)源于MAH 的報(bào)告數(shù)量?jī)H占同期總數(shù)的4.1%�,較2020 年的3.9% 并沒(méi)有明顯增長(zhǎng)。由此可見(jiàn)���,我國(guó)對(duì)ADR 的監(jiān)測(cè)亟需進(jìn)一步加強(qiáng)���。2013~2021年�����,國(guó)家藥監(jiān)局發(fā)布的國(guó)家ADR監(jiān)測(cè)年度報(bào)告來(lái)源情況如圖3 所示�����。數(shù)據(jù)顯示����,近10 年來(lái)���,醫(yī)療機(jī)構(gòu)報(bào)告的ADR 事件占大多數(shù)�����,其次是藥品生產(chǎn)經(jīng)營(yíng)企業(yè)�����;近3年來(lái)���,MAH 報(bào)告的ADR 數(shù)量雖有所增加���,但增幅不大,報(bào)告數(shù)量所占比例仍較低�,我國(guó)GVP制度的落地還需要不斷完善相關(guān)配套制度和規(guī)范。
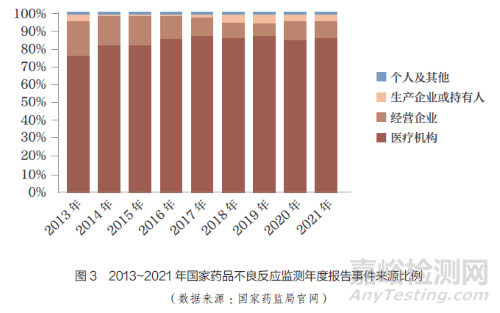
在MAH 制度實(shí)施前���,ADR報(bào)告的責(zé)任主體是藥品生產(chǎn)和經(jīng)營(yíng)企業(yè)��、醫(yī)療機(jī)構(gòu)��、個(gè)人及其他�,但從ADR 報(bào)告的數(shù)量來(lái)看�,藥品生產(chǎn)和經(jīng)營(yíng)企業(yè)報(bào)告數(shù)量較少����,主要原因在于企業(yè)追求利益最大化,不愿在ADR 監(jiān)測(cè)和報(bào)告中投入更多人力����、物力和財(cái)力,部分企業(yè)認(rèn)為公眾知曉ADR 報(bào)告會(huì)影響產(chǎn)品銷量和企業(yè)形象����。相信隨著MAH 制度的持續(xù)推進(jìn)���,上述狀況將得到改善。
2.3 目標(biāo)群體
目標(biāo)群體是指政策執(zhí)行的實(shí)施對(duì)象����。PASS 實(shí)施對(duì)象包括MAH、醫(yī)療機(jī)構(gòu)及藥品生產(chǎn)經(jīng)營(yíng)企業(yè)等����。郭莎莎等[11] 認(rèn)為,河北省僅有少部分MAH 開(kāi)展風(fēng)險(xiǎn)評(píng)估��,原因可能是MAH 把更多的資源和精力投入到藥品上市前研究階段���,而減少了藥品上市后風(fēng)險(xiǎn)管控的投入���。方樂(lè)敏等[12] 認(rèn)為,上海市部分MAH 存在未對(duì)藥品安全數(shù)據(jù)進(jìn)行回顧性評(píng)價(jià)�����、未實(shí)施評(píng)價(jià)和控制等問(wèn)題��,即使有些MAH 發(fā)現(xiàn)藥品存在風(fēng)險(xiǎn)信號(hào),也沒(méi)有進(jìn)行控制���,無(wú)法實(shí)現(xiàn)風(fēng)險(xiǎn)管理的閉環(huán)���。目前,我國(guó)ADR 報(bào)告來(lái)源以醫(yī)療機(jī)構(gòu)為主�����,藥品生產(chǎn)經(jīng)營(yíng)企業(yè)為輔���,存在收集渠道不健全���、漏報(bào)瞞報(bào)、信息利用率低�、主動(dòng)監(jiān)測(cè)意識(shí)不足等問(wèn)題[13]。而藥物警戒制度的核心內(nèi)容是藥品風(fēng)險(xiǎn)管理���,MAH 需要探測(cè)藥品全生命周期中的隱患信號(hào),在未發(fā)生嚴(yán)重ADR 事件時(shí)就加以控制�,確保藥品上市前與上市后的安全性。
藥品生產(chǎn)企業(yè)是保障藥品安全的責(zé)任主體�����。部分藥品生產(chǎn)企業(yè)對(duì)藥品上市前安全性研究的投入比上市后多,認(rèn)為藥品上市后安全性研究投入會(huì)增加企業(yè)負(fù)擔(dān)�����。企業(yè)加大對(duì)藥物警戒的資金投入����,可能不會(huì)給企業(yè)帶來(lái)直接的經(jīng)濟(jì)利益, 但可以保障企業(yè)獲得更大的經(jīng)濟(jì)利益��。藥品生產(chǎn)企業(yè)有必要對(duì)上市后的藥品進(jìn)行監(jiān)測(cè)����, 降低藥品上市后的安全性風(fēng)險(xiǎn)。
2.4 政策環(huán)境
我國(guó)藥品監(jiān)管由國(guó)家藥監(jiān)局�����、省級(jí)藥監(jiān)局����、市縣藥監(jiān)部門(mén)三級(jí)管理[4]。由于各省份���、城鄉(xiāng)之間醫(yī)療水平不同�����、資源分布不均�����、監(jiān)管能力存在差異等���,加之跨省監(jiān)管協(xié)作機(jī)制仍有待完善����,MAH制度順利實(shí)施的難度較大[14]����。目前,我國(guó)藥品監(jiān)管部門(mén)對(duì)藥品的審批更加嚴(yán)格��,并加強(qiáng)了上市后監(jiān)管��。然而����,每年ADR 報(bào)告數(shù)量仍在增加,原因之一是ADR安全性評(píng)價(jià)機(jī)制仍有待完善��。少數(shù)醫(yī)療機(jī)構(gòu)為了通過(guò)審批偽造材料�����, 加之審批時(shí)間縮減����, 導(dǎo)致藥品審批監(jiān)管難度加大, 藥品質(zhì)量和安全性受到影響[15-16]���。新藥上市前安全性研究需要經(jīng)過(guò)臨床試驗(yàn)階段��,試驗(yàn)會(huì)受到時(shí)間��、用藥人群等影響�����,導(dǎo)致新藥上市后的風(fēng)險(xiǎn)不能被準(zhǔn)確估量�����;而隨著上市后用藥人群的擴(kuò)大�,風(fēng)險(xiǎn)隱患也在增加。因此���,相關(guān)部門(mén)有必要開(kāi)展PASS 研究�����。
隨著人們生活質(zhì)量的提高�����,醫(yī)療衛(wèi)生需求日益增加�, 國(guó)家出臺(tái)了一系列保證藥品質(zhì)量和安全的政策�����, 同時(shí)加深了人們對(duì)藥品安全的認(rèn)識(shí)�����。GVP 強(qiáng)調(diào)了在開(kāi)展PASS 過(guò)程中的風(fēng)險(xiǎn)評(píng)估和控制���,如MAH 應(yīng)當(dāng)監(jiān)測(cè)PASS 期間的安全性信息��, 發(fā)現(xiàn)任何可能影響藥品獲益- 風(fēng)險(xiǎn)平衡的新信息�����, 應(yīng)當(dāng)及時(shí)開(kāi)展評(píng)估��,并采取適宜風(fēng)險(xiǎn)控制措施�����;研究中發(fā)現(xiàn)可能嚴(yán)重危害患者生命安全或公眾健康的藥品安全問(wèn)題時(shí)��,MAH 應(yīng)當(dāng)立即采取暫停銷售和使用�、召回等緊急控制措施����,并將召回和處理情況向省級(jí)藥品監(jiān)管部門(mén)和ADR 監(jiān)測(cè)機(jī)構(gòu)報(bào)告[6]。為了確保受試者或用藥者的安全���,MAH 要在整個(gè)PASS 過(guò)程中貫徹風(fēng)險(xiǎn)管理理念���, 并對(duì)藥品全生命周期進(jìn)行監(jiān)測(cè)。
3�����、藥品上市后安全性研究政策執(zhí)行建議
3.1 完善PASS 政策,出臺(tái)PASS 管理規(guī)范和條例
我國(guó)的PASS 法律體系是以法律為主��、法規(guī)為輔��,共同指導(dǎo)MAH 進(jìn)行PASS�����,同時(shí)由相關(guān)部門(mén)指導(dǎo)和監(jiān)督研究全過(guò)程�。MAH 應(yīng)建立藥品安全體系,對(duì)藥品上市后安全進(jìn)行監(jiān)測(cè)�,包括ADR 監(jiān)測(cè)與報(bào)告流程規(guī)范、藥品上市前后風(fēng)險(xiǎn)管理相關(guān)文件�����、藥品上市后再評(píng)價(jià)相關(guān)規(guī)定等[16]�����。MAH 制度的不斷完善��,有利于MAH 開(kāi)展PASS�����。
如上所述, 目前我國(guó)在PASS 政策執(zhí)行過(guò)程中���,對(duì)違法行為的行政處罰方式僅是警告和罰款��。為保證PASS 政策的實(shí)施���,建議在藥品監(jiān)管相關(guān)法律法規(guī)中對(duì)PASS 作出更詳細(xì)的規(guī)定�����,對(duì)違法行為制定更嚴(yán)厲的處罰措施(如停止銷售相關(guān)產(chǎn)品��、吊銷《藥品生產(chǎn)許可證》等)�,以進(jìn)一步督促M(fèi)AH 自覺(jué)遵守PASS 相關(guān)規(guī)定。同時(shí)�����,建議相關(guān)部門(mén)出臺(tái)PASS 相關(guān)管理規(guī)范等���,從而更好指導(dǎo)MAH 開(kāi)展PASS�。
3.2 加強(qiáng)MAH 責(zé)任落實(shí)及對(duì)PASS 的監(jiān)管,加大PASS 投入
MAH 是藥物警戒的責(zé)任主體��,職責(zé)包括對(duì)ADR 進(jìn)行監(jiān)測(cè)和報(bào)告���。從已發(fā)生的ADR 事件來(lái)看����,開(kāi)展ADR 監(jiān)測(cè)不僅有助于發(fā)現(xiàn)上市前受環(huán)境等因素影響未被發(fā)現(xiàn)的安全性問(wèn)題�����,還有助于發(fā)現(xiàn)產(chǎn)品在流通或用藥過(guò)程中出現(xiàn)的問(wèn)題��。同時(shí)����,ADR 監(jiān)測(cè)和報(bào)告的結(jié)果可作為藥品安全性評(píng)價(jià)的依據(jù),從而保障藥品質(zhì)量和公眾用藥安全�����。此外����,藥品生產(chǎn)經(jīng)營(yíng)企業(yè)在開(kāi)展ADR 監(jiān)測(cè)時(shí)���,還可向公眾展示最新的產(chǎn)品信息,這種具有主動(dòng)性���、自覺(jué)性的做法有利于企業(yè)樹(shù)立良好形象�����,增加公眾對(duì)企業(yè)的信任���。因此�����,從長(zhǎng)遠(yuǎn)來(lái)看����,加大對(duì)PASS 的投入有利于企業(yè)發(fā)展。
3.3 提高藥品上市后的風(fēng)險(xiǎn)管理
在PASS 政策執(zhí)行過(guò)程中�����,需要進(jìn)行藥品上市后風(fēng)險(xiǎn)管理����,包括識(shí)別藥品風(fēng)險(xiǎn)信號(hào)�����、啟動(dòng)風(fēng)險(xiǎn)管理計(jì)劃���、藥品安全性再評(píng)價(jià)��、風(fēng)險(xiǎn)效益再評(píng)價(jià)等[17]��。MAH 實(shí)施藥物警戒制度時(shí)需改變思想觀念���,由被動(dòng)轉(zhuǎn)變?yōu)橹鲃?dòng)監(jiān)測(cè)、識(shí)別��、評(píng)估與控制藥品風(fēng)險(xiǎn)��。在監(jiān)測(cè)階段��,MAH 應(yīng)主動(dòng)收集藥物警戒相關(guān)信息并按要求上報(bào)���,完善ADR 網(wǎng)絡(luò)信息系統(tǒng)和藥品監(jiān)測(cè)機(jī)制��,全面監(jiān)測(cè)藥品風(fēng)險(xiǎn)。在識(shí)別風(fēng)險(xiǎn)階段�����,MAH 應(yīng)增強(qiáng)對(duì)監(jiān)測(cè)信息的分析能力�,識(shí)別信息中是否存在潛在風(fēng)險(xiǎn)信號(hào)。在評(píng)估階段����,MAH 應(yīng)重點(diǎn)關(guān)注具有潛在風(fēng)險(xiǎn)的信息,研究風(fēng)險(xiǎn)發(fā)生機(jī)制�����,定期對(duì)藥品開(kāi)展風(fēng)險(xiǎn)評(píng)估�,包括藥品安全性評(píng)價(jià)�����、藥品潛在風(fēng)險(xiǎn)識(shí)別�、主動(dòng)開(kāi)展PASS 等。在控制階段�����,MAH 應(yīng)根據(jù)風(fēng)險(xiǎn)評(píng)估結(jié)果,對(duì)存在的風(fēng)險(xiǎn)采取相應(yīng)的解決措施�����,并撰寫(xiě)年度ADR 報(bào)告�,減少藥品對(duì)公眾健康的危害。
3.4 健全藥品上市后安全性評(píng)價(jià)體系
ADR 數(shù)據(jù)信息是開(kāi)展藥物警戒工作的基礎(chǔ)���。2016 年�,原國(guó)家食品藥品監(jiān)督管理總局藥品評(píng)價(jià)中心開(kāi)發(fā)了中國(guó)醫(yī)院藥物警戒系統(tǒng)(CHPS)�����,通過(guò)該系統(tǒng)可主動(dòng)監(jiān)測(cè)是否存在ADR 風(fēng)險(xiǎn)����。該監(jiān)測(cè)手段靈敏度高、便于數(shù)據(jù)分析�,優(yōu)化了醫(yī)療機(jī)構(gòu)上報(bào)ADR 事件的流程,提高了醫(yī)療機(jī)構(gòu)對(duì)ADR的監(jiān)測(cè)水平��,為藥品上市后安全性評(píng)價(jià)提供了數(shù)據(jù)信息支撐���。
藥品上市后安全性評(píng)價(jià)體系的構(gòu)建和完善是PASS 的內(nèi)容之一���,對(duì)于開(kāi)展PASS 具有重要意義。藥品上市前和上市后都需要進(jìn)行風(fēng)險(xiǎn)評(píng)價(jià)�����,上市后安全性評(píng)價(jià)有利于識(shí)別和確認(rèn)藥品上市后是否存在安全隱患,如存在安全隱患�,則需要采取暫停銷售�、召回藥品等措施���,從而有效防止更嚴(yán)重的ADR 事件發(fā)生。在藥品審批階段�����,建議藥品監(jiān)管部門(mén)加強(qiáng)對(duì)申請(qǐng)資料的審查����,確保資料真實(shí)可靠。為保證安全性評(píng)價(jià)的真實(shí)性和準(zhǔn)確性��,建議選擇德才兼?zhèn)?�、?jīng)驗(yàn)豐富的醫(yī)師作為藥品安全性評(píng)價(jià)專家�。此外���,建議藥品監(jiān)管部門(mén)完善新藥上市后安全性評(píng)價(jià)體系�����,定期對(duì)藥品開(kāi)展抽檢和ADR 監(jiān)測(cè)[18]。
近年來(lái)���,我國(guó)不斷出臺(tái)規(guī)范藥物警戒相關(guān)文件,藥物警戒體系逐漸完善�,相關(guān)法律法規(guī)不斷成熟�����,為MAH 開(kāi)展PASS 提供了保障����。MAH 制度雖已被寫(xiě)入《藥品管理法》中��,但仍處于推進(jìn)階段,還需要不斷完善��。GVP 的頒布�,促進(jìn)了MAH 制度和PASS制度的推行�,但同時(shí)需要注意�����,ADR 監(jiān)測(cè)和管理方面還需完善���,需要出臺(tái)PASS 管理規(guī)范等來(lái)進(jìn)一步明確PASS 相關(guān)內(nèi)容�����,加強(qiáng)對(duì)PASS 的監(jiān)管和風(fēng)險(xiǎn)管理��,建立健全藥品上市后安全性評(píng)價(jià)體系�����,從而最大程度地降低藥品安全風(fēng)險(xiǎn)�,保障公眾生命安全與健康。