今日頭條
同源康小分子CDK7抑制劑獲批臨床���。同源康醫(yī)藥自研新一代小分子CDK7抑制劑TY-2699a獲FDA臨床許可���,擬用于治療多種晚期腫瘤,如乳腺癌���、卵巢癌���、前列腺癌、胰腺癌���、小細胞癌及血液瘤等�。在臨床前研究中�����,TY-2699a已在多個瘤種中顯示出良好的抑制作用�,而且具有良好的安全性。目前���,該公司計劃盡快提交TY-2699a的國內(nèi)臨床試驗申請�����。
國內(nèi)藥訊
1.武田CMV口服療法擬納入優(yōu)先審評�����。武田新機制抗病毒療法馬立巴韋片的上市申請獲CDE擬納入優(yōu)先審評�,擬用于治療移植后巨細胞病毒(CMV)感染/疾病�����,且使用過更昔洛韋、纈更昔洛韋、西多福韋或膦甲酸鈉難治(伴或不伴基因型耐藥)的成人患者���。Livtencity通過抑制CMV病毒的pUL97蛋白激酶,阻斷病毒的復(fù)制。該新藥為首款且唯一一款獲FDA批準(zhǔn)針對這類患者的口服療法���。
2.羅氏抗兒童流感新藥擬納入優(yōu)先審評。羅氏瑪巴洛沙韋干混懸劑的上市申請擬納入優(yōu)先審評���,擬用于兒童單純性甲型和乙型流感患者?,敯吐迳稠f是一款具有創(chuàng)新作用機制的帽狀結(jié)構(gòu)依賴性核酸內(nèi)切酶抑制劑���,也是獲批治療流感的首個單劑量口服藥物���。2021年4月,瑪巴洛沙韋片在中國獲批上市���,用于治療12周歲及以上急性無并發(fā)癥的流感患者����。
3.維立志博MUC16/CD3雙抗獲批臨床�。維立志博1類新藥注射用LBL-033獲國家藥監(jiān)局臨床試驗?zāi)驹S可。LBL-033是一種T細胞連接器�,可同時靶向并結(jié)合表達MUC16的腫瘤細胞和表達CD3的T細胞,介導(dǎo)T細胞對MUC16陽性腫瘤細胞的特異性殺傷���,同時促進免疫細胞因子的分泌����,具協(xié)同抗腫瘤潛力���。該新藥擬開發(fā)用于治療MUC16陽性惡性腫瘤�。
4.百吉自體T細胞療法獲批鼻咽癌臨床�。百吉生物基因修飾T細胞療法BRG01注射液獲FDA臨床許可���,擬開展用于治療復(fù)發(fā)/轉(zhuǎn)移性鼻咽癌的Ⅰ/Ⅱ期臨床。BRG01是一款靶向EB病毒(EBV)抗原的自體T細胞免疫治療產(chǎn)品����,已于去年年底在國內(nèi)獲批開展用于末線治療復(fù)發(fā)/轉(zhuǎn)移性EBV陽性鼻咽癌的臨床研究。百吉生物計劃在中國�、美國、新加坡三地同步開展Ⅰ/Ⅱ期國際多中心臨床試驗���,為新藥未來的全球商業(yè)上市奠定基礎(chǔ)�。
5.石藥TNFR2單抗國內(nèi)獲批臨床�。石藥集團旗下新石生物TNFR2單抗1類新藥NBL-020注射液獲國家藥監(jiān)局臨床試驗?zāi)驹S可,擬單藥或聯(lián)合標(biāo)準(zhǔn)治療用于治療晚期惡性腫瘤����,包括但不限于肺癌、結(jié)腸癌����、卵巢癌、乳腺癌以及皮膚T細胞淋巴瘤等���。臨床前研究顯示�,NBL-020單藥或與PD-1抗體聯(lián)用,均具有積極的抗腫瘤活性和良好的安全性�。去年12月,該新藥已在美國獲批開展治療晚期實體瘤的臨床試驗����。
國際藥訊
1.輝瑞PARP抑制劑治療mCRPC的III期臨床積極����。輝瑞在ASCO GU 2023會議上公布PARP抑制劑Talzenna(talazoparib)聯(lián)合恩扎盧胺一線治療轉(zhuǎn)移性去勢抵抗前列腺癌(mCRPC)的III期TALAPRO-2研究最新數(shù)據(jù)。與安慰劑相比�,Talzenna使患者的疾病進展或死亡風(fēng)險降低37%(P<0.001)。目前Talzenna組患者仍未達到中位rPFS���,而安慰劑組患者的中位rPFS為21.9個月����。FDA已授予Talzenna針對mCRPC適應(yīng)癥的上市申請優(yōu)先審評資格����。
2.SORD缺陷療法Ⅲ期臨床積極。Applied公司具CNS滲透性的醛糖還原酶抑制劑AT-007(govorestat)治療SORD缺陷(遺傳性軸突神經(jīng)病變)的Ⅲ期研究INSPIRE結(jié)果積極�。SORD缺陷由山梨醇脫氫酶基因突變引起,山梨醇的高水平積聚將導(dǎo)致運動神經(jīng)元變性���,從而使患者喪失運動能力����。90天治療結(jié)果顯示,AT-007使患者的血液山梨醇水平平均減少52%(大約16000ng/ml)���,較安慰劑組有顯著差異(p<0.001)���;藥物總體耐受性良好。
3.武田Bcr-Abl激酶抑制劑Ⅲ期臨床積極�。武田Bcr-Abl激酶抑制劑泊那替尼(ponatinib)聯(lián)合化療治療費城染色體陽性急性淋巴細胞白血病新確診患者的Ⅲ期臨床(PhALLCON)達到主要終點。與伊馬替尼(imatinib)聯(lián)合化療相比���,ponatinib組合使患者達到微小殘留病灶(MRD)陰性完全緩解的比例更高(34.4%vs16.7%���,p=0.0021),其中位無事件生存期也呈現(xiàn)改善趨勢(HR=0.652���,95% CI:0.385-1.104)�。兩組的治療伴發(fā)不良反應(yīng)(TEAE)率相似�。詳細數(shù)據(jù)公布于ASCO會議上。
4.歧化酶類小分子新藥獲FDA優(yōu)先審評。Galera公司小分子歧化酶模擬物avasopasem的新藥申請(NDA)獲FDA受理����,用于治療接受標(biāo)準(zhǔn)治療的頭頸癌(HNC)患者因放療引起的嚴重口腔粘膜炎。FDA同時授予其優(yōu)先審評資格����,PDUFA日期為2023年8月9日。Ⅲ期試驗ROMAN和Ⅱb期試驗GT-201的匯總數(shù)據(jù)顯示���,avasopasem顯著降低了患者的SOM疾病負擔(dān)關(guān)鍵性指標(biāo)(包括SOM發(fā)生率和天數(shù)、SOM嚴重程度等)���,而且不影響標(biāo)準(zhǔn)放化療的治療效果����。
5.安博PSMA-ADC晚期前列腺癌早期臨床積極����。Ambrx Biopharma公司靶向前列腺特異性膜抗原(PSMA)的抗體偶聯(lián)藥物(ADC)ARX517治療晚期前列腺癌經(jīng)治患者的Ⅰ期臨床(APEX-01)結(jié)果積極。與基線相比����,ARX517(2.0mg/kg)降低隊列6患者(n=3)的前列腺特異性抗原(PSA)水平超過50%,其中2例患者PSA水平下降程度超過90%;臨床中無藥物相關(guān)嚴重不良反應(yīng)(SAE)或≥3級的治療相關(guān)不良反應(yīng)�,ARX517總體耐受性良好。
6.細胞外蛋白降解藥物公司完成新融資����。專注于細胞外蛋白降解的Avilar 公司宣布獲得新投資者的支持,目前已完成總金額7500萬美元融資���。Avilar Therapeutics正在開發(fā)一類被稱為ATAC(ASGPR Targeting Chimeras)的新型蛋白質(zhì)降解劑���,以用于治療由致病性細胞外蛋白驅(qū)動的自身免疫疾病、神經(jīng)疾病和其他疾病����。ATAC是一種雙功能分子,由能與肝臟細胞表面表達的去唾液酸糖蛋白受體(ASGPR)結(jié)合的配體和能與致病性細胞外蛋白結(jié)合的另一種配體組成����。
醫(yī)藥熱點
1.5類互聯(lián)網(wǎng)診療行為將被扣分。江蘇省蘇州市修訂印發(fā)《醫(yī)務(wù)人員不良執(zhí)業(yè)行為記分管理辦法》����,將于3月1日起施行。新《辦法》增加互聯(lián)網(wǎng)診療等相關(guān)記分條款����,明確5類“云服務(wù)”將被扣分���,分別是:對首診患者開展互聯(lián)網(wǎng)診療活動;互聯(lián)網(wǎng)診療中違反規(guī)定開具麻醉藥品���、精神藥品等特殊管理藥品處方���;未經(jīng)電子實名認證或未滿3年獨立臨床工作經(jīng)驗開展互聯(lián)網(wǎng)診療活動;未經(jīng)其執(zhí)業(yè)注冊的醫(yī)療機構(gòu)同意開展互聯(lián)網(wǎng)診療活動����;未經(jīng)批準(zhǔn)利用互聯(lián)網(wǎng)開展診療活動。
2.國家醫(yī)保局推進藥店購藥可報銷���。日前,國家醫(yī)療保障局發(fā)布《關(guān)于進一步做好定點零售藥店納入門診統(tǒng)籌管理的通知》���?!锻ㄖ分赋?,各級醫(yī)保部門要采取有效措施,鼓勵符合條件的定點零售藥店自愿申請開通門診統(tǒng)籌服務(wù)����,為參保人員提供門診統(tǒng)籌用藥保障����。參保人員憑定點醫(yī)藥機構(gòu)處方在定點零售藥店購買醫(yī)保目錄內(nèi)藥品發(fā)生的費用可由統(tǒng)籌基金按規(guī)定支付����。
3.中華醫(yī)學(xué)會罕見病分會在京成立。2月19日下午����,中華醫(yī)學(xué)會罕見病分會成立大會在北京隆重召開。會議選舉產(chǎn)生第一屆委員會常務(wù)委員����、副主任委員和主任委員。北京協(xié)和醫(yī)院院長���、心內(nèi)科教授張抒揚當(dāng)選第一屆主任委員���。張抒揚表示,分會成立后����,緊鑼密鼓即將開展的工作包括組織罕見病專業(yè)培訓(xùn)���,加強罕見病學(xué)術(shù)交流,不斷培養(yǎng)壯大能診能治的罕見病醫(yī)師隊伍���;組織專家團隊編寫指南����,優(yōu)化臨床路徑����,提高罕見病規(guī)范診斷和治療水平。
4.上海百匯醫(yī)院開業(yè)試運營�。2月18日,新虹橋國際醫(yī)學(xué)園區(qū)內(nèi)唯一的中外合資綜合醫(yī)院——上海百匯醫(yī)院開業(yè)試運營���。上海百匯醫(yī)院一期總投資16.1億元人民幣�,建筑面積84,400平方米����,可設(shè)置近500張床位����。一期開設(shè)42間內(nèi)科及?���?圃\室����,66間病房、VIP套房���,百級�、千級����、萬級層流手術(shù)室,可提供門診���、手術(shù)�、住院服務(wù)�,并設(shè)有24小時醫(yī)療服務(wù)。值得一提的是�,該院首批開展的業(yè)務(wù)包括全國呼吸專家白春學(xué)教授領(lǐng)銜的“元宇宙肺結(jié)節(jié)診治和健康管理中心”。
評審動態(tài)
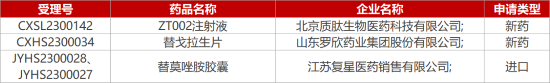
1. CDE新藥受理情況(02月20日)
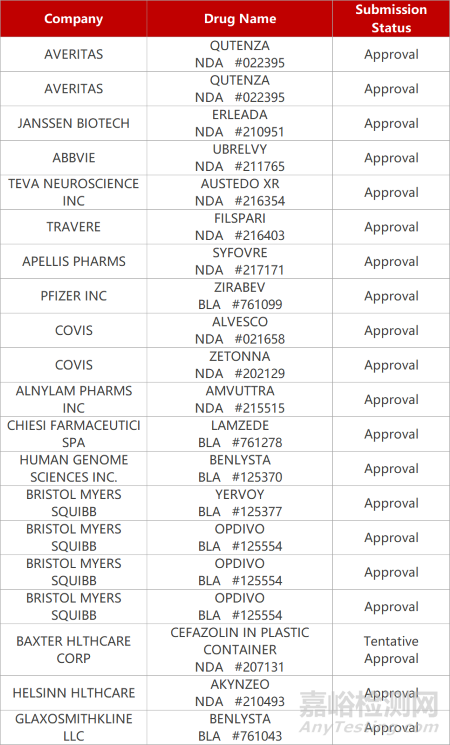
2. FDA新藥獲批情況(北美02月17日)