質(zhì)量源于設(shè)計(jì)(Quality by Design),縮寫為QbD����。QbD概念應(yīng)用于藥物研發(fā),最早是在2004年由美國FDA提出[1]����,后來用到人用藥品注冊技術(shù)要求國際協(xié)調(diào)會(ICH)質(zhì)量體系中并成為指導(dǎo)原則和指南。ICH質(zhì)量體系中Q8(藥物研發(fā))�、Q9(質(zhì)量風(fēng)險(xiǎn)管理)和Q10(藥物質(zhì)量系統(tǒng))貫穿于小試研發(fā)、工藝開發(fā)和生產(chǎn)管理����。
一、QbD定義
根據(jù)ICH Q8對QbD的定義我們可以知道:是一種系統(tǒng)的研發(fā)方法�,其以預(yù)先設(shè)定目標(biāo)為起始,基于可靠的科學(xué)和質(zhì)量風(fēng)險(xiǎn)管理����,強(qiáng)調(diào)對目標(biāo)產(chǎn)品和生產(chǎn)過程的理解及對工藝的控制[2]。
二��、QbD的關(guān)鍵要素
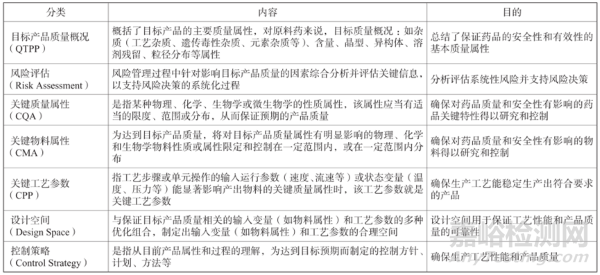
圖1 QbD的關(guān)鍵要素[3]
如圖1所示,QbD理念包括目標(biāo)產(chǎn)品質(zhì)量概況(QTPP)��、關(guān)鍵質(zhì)量屬性(CQA)����、關(guān)鍵物質(zhì)屬性(CMA)、關(guān)鍵工藝參數(shù)(CPP)��、設(shè)計(jì)空間(Design Space)��、風(fēng)險(xiǎn)評估(Risk Assessment)和控制策略(Control Strategy)等關(guān)鍵要素����。
三��、QbD的關(guān)鍵要素的關(guān)系
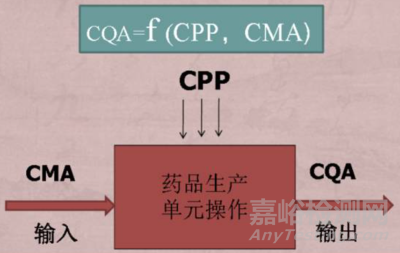
根據(jù)QbD關(guān)鍵要素中的定義��,關(guān)鍵工藝參數(shù)(CPP)和關(guān)鍵物料屬性(CMA)的波動或變化對目標(biāo)產(chǎn)品的關(guān)鍵質(zhì)量屬性(CQAs)有顯著影響����。
關(guān)系示意圖如圖2所示,其基本內(nèi)容為:以預(yù)先設(shè)定的目標(biāo)產(chǎn)品質(zhì)量概況(QTPP)作為研發(fā)的起點(diǎn)�,在確定產(chǎn)品關(guān)鍵質(zhì)量屬性(CQA)基礎(chǔ)上,基于風(fēng)險(xiǎn)評估和試驗(yàn)研究�,確定關(guān)鍵物料屬性(CMA)和關(guān)鍵工藝參數(shù)(CPP)����,進(jìn)而建立能滿足產(chǎn)品性能且工藝穩(wěn)健的控制策略��,并實(shí)施產(chǎn)品和工藝生命周期管理(包括持續(xù)改進(jìn))[4]����。
圖2 CMA、CPP與CQAs關(guān)系示意圖[5]
CPP和CMA的確定是多方面��、系統(tǒng)綜合的評估研究結(jié)論��,僅基于風(fēng)險(xiǎn)評估的結(jié)論是不夠充分的��,通常需要結(jié)合經(jīng)驗(yàn)知識和一些測量或?qū)嶒?yàn)工具/方法加以驗(yàn)證確認(rèn)�。試驗(yàn)?zāi)M和實(shí)驗(yàn)設(shè)計(jì)(DOE)是分析評估并確認(rèn)CPP和CMA的有效方法和核心工具。
四�、QbD應(yīng)用的案例
天津生物工程職業(yè)技術(shù)學(xué)院陳靜[6]通過DOE的方法進(jìn)行試驗(yàn)設(shè)計(jì),以期尋找出提高原料轉(zhuǎn)化率����,減少雜質(zhì)生成的最優(yōu)工藝,更好的應(yīng)用于工業(yè)化大生產(chǎn)�,生產(chǎn)出成本低廉、優(yōu)質(zhì)的藥品��。
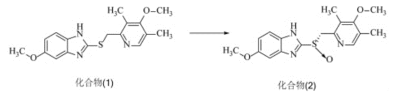
化合物(2)為S-奧美拉唑,其是由原來化合物(1)通過一步氧化反應(yīng)制備��,本步反應(yīng)中存在的主要問題是化合物1反應(yīng)不完全����,以及以下氧化雜質(zhì)較大,不易除去��,從而嚴(yán)重影響產(chǎn)品質(zhì)量��。
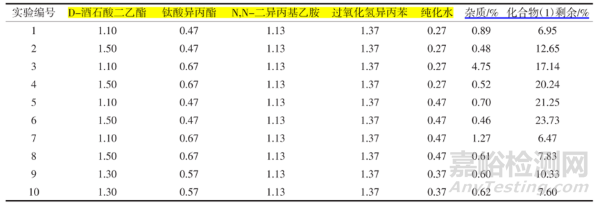
化合物(2)合成�,采用DOE設(shè)計(jì)10組不同投料比的進(jìn)行投料,分別以監(jiān)控反應(yīng)2h后的雜質(zhì)生成量及原料剩余量為指標(biāo)����,HPLC結(jié)果見表1。
表1 DOE設(shè)計(jì)10組實(shí)驗(yàn)的HPLC結(jié)果
經(jīng)過DOE軟件分析(等值線圖)可以確定的配比為化合物(1):D酒石酸二乙酯∶鈦酸異丙酯∶N,N-二異丙基乙胺∶過氧化氫異丙苯∶純化水=1.0∶1.10∶0.55∶1.13∶1.37∶0.33����。通過優(yōu)化后的實(shí)驗(yàn)進(jìn)一步驗(yàn)證了該投料比反應(yīng)液中氧化雜質(zhì)的產(chǎn)生明顯減小��,降低了反應(yīng)液中氧化雜質(zhì)大的風(fēng)險(xiǎn)��,同時(shí)使原料反應(yīng)更徹底����,可以極好的降低成本����,提高轉(zhuǎn)化率及收率����,更有利于工業(yè)化大生產(chǎn)。
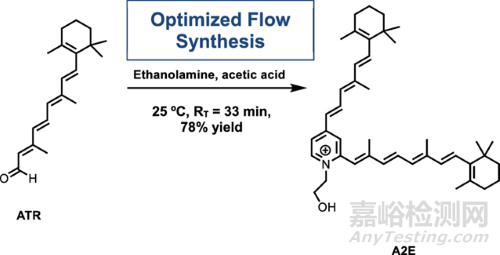
2022年����,David H. Thompson等[7]人通過實(shí)驗(yàn)設(shè)計(jì)和高通量研究指導(dǎo)N-視黃亞基-N-視黃基乙醇胺(A2E)(如圖3所示)連續(xù)流動合成。
圖3 A2E的合成路線圖
通過用實(shí)驗(yàn)設(shè)計(jì)(DoE)和高通量方法重新優(yōu)化了A2E的合成��,旨在確定變量(溫度��、溶劑和試劑當(dāng)量)的最佳組合�,以優(yōu)化A2E產(chǎn)量。他們的DoE結(jié)果分析表明����,乙醇胺與乙酸和ATR的相互作用對于高產(chǎn)率A2E的形成至關(guān)重要,表明亞胺的形成是反應(yīng)中的關(guān)鍵步驟�。有了這些DoE的結(jié)果,他們能夠使用微流體反應(yīng)器系統(tǒng)優(yōu)化方法,然后再擴(kuò)大這些條件以進(jìn)行A2E的連續(xù)流動合成��。這種改進(jìn)的方法使材料生產(chǎn)更加高效����,從48小時(shí)的反應(yīng)時(shí)間到33分鐘的停留時(shí)間,同時(shí)產(chǎn)量從49%提高到78%�。
當(dāng)然,對這方面感興趣��,或者想了解更多案例的朋友可以在Organic Process Research & Development期刊搜索Quality by Design�。
五、QbD小結(jié)
盡管21世紀(jì)初��,在美國FDA的推動下��,QbD的概念開始成為制藥行業(yè)關(guān)注的熱點(diǎn)����,但這方面國內(nèi)依然薄弱,更多的研發(fā)人員還是采用先前的那套理論方法進(jìn)行藥物工藝研究��,甚至一些藥物研發(fā)人員并沒有聽過QbD的概念�。
根據(jù)QbD的概念藥品從研發(fā)開始就要考慮最終產(chǎn)品的質(zhì)量����。在配方設(shè)計(jì)��、工藝路線確定��、工藝參數(shù)選擇�、物料控制等各個(gè)方面都要進(jìn)行深入地研究�,積累翔實(shí)的數(shù)據(jù),在透徹理解的基礎(chǔ)上確定最佳的產(chǎn)品配方和生產(chǎn)工藝����。
再往細(xì)點(diǎn)說,QbD是非常適合于原料藥工藝開發(fā)的����。因?yàn)椋纤幑に囬_發(fā)的目的是通過科學(xué)合理的方法�,建立能夠持續(xù)生產(chǎn)出預(yù)期質(zhì)量的工業(yè)化生產(chǎn)工藝。QbD理念強(qiáng)調(diào)要制定目標(biāo)��,即在原料藥工藝開發(fā)的早期環(huán)節(jié)��,就強(qiáng)調(diào)質(zhì)量控制需在可靠的科學(xué)和風(fēng)險(xiǎn)的管理基礎(chǔ)上����,對產(chǎn)品和工藝具有深刻的理解并加以控制,是一個(gè)系統(tǒng)的藥物開發(fā)方法[8]。我個(gè)人是贊同王春山先生說的那句話�,QbD理念應(yīng)用于原料藥的工藝開發(fā),必將為原料藥工藝開發(fā)的整個(gè)過程提供更加充分��、科學(xué)����、有針對性的方法和理論指導(dǎo)[3]。
參考文獻(xiàn)
[1]WEISSMAN S A, ANDERSON N G. Design of Experiments (DoE) and Process Optimization. A Review of Recent Publications[J]. Organic Process Research & Development, 2015, 19(11):1605-1633.
[2]METIL D S, SONAWANE S P, PACHORE S S, et al. Synthesis and Optimization of Canagliflozin by Employing Quality by Design (QbD) Principles[J]. Organic Process Research & Development, 2018, 22(1):27-39.
[3]王春山. 基于質(zhì)量源于設(shè)計(jì)(QbD)理念的原料藥工藝開發(fā)思路和方法[J]. 化工與醫(yī)藥工程, 2021, 42(06):30-33.
[4]郭六一. 基于質(zhì)量源于設(shè)計(jì)理念的非洛地平片一致性評價(jià)研究[D]. 浙江大學(xué), 2020.
[5]王明娟, 胡曉茹, 戴忠, et al. 新型的藥品質(zhì)量管理理念“質(zhì)量源于設(shè)計(jì)”[J]. 中國新藥雜志, 2014, 23(08):948-954.
[6]陳靜. DOE(試驗(yàn)設(shè)計(jì))在原料藥工藝優(yōu)化中的應(yīng)用[J]. 天津化工, 2021, 35(03):61-63.
[7]MURBACH-OLIVEIRA G, BANERJEE K, NOCIARI M M, et al. Continuous Flow Synthesis of A2E Guided by Design of Experiments and High-Throughput Studies[J]. ACS Bio & Med Chem Au, 2022, 2(3):297-306.
[8]劉理文. QbD在仿制藥工程的應(yīng)用路徑設(shè)計(jì)[D]. 廈門大學(xué), 2014.