《國務(wù)院辦公廳關(guān)于全面加強藥品監(jiān)管能力建設(shè)的實施意見》(國辦發(fā)[2021]16 號)[1]中指出“藥品安全事關(guān)人民群眾身體健康和生命安全”����,并提出“堅決守住藥品安全底線,更好滿足人民群眾對藥品安全的需求”“強化對藥品中危害物質(zhì)的識別與控制”的要求����。因此,加強中藥安全性質(zhì)量研究和質(zhì)量控制對于中藥研發(fā)至關(guān)重要�。
古往今來��,通過對人用經(jīng)驗的總結(jié)及對現(xiàn)代中藥的研究��,逐漸發(fā)現(xiàn)了毒性藥材�、毒性成分及其作用機(jī)制,從而建立了針對內(nèi)源性毒性成分的質(zhì)量控制方法����。同時,隨著對藥品全生命周期管理��、源頭控制�、生產(chǎn)過程控制認(rèn)識的逐漸深入,建立了針對重金屬�、農(nóng)藥殘留�、溶劑殘留等外源性污染物的預(yù)防和控制措施����。中藥是在中醫(yī)藥理論指導(dǎo)下使用的藥用物質(zhì),因此����,其在安全性質(zhì)量控制方面有自身特點。傳統(tǒng)中藥可通過配伍����、炮制等方式減毒,并且中醫(yī)理論認(rèn)為有些毒性成分同時也是中藥發(fā)揮藥效的成分�,因此對于該類成分的質(zhì)量控制也有特殊要求。本文基于中藥特點對研發(fā)過程中影響中藥質(zhì)量安全的因素以及中藥安全性質(zhì)量控制措施進(jìn)行了探討��,并提出了相關(guān)思考和建議�,以期為中藥安全性質(zhì)量研究和質(zhì)量控制提供思路。
影響中藥質(zhì)量安全的因素
中藥的質(zhì)量涵蓋從藥材�、飲片到最終制成制劑過程中的多個環(huán)節(jié),包括藥材種植或養(yǎng)殖��、采收加工��、炮制、制劑生產(chǎn)等��,根據(jù)不同研究階段的特點��,對影響中藥質(zhì)量安全的主要因素進(jìn)行了梳理����。
1.1 基原混用
在中藥的長期使用過程中,由于不同地區(qū)的用藥習(xí)慣不同��,存在同名異物��、同物異名的現(xiàn)象����,名稱相似的藥材互相代替的情況也時有發(fā)生��,從而導(dǎo)致誤用某種毒性藥材��。以木通為例����,其有多種來源,如木通 Akebiae Caulis 為木通科的木通 Akebiaquinata (Thunb.) Decne. ��、三葉木通 A. trifoliata(Thunb.) Koidz.或白木通 A. trifoliata (Thunb.) Koidz.var. australis (Diels) Rehd.的干燥藤莖�,川木通Clematidis Armandii Caulis 為毛莨科植物小木通Clematis armandii Franch. 的干燥藤莖及關(guān)木通Caulis Aristolochiae Manshuriensis 為馬兜鈴科植物東北馬兜鈴 Aristolochia manshuriensis Kom.的干燥藤莖等��。其中��,關(guān)木通含有毒性成分馬兜鈴酸��,具有腎毒性����,若誤以關(guān)木通代替木通�、川木通入藥,則可能引起毒性反應(yīng)�。2003 年 4 月 1 日,國家藥品監(jiān)督管理局發(fā)布了《國家藥品監(jiān)督管理局關(guān)于取消關(guān)木通藥用標(biāo)準(zhǔn)的通知(國藥監(jiān)注[2003]121 號)》[2]����,取消了關(guān)木通(馬兜鈴科)的藥用標(biāo)準(zhǔn),并要求將國家標(biāo)準(zhǔn)處方中的關(guān)木通替換為“木通(木通科)”�,《中國藥典》也自 2005 年版起未再收錄關(guān)木通。除此以外����,山豆根 Sophorae Tonkinensis Radix et Rhizoma 與北豆根 Menispermi Rhizoma、五加皮 AcanthopanacisCortex 與香加皮 Periplocae Cortex��、何首烏 PolygoniMultiflori Radix 與黃藥子 Rhizoma DioscoreaeBulbiferae 也易發(fā)生混用,可能帶來安全性問題����。來源于天然的中藥存在物種多樣性、近緣性等復(fù)雜因素��,因此制備中藥所用藥材基原的準(zhǔn)確性對于預(yù)防�、減少不良反應(yīng)的發(fā)生至關(guān)重要。
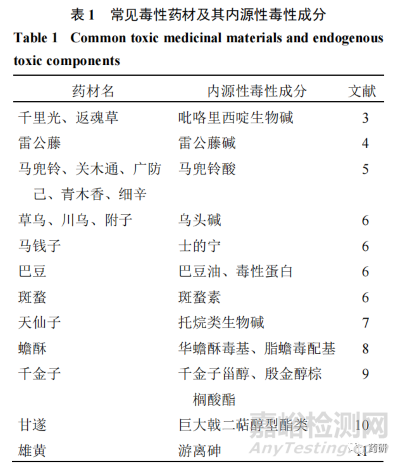
1.2 內(nèi)源性毒性成分
古人在用藥過程中逐漸發(fā)現(xiàn)了中藥的毒性并對其進(jìn)行分類����,《神農(nóng)本草經(jīng)》按照“三品分類法”將收錄的 365 種中藥分為上、中����、下三品:上品無毒,久服不傷人�;中品無毒有毒,斟酌其宜����;下品多毒����,不可久服。《中國藥典》沿用歷代本草記載��,將毒性藥味分為“有大毒”“有毒”“有小毒”3 類�,作為臨床用藥的警示性參考,如川烏 Aconiti Radix�、馬錢子 Strychni Semen、天仙子 Hyoscyami Semen 等按照藥典毒性分類屬于“有大毒”的藥味��。隨著科技的進(jìn)步和研究的深入�,通過不良反應(yīng)事件溯源和現(xiàn)代毒理研究總結(jié),發(fā)現(xiàn)了毒性藥味中的毒性成分�,常見的毒性藥味及毒性成分見表 1。對內(nèi)源性毒性成分的控制是保證中藥安全性的關(guān)鍵��,考慮到傳統(tǒng)中醫(yī)理論認(rèn)為中藥的“毒性”也是其發(fā)揮藥效作用的“偏性”����,因此內(nèi)源性毒性成分的質(zhì)量控制有其自身特點。
1.3 外源性污染物
中藥毒性并不都源自藥材本身����,由于中藥是由天然的植物、動物�、礦物加工制備而成,因此可能引入重金屬��、農(nóng)藥殘留、真菌毒素��、樹脂殘留����、溶劑殘留、微生物等外源性污染物��。其來源主要有 2種途徑��,一是在藥材種植過程中使用的農(nóng)藥和植物生長調(diào)節(jié)劑��、受土壤等自然因素影響而蓄積的重金屬�、放置過程中因儲存不當(dāng)而產(chǎn)生的微生物和真菌毒素及貯藏養(yǎng)護(hù)過程中使用的熏蒸劑和殺蟲劑[12]等。二是藥材在制成制劑的過程中��,經(jīng)提取�、純化等一系列制備工藝處理后殘留的有機(jī)溶劑、樹脂等有害物質(zhì)�。因此,在中藥研發(fā)過程中應(yīng)重視藥材源頭控制和生產(chǎn)過程控制��,使制劑中所含外源性污染物的量最小化�,從而降低中藥的安全性風(fēng)險�。
中藥安全性相關(guān)質(zhì)量控制措施
藥材��、飲片�、制劑的全過程質(zhì)量控制是目前中藥研發(fā)所倡導(dǎo)的理念�,源頭控制[13]、生產(chǎn)過程控制等針對不同階段的質(zhì)量控制措施貫穿始終��,目的是為了保障制劑安全����、有效、質(zhì)量可控�。因此,中藥安全性相關(guān)質(zhì)量控制措施的建立也需要依托全鏈條質(zhì)量控制的思路����,針對不同研發(fā)階段可能涉及的影響中藥安全性的因素建立相應(yīng)的質(zhì)控手段。
2.1 正本清源��,保證藥材基原準(zhǔn)確
《中藥新藥研究各階段藥學(xué)研究技術(shù)指導(dǎo)原則(試行)》[14]中提出����,在申請臨床試驗時藥材基原應(yīng)“明確”,III 期臨床試驗前�、申請上市時基原應(yīng)“固定”,明確了中藥新藥用藥材的基原是通過研究逐漸固定下來的����,從而實現(xiàn)正本清源的目的�,為保證不同研究階段樣品與申請上市制劑的質(zhì)量一致提供了基礎(chǔ)�。因此,在中藥新藥的研發(fā)過程中應(yīng)關(guān)注所用藥材基原的準(zhǔn)確性��,避免出現(xiàn)因基原有誤或不同基原混用而引發(fā)安全性問題����。同時,應(yīng)重視基原鑒定工作����,對于基原易混淆品種,注冊申報時需提供藥材基原鑒定報告��,并提供基原選用的依據(jù)����,建議研究建立區(qū)別易混淆品種的專屬性檢測方法。
新疆����、西藏地處我國邊境,與多國為鄰�,地理位置具有特殊性�,因此從國外進(jìn)口藥材的情況較為普遍�,部分進(jìn)口藥材品種來源復(fù)雜����、基原混亂、基礎(chǔ)研究薄弱�,對于此類藥材毒性的認(rèn)識尚不全面[15-16]。2019 年 5 月 16 日����,國家市場監(jiān)管總局發(fā)布了《進(jìn)口藥材管理辦法》[17],法規(guī)中明確規(guī)定了首次進(jìn)口藥材的備案資料要求��,其中包括進(jìn)口藥材的基原鑒定資料:需提供由中國境內(nèi)具有動����、植物基原鑒定資質(zhì)的機(jī)構(gòu)出具的載有鑒定依據(jù)、鑒定結(jié)論��、樣品圖片����、鑒定人、鑒定機(jī)構(gòu)及其公章等信息的藥材基原鑒定證明原件��。因此,研發(fā)過程中如需使用進(jìn)口藥材的�,應(yīng)加強對進(jìn)口藥材的溯源、管理和研究����,關(guān)注基原的準(zhǔn)確性和藥材的不良反應(yīng)。
2.2 根據(jù)內(nèi)源性毒性成分類型��,建立有針對性的質(zhì)控措施
對于含有毒性成分的藥材��,部分法定藥材標(biāo)準(zhǔn)中針對毒性成分明確的藥材建立了相應(yīng)的質(zhì)量控制方法��,并根據(jù)毒性成分是否同時為藥效成分質(zhì)控要求有所不同�,如烏頭堿類成分既是附子的毒性成分又是其藥效成分,《中國藥典》2020 年版附子藥材標(biāo)準(zhǔn)中建立了毒性成分雙酯型生物堿的限量檢查方法�,規(guī)定“本品含雙酯型生物堿以新烏頭堿、次烏頭堿和烏頭堿的總量計��,不得過 0.020%”��,另外還建立了 3 種單酯型生物堿的含量測定方法�,規(guī)定“本品按干燥品計算,含苯甲酰新烏頭原堿�、苯甲酰烏頭原堿、苯甲酰次烏頭原堿的總量,不得少于0.010%”[18]��。礦物藥雄黃中有效成分為二硫化二砷��,毒性成分為三價砷和五價砷����,《中國藥典》2020 年版雄黃藥材標(biāo)準(zhǔn)中建立了三價砷和五價砷的限量檢查項�,規(guī)定“本品含三價砷和五價砷的總量以砷計,不得過 7.0%”��,建立了二硫化二砷含量測定項��,規(guī)定“本品含砷量以二硫化二砷計不得少于 90.0%”[18]����。
對于處方中含有毒性藥味的中藥復(fù)方制劑新藥,已發(fā)布的相關(guān)指導(dǎo)原則[19-20]中明確了針對內(nèi)源性毒性成分的質(zhì)量研究要求�,提出了對于含毒性成分明確的藥味,若為毒性成分而非藥效成分����,應(yīng)建立毒性成分的限量檢查方法,明確安全限量或規(guī)定不得檢出��,其限度可根據(jù)相應(yīng)的毒理學(xué)或文獻(xiàn)研究資料合理制定;既是毒性成分又是藥效成分時����,則應(yīng)根據(jù)文獻(xiàn)報道和安全性、有效性研究結(jié)果制定毒性成分的含量范圍(上下限)�。對于含毒性明確但毒性成分尚不明確的藥味時,應(yīng)根據(jù)中醫(yī)藥理論和臨床傳統(tǒng)使用方法�,研究確定其安全劑量范圍,或開展毒性成分的確定性研究和藥用物質(zhì)毒理的深入研究��,加強質(zhì)量控制����。中藥新藥質(zhì)量標(biāo)準(zhǔn)研究是一個動態(tài)的過程,隨著新藥研究的不斷推進(jìn)而逐步完善����。因此,在臨床試驗前應(yīng)著重研究建立包括毒性成分在內(nèi)的主要指標(biāo)的檢測方法�,質(zhì)量標(biāo)準(zhǔn)涉及安全性的指標(biāo)應(yīng)盡可能全面。由于中藥成分復(fù)雜��,不良反應(yīng)有時并非由藥物中的原型物質(zhì)產(chǎn)生��,而是某個成分的代謝產(chǎn)物導(dǎo)致��,或某個成分進(jìn)入人體后影響人體正常代謝等[21],建議加強代謝����、毒理等多學(xué)科交叉研究,明確毒性反應(yīng)的作用機(jī)制����,從而有針對性地建立相關(guān)質(zhì)量控制方法。
對于已上市多年的品種�,由于上市時間較早,質(zhì)量標(biāo)準(zhǔn)中可能缺少針對內(nèi)源性毒性成分的質(zhì)量控制方法����,因此需逐步完善安全性相關(guān)檢測項目��,健全質(zhì)量標(biāo)準(zhǔn)�。對于毒性成分明確且檢測方法成熟的,可在質(zhì)量標(biāo)準(zhǔn)中增訂相應(yīng)的質(zhì)控項目��。以“九味羌活丸”為例�,該品種自 1977 年開始收載于《中國藥典》,其處方中含有馬兜鈴科的細(xì)辛且制備工藝為全粉入藥��,但至《中國藥典》2015 版均未建立馬兜鈴酸的限量檢查方法�。直到《中國藥典》2020 年版發(fā)布,九味羌活丸質(zhì)量標(biāo)準(zhǔn)項下新增了馬兜鈴酸 I 的液相質(zhì)譜聯(lián)用限量檢查方法,對馬兜鈴酸碎片離子的特征峰進(jìn)行測定��,規(guī)定:“應(yīng)不得同時出現(xiàn)與對照品色譜保留時間一致的色譜峰�;若同時出現(xiàn),則供試品中 m/z 359.0→298.0 的色譜峰應(yīng)小于對照品色譜峰(20 ng/mL)”[18]��。自此����,九味羌活丸質(zhì)量標(biāo)準(zhǔn)中安全性相關(guān)檢測項目得以完善。
另外��,已上市中藥在進(jìn)行變更研究時同樣應(yīng)關(guān)注處方中含毒性藥味的情況��,以及變更對藥品安全性的影響�,有針對性地開展研究,具體要求可參考《已上市中藥藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》[22]�。
2.3 落實源頭控制和生產(chǎn)過程控制,降低外源性污染物的安全性風(fēng)險
藥材作為中藥生產(chǎn)的源頭對于中藥的質(zhì)量和安全至關(guān)重要��,正所謂“藥材好��,藥才好”����。曾經(jīng)��,為預(yù)防病蟲害��、增大產(chǎn)量而濫用農(nóng)藥�、植物生產(chǎn)調(diào)節(jié)劑����、熏蒸劑、殺蟲劑等�,未考慮不合理使用對藥材質(zhì)量以及制劑安全性的影響。隨著時代的進(jìn)步和觀念的更新��,藥材外源性有害殘留物的安全性問題逐漸受到了關(guān)注�。農(nóng)業(yè)部于 2002 年發(fā)布公告,明確了停止使用的農(nóng)藥種類�,以及不得用于中藥材的農(nóng)藥[23]。2022 年發(fā)布的新版《中藥材生產(chǎn)質(zhì)量管理規(guī)范》第五十條規(guī)定:“禁止使用國務(wù)院農(nóng)業(yè)農(nóng)村行政主管部門禁止使用的劇毒�、高毒�、高殘留農(nóng)藥,以及限制在中藥材上使用的其他農(nóng)藥����;禁止使用壯根靈、膨大素等生長調(diào)節(jié)劑調(diào)節(jié)中藥材收獲器官生長”����。第一百零六條規(guī)定:“明確貯存的避光��、遮光��、通風(fēng)����、防潮�、防蟲、防鼠等養(yǎng)護(hù)管理措施�;使用的熏蒸劑不能帶來質(zhì)量和安全風(fēng)險,不得使用國家禁用的高毒性熏蒸劑����;禁止貯存過程使用硫磺熏蒸”[24]?���!吨袊幍洹纷?2000 年版在甘草、黃芪藥材標(biāo)準(zhǔn)中增加了9 種有機(jī)氯農(nóng)藥的限量檢查項����,并在附錄中增加了“有機(jī)氯類農(nóng)藥殘留量測定法”;《中國藥典》自 2015年版起“藥材和飲片檢定通則”增加了針對二氧化硫殘留量的規(guī)定:藥材及飲片(礦物類除外)的二氧化硫殘留量不得過 150 mg/kg�。隨著藥典版本的更新��,更多的農(nóng)藥種類和先進(jìn)方法被收載����,《中國藥典》中關(guān)于有害殘留物的質(zhì)量控制體系正處于逐步建立完善的過程中[25]����。因此,中藥新藥的研發(fā)應(yīng)加強藥材源頭控制��,參照《中藥材生產(chǎn)質(zhì)量管理規(guī)范》的要求進(jìn)行藥材種植養(yǎng)殖��,加強對藥材外源性污染物的研究��。根據(jù)農(nóng)業(yè)投入品的使用情況以及藥材的自身特點進(jìn)行風(fēng)險評估��,對農(nóng)藥��、真菌毒素��、養(yǎng)護(hù)用熏蒸劑和殺蟲劑等有害殘留物進(jìn)行限量檢測��,制定合理的限度要求�,從源頭降低中藥潛在的安全隱患�。對于是否需要在制劑質(zhì)量標(biāo)準(zhǔn)中建立針對藥材所用農(nóng)業(yè)投入品及可能含有的真菌毒素的檢測項目����,還需結(jié)合藥材����、飲片、制劑生產(chǎn)過程中的量質(zhì)傳遞情況����,對指標(biāo)成分的影響、制劑自身特點以及殘留物可能引發(fā)的安全性風(fēng)險等綜合評估判斷��。原粉入藥的制劑由于藥材粉末未經(jīng)提取等溶劑��、高溫的處理而直接制成制劑����,藥材或飲片在貯藏過程中產(chǎn)生的微生物負(fù)載過高可能會轉(zhuǎn)移到制劑中而導(dǎo)致制劑微生物超標(biāo),因此����,在原料前處理時應(yīng)結(jié)合藥材中成分類型采用合理的方法、設(shè)備�、條件等降低微生物污染水平[26]。
另外�,中藥生產(chǎn)過程中使用的溶媒��、樹脂等材料的殘留也會影響中藥的安全性��?�!吨袊幍洹分苿┩▌t“0861 殘留溶劑檢測方法”中規(guī)定了藥品常見的殘留溶劑種類及限度要求��,將溶劑分為 3 類����,第1 類為應(yīng)該避免使用的溶劑��,第 2 類為應(yīng)該限制使用的溶劑��,第 3 類為《藥品生產(chǎn)質(zhì)量管理規(guī)范》或其他質(zhì)量要求限制使用的溶劑��?���;诖耍谥兴幮滤幍难邪l(fā)過程中應(yīng)合理選擇溶媒�,根據(jù)具體品種的工藝步驟對生產(chǎn)過程中溶劑殘留情況進(jìn)行研究,盡量降低溶劑殘留量�。另外,由于中藥組成及成分復(fù)雜�,存在為富集某一類成分而進(jìn)行必要的純化處理的情況,樹脂則是最常見的純化材料�。樹脂中含有未聚合的單體、交聯(lián)劑����、致孔劑等,且樹脂種類�、型號較多,骨架結(jié)構(gòu)存在差異��,因此一般應(yīng)根據(jù)所使用樹脂的類型在制劑質(zhì)量標(biāo)準(zhǔn)中建立針對其殘留物及裂解產(chǎn)物的限量檢查方法�。
2.4 規(guī)范毒性藥味的炮制研究
“炮制”是中藥區(qū)別于國外植物藥的一大特色����,對于降低藥材的不良反應(yīng)具有重要意義��。在中藥的長期使用過程中��,通過總結(jié)用藥經(jīng)驗����,針對一些毒性藥材形成了特定的減毒炮制工藝�,如雄黃、朱砂水飛,巴豆����、千金子制霜,半夏姜炙�,斑蝥、紅娘子米炒��,馬錢子砂炒等�。有的毒性飲片具有多種炮制規(guī)格,如附子的炮制品包括黑順片��、白順片�、淡附片、炮附子等����,炮制工藝不同,炮制用輔料也有區(qū)別�,但均通過炮制降低藥材的毒性?���!吨袊幍洹?020 年版四部“0213 炮制通則”中規(guī)定了常用的炮炙方法和要求,包括炒(清炒�、麩炒����、砂炒��、蛤粉炒��、滑石粉炒)��、炙法(酒炙�、醋制�、鹽炙、姜炙��、蜜炙��、油炙)����、制炭(炒炭、煅炭)�、煅(明煅、煅淬)��、蒸����、煮��、燉����、煨��,除此以外還有燀法����、制霜(去油成霜)、水飛��、發(fā)芽�、發(fā)酵。除藥典規(guī)定的常用炮炙工藝��,藏藥����、維藥等民族藥在用藥過程中形成了一些特殊的炮制減毒方法,如維藥中采用牛奶浸漬的方法將馬錢子炮制成“奶制馬錢子”[27]�,蒙藥中使用訶子湯對烏頭進(jìn)行炮制[28]。毒性飲片的炮制工藝一般較為復(fù)雜����,炮制不到位����、不規(guī)范可能會影響藥效的保留和毒性的降低����,因此炮制工藝的合理性和規(guī)范性顯得尤為重要?���!吨袊幍洹泛偷胤脚谥埔?guī)范對于炮制火候��、炒制程度等工藝步驟的描述往往相對簡單��,因此研究中應(yīng)進(jìn)一步細(xì)化炮制工藝參數(shù)��,如炮制輔料的用量��、炮制終點的判斷等��,不應(yīng)僅憑經(jīng)驗確定炮制工藝����。對于尚無國家標(biāo)準(zhǔn)和地方炮制規(guī)范收載的炮制品�,應(yīng)通過炮制工藝研究確定炮制工藝路線及關(guān)鍵工藝參數(shù)��、炮制用輔料等�,并采用合理的指標(biāo)對炮制程度、飲片質(zhì)量等進(jìn)行評價�,建立飲片質(zhì)量標(biāo)準(zhǔn)。炮制過程中應(yīng)平衡好毒性和藥效的關(guān)系����,確保炮制工藝的規(guī)范性和合理性。
另外�,硫熏作為一種傳統(tǒng)的加工方法常用于對藥材、飲片的處理��,尤其是對于淀粉����、多糖含量較高的藥材,可以提高干燥效率����,降低因干燥時間過長而產(chǎn)生具有毒性的真菌毒素的風(fēng)險[29]。由于二氧化硫同時也是一種毒性物質(zhì)�,因此需結(jié)合其對制劑質(zhì)量、藥效等的影響規(guī)定二氧化硫的合理殘留限量��。《中國藥典》2020 年版四部通則規(guī)定了藥材及飲片的二氧化硫殘留限量不得過 150 mg/kg��,對于毛山藥�、光山藥、天冬��、天花粉����、天麻、牛膝�、白及、白術(shù)�、白芍��、黨參����、粉葛的二氧化硫殘留量相應(yīng)的質(zhì)量標(biāo)準(zhǔn)中規(guī)定不得過 400 mg/kg,山藥片不得過10 mg/kg��。
思考與建議
3.1 重視人用經(jīng)驗對中藥安全性質(zhì)量控制的重要作用
為加強對古典醫(yī)籍精華的梳理和挖掘��,改革完善中藥的審評審批機(jī)制����,促進(jìn)中藥新藥研發(fā)和產(chǎn)業(yè)發(fā)展��,2020 年 9 月 28 日國家藥品監(jiān)督管理局發(fā)布了《中藥注冊分類及申報資料要求》[30]將古代經(jīng)典名方中藥復(fù)方制劑單獨分類�,并細(xì)分為“3.1 按古代經(jīng)典名方目錄管理的中藥復(fù)方制劑”及“3.2 其他來源于古代經(jīng)典名方的中藥復(fù)方制劑”�,3.1 和 3.2 類均需進(jìn)行藥學(xué)及非臨床安全性研究,3.2 類還需對中藥人用經(jīng)驗進(jìn)行系統(tǒng)總結(jié)��,并對藥物臨床價值進(jìn)行評估��。古代經(jīng)典名方中藥復(fù)方制劑是尊重中藥研發(fā)規(guī)律的重要體現(xiàn)��,也是構(gòu)建符合中藥特點的“三結(jié)合”審評證據(jù)體系[31]的關(guān)鍵所在��。
古籍關(guān)鍵信息考證以及臨床實踐所用制劑相關(guān)信息收集��、整理的準(zhǔn)確性�,對于保證含有毒性藥味的古代經(jīng)典名方中藥復(fù)方制劑的安全性和有效性具有重要意義。已發(fā)布的《古代經(jīng)典名方目錄(第一批)》[32]的部分處方中含有毒性藥味附子��、半夏��,關(guān)于炮制有如下表述:“附子一枚(炮��,去皮��,破八片)”“附子(炮)”“附子(炮、去皮臍)”“半夏(湯洗)”等�。目錄中未明確具體的炮制方法,因此建議參考已發(fā)布的《古代經(jīng)典名方關(guān)鍵信息考證原則》開展考證工作[33]����,保證考證信息準(zhǔn)確。處方來源于臨床經(jīng)驗方����、醫(yī)療機(jī)構(gòu)制劑的,如擬按“基于古代經(jīng)典名方加減化裁的中藥復(fù)方制劑”申報����,應(yīng)保證處方組成(如基原、炮制��、劑量)��、制備工藝等與臨床實踐所用制劑一致�?���?紤]到臨床醫(yī)生開具處方時可能存在處方寫生品付炮制品的情況,因此�,在對臨床實踐所用制劑信息收集�、整理時應(yīng)關(guān)注“處方應(yīng)付”問題����。
人用經(jīng)驗對于中藥新藥注冊申請的支持作用是以注冊申報的處方、工藝等與臨床實踐基本一致為基礎(chǔ)����,如臨床實踐所用制劑為傳統(tǒng)水煎工藝,申報注冊時工藝變化較大�,則可能對制劑安全性產(chǎn)生不利影響。以某一含補骨脂的中藥復(fù)方制劑新藥為例����,原臨床經(jīng)驗方為水煎工藝,注冊申報時補骨脂改為醇提����,導(dǎo)致具有肝毒性的香豆素類成分富集,增加了藥物的安全性風(fēng)險[34]��。
3.2 重視毒理研究用樣品的研究
非臨床安全性評價對于中藥毒性的發(fā)現(xiàn)及安全性相關(guān)質(zhì)量控制措施的建立具有重要作用����,毒理研究用樣品更是保證試驗結(jié)果科學(xué)、可靠的關(guān)鍵所在。因此����,應(yīng)在前期藥學(xué)研究確定處方、工藝等的基礎(chǔ)上制備毒理研究用受試物�,受試物應(yīng)能充分代表臨床試驗用樣品和申請上市樣品的質(zhì)量屬性和安全性,為滿足試驗需要而特殊制備受試物的��,其改變不應(yīng)引起藥用物質(zhì)基礎(chǔ)和吸收利用的明顯變化�。應(yīng)研究建立受試物的質(zhì)量標(biāo)準(zhǔn),其中安全性相關(guān)的檢測項目應(yīng)盡可能全面�,檢測指標(biāo)應(yīng)能反映受試物的質(zhì)量屬性和安全性,并應(yīng)重點考察對藥物安全性��、有效性有較大影響的指標(biāo)�。另外,應(yīng)加強研究過程的質(zhì)量控制和過程管理�,建立毒理研究用樣品檔案,保證樣品的可溯源性�。由于中藥組成及成分復(fù)雜,劑型及給藥途徑多樣����,為滿足試驗需求應(yīng)具體問題具體分析�,有針對性地開展研究。可結(jié)合毒理試驗結(jié)果查找影響產(chǎn)品安全性的因素�,從而制定相應(yīng)的質(zhì)量控制措施。
3.3 加強中藥安全性風(fēng)險識別�、管理和控制
中藥安全性風(fēng)險識別貫穿中藥研發(fā)的整個過程,應(yīng)通過全局觀的質(zhì)量設(shè)計查找影響中藥安全性的風(fēng)險因素����,加強藥材種植和采收、飲片炮制����、工藝研究、制劑生產(chǎn)等多個環(huán)節(jié)的安全性風(fēng)險管理和防控��。
藥材研究階段應(yīng)保證藥材基原準(zhǔn)確�,避免出現(xiàn)易混淆品;加強對農(nóng)藥等有害污染物的跟蹤監(jiān)測��,包括藥材種植過程中農(nóng)藥��、化肥等投入品的使用情況�,產(chǎn)地加工過程可能引入的二次污染,可能發(fā)生的重金屬及有害元素��、真菌毒素等污染風(fēng)險��;根據(jù)具體情況制定外源性污染物的風(fēng)險控制策略。飲片炮制過程中應(yīng)關(guān)注炮制工藝的規(guī)范性����、炮制評價指標(biāo)選擇的合理性,按照確定的炮制工藝標(biāo)準(zhǔn)化操作規(guī)程進(jìn)行炮制��,避免因過度炮制或炮制不到位影響藥效和安全性����。在工藝研究階段應(yīng)根據(jù)品種特點合理選擇溶媒、生產(chǎn)過程中材料��,對于具有人用經(jīng)驗的品種可結(jié)合臨床實踐所用制劑情況研究確定注冊申報制劑的工藝����。對于影響中藥安全性的內(nèi)源性毒性成分,應(yīng)考察毒性成分在藥材-飲片-制劑中的量質(zhì)傳遞規(guī)律����,綜合評估毒-效關(guān)系,制定質(zhì)量控制方法并規(guī)定合理的含量限度或限度范圍[35]�。對于處方中含有毒性藥味,但質(zhì)量標(biāo)準(zhǔn)中尚缺乏相關(guān)質(zhì)控項目的已上市品種����,建議根據(jù)所含毒性藥味的情況建立合理的質(zhì)控方法并視情況修訂質(zhì)量標(biāo)準(zhǔn)�,如發(fā)生工藝��、輔料等變更�,應(yīng)考慮變更對藥品安全性的影響����。
3.4 加強基礎(chǔ)研究,科學(xué)制定質(zhì)控策略
中藥來源多樣����,組成及成分復(fù)雜,對于中藥毒性的認(rèn)識還處于不斷探索和發(fā)現(xiàn)的過程��。因此��,加強基礎(chǔ)研究對于中藥安全性質(zhì)量控制至關(guān)重要����。近年來,科技帶動產(chǎn)學(xué)研發(fā)展��,越來越多的新技術(shù)��、新研究模式被用于中藥毒性成分的發(fā)現(xiàn)以及作用機(jī)制的研究����。崔鶴蓉等[36]創(chuàng)建了臨床“有毒”中藥數(shù)智融合研究模式以及藥物聯(lián)用風(fēng)險智能預(yù)測方法�,辨識“有毒”中藥的臨床特征及潛在風(fēng)險��;陳穎等[37]采用斑馬魚模型考察了 26 種常見骨傷科相關(guān)藥味的安全性����,發(fā)現(xiàn)其中續(xù)斷、知母����、補骨脂、制何首烏等 13 種藥味水煎液有一定或潛在毒性����,致斑馬幼魚臟器形態(tài)明顯改變;Li 等[38]采用基因芯片技術(shù)研究黃秦艽對雪上一枝蒿小鼠肝毒性的作用機(jī)制�,結(jié)果表明,黃秦艽可通過調(diào)節(jié)氧化應(yīng)激����、炎癥損傷和細(xì)胞凋亡/壞死途徑減輕雪上一枝蒿誘導(dǎo)的小鼠肝損傷。另外�,類器官芯片技術(shù)也開始被用于藥物毒性的研究[39]。通過基礎(chǔ)研究的開展可以促進(jìn)中藥安全性(毒性)數(shù)據(jù)庫的構(gòu)建����,從而進(jìn)一步探索將研究成果轉(zhuǎn)化為安全性質(zhì)量控制方法的可行性�,科學(xué)制定相關(guān)質(zhì)量控制策略����,為保障中藥用藥安全提供基礎(chǔ)����。
結(jié)語
中藥的全生命周期包括研發(fā)、注冊����、上市、上市后等多個階段�,符合中藥特點的安全性相關(guān)質(zhì)量研究和質(zhì)量控制應(yīng)貫穿始終。藥品上市許可持有人作為藥品安全的第一責(zé)任人��,一方面應(yīng)提高質(zhì)量意識和安全意識�,重視安全性風(fēng)險識別,強化風(fēng)險意識和風(fēng)險評估��,建立科學(xué)的管理體系��;另一方面應(yīng)落實藥品全生命周期管理����,加強源頭控制����、生產(chǎn)過程控制����,建立全過程質(zhì)量控制體系。通過具有前瞻性的質(zhì)量設(shè)計以及全局觀的質(zhì)量控制����,使中藥安全性得到有力保障,確?���;颊哂盟幇踩?/span>