近年來����,心衰治療正處于一個發(fā)展和變革的時代。對新機制��、新藥物的研究如火如荼����,使多機制、多通路早期聯(lián)合治療的新理念正在不斷鞏固�。
沙庫巴曲纈沙坦��,是首個血管緊張素受體腦啡肽酶抑制劑(ARNI)類藥物����,也是全球首款心衰治療領(lǐng)域的突破性創(chuàng)新藥物��。
資料顯示�,沙庫巴曲纈沙坦是一種心血管系統(tǒng)用藥,臨床上主要用于治療慢性心力衰竭��。本品是由沙庫巴曲(腦啡肽酶抑制劑)和纈沙坦(血管緊張素受體拮抗劑)組成的復(fù)方制劑�,通過LBQ657(前藥沙庫巴曲的活性代謝產(chǎn)物)抑制腦啡肽酶(中性肽鏈內(nèi)切酶;NEP)����,增加腦啡肽酶所降解的肽類水平(例如利鈉肽)。同時通過纈沙坦阻斷血管緊張素II的1型受體(AT1)��,在心力衰竭患者中沙庫巴曲纈沙坦鈉可產(chǎn)生心血管和腎臟作用�,此時還可抑制血管緊張素II依賴性醛固酮釋放。
據(jù)了解����,沙庫巴曲纈沙坦由瑞士諾華研發(fā),原研產(chǎn)品沙庫巴曲纈沙坦鈉片于2015年7月獲得FDA批準(zhǔn)上市�,為全球首款治療心衰創(chuàng)新藥��。2017年7月��,沙庫巴曲纈沙坦鈉片首次獲批進入國內(nèi)市場,2019年通過談判納入全國醫(yī)保乙類目錄��,2021年成功續(xù)簽����,并新增原發(fā)性高血壓適應(yīng)癥。
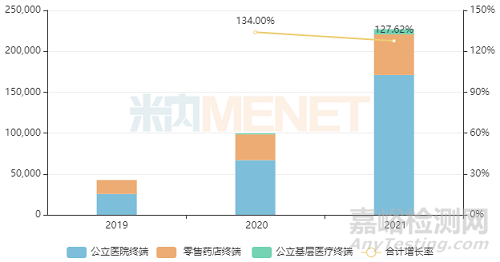
米內(nèi)網(wǎng)數(shù)據(jù)顯示�,原研產(chǎn)品沙庫巴曲纈沙坦鈉片2021年全球銷售額達35.48億美元。且該產(chǎn)品近年來在中國三大終端6大市場的銷售額增速均達三位數(shù)�,2021年首次突破20億元,同比增長127.62%�,市場潛力十足。
近年來中國三大終端6大市場沙庫巴曲纈沙坦鈉片銷售情況(單位:萬元)
(來源:米內(nèi)網(wǎng)數(shù)據(jù))
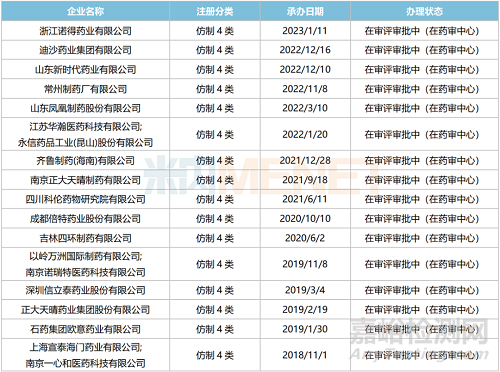
此外,米內(nèi)網(wǎng)數(shù)據(jù)顯示����,目前國內(nèi)有超10家企業(yè)以仿制4類提交沙庫巴曲纈沙坦鈉片上市申請,其中上海宣泰海門/一心和最早報產(chǎn)�,其上市申請于2018年11月獲得CDE承辦受理����,目前正處于第二輪資料發(fā)補����。此外�,石藥歐意、正大天晴����、信立泰等企業(yè)的產(chǎn)品處于第一輪資料發(fā)補��。
沙庫巴曲纈沙坦鈉片新分類報產(chǎn)情況
(來源:米內(nèi)網(wǎng)數(shù)據(jù))
隨著我國人口老齡化加劇,冠心病����、高血壓等慢性病的發(fā)病率逐年上升�,心衰作為心血管疾病“最后的戰(zhàn)場”,其患病率及死亡率一直居高不下����。
據(jù)悉,我國成年人心衰患病率達1.3%�。截至2021年底,我國60歲以上的老年人口已達2.67億�,而心衰的發(fā)病率和患病率均隨年齡增加, 80歲以上人群心衰患病率可達近12%��。隨著我國人口老齡化加劇��,冠心病����、高血壓�、糖尿病��、肥胖等慢性病的發(fā)病呈上升趨勢�,醫(yī)療水平的提高使心臟疾病患者生存期延長,導(dǎo)致我國心衰患病率呈持續(xù)升高趨勢����。根據(jù)弗若斯特沙利文公布的數(shù)據(jù),2019年我國心衰患者人數(shù)約為1067.8 萬人����,預(yù)計2030年達到1614.0萬人。
目前����,藥物治療是防治慢性心衰的一線療法,而沙庫巴曲纈沙坦是目前指南中推薦的一線藥物��。臨床研究表明�,沙庫巴曲纈沙坦比傳統(tǒng)的ACEI或者ARB藥物的療效更為顯著和持久,可以明顯減少慢性心衰患者的死亡率����,明顯改善患者的生活質(zhì)量�。
然而�,在采用標(biāo)準(zhǔn)治療方案情況下,心力衰竭仍是致命的臨床頑疾��,心衰治療市場仍存在巨大而未被滿足的臨床需求��。
藥品進口備案不斷優(yōu)化�,國內(nèi)患者有望更快獲得進口新藥
近日,廣東省藥監(jiān)局印發(fā)《藥品監(jiān)督管理局關(guān)于優(yōu)化藥品進口備案工作的指導(dǎo)意見》的通知�。《意見》中提了優(yōu)化藥品進口備案流程��、推動大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新����、持續(xù)強化藥品進口備案監(jiān)管等內(nèi)容�。
其中,對于進口業(yè)務(wù)量大��、信用記錄良好的進口單位����,《意見》明確首次申請進口備案時應(yīng)現(xiàn)場核驗《藥品注冊證書》(或者《醫(yī)藥產(chǎn)品注冊證》)(正本或者副本)原件。上述進口單位后續(xù)申請同一進口藥品備案的�,無需前往口岸局現(xiàn)場提供《藥品注冊證書》原件。
進口藥品發(fā)生處方工藝、質(zhì)量標(biāo)準(zhǔn)��、生產(chǎn)場地等質(zhì)量安全性相關(guān)事項變更的��,應(yīng)按首次進口辦理�。進口單位申請生物制品以及首次進口藥品進口備案,經(jīng)抽樣檢驗符合標(biāo)準(zhǔn)規(guī)定的�,藥品口岸監(jiān)管機構(gòu)出具檢驗報告以及啟封文書后,允許進口單位直接解封上市�。
此外,還明確了進口備案工作時限要求��。各口岸局應(yīng)嚴(yán)格執(zhí)行《藥品進口管理辦法》有關(guān)規(guī)定�,在備案材料受理后1個工作日出具《進口藥品通關(guān)單》。
據(jù)了解�,廣東省這幾年其實一直在不斷優(yōu)化藥品進口備案工作,在2022年11月印發(fā)的《廣州市全面加強藥品監(jiān)管能力建設(shè)具體措施》中��,就提出過優(yōu)化完善藥品進口備案�、第一類醫(yī)療器械備案、普通化妝品備案的技術(shù)核查機制和決策機制等內(nèi)容��。
而除了廣東省����,還有不少省市近年來在推進藥品監(jiān)管同時�,也在不斷優(yōu)化完善藥品進口備案��。如2022年9月�,海南省出臺了《海南自由貿(mào)易港藥品進口便利化若干規(guī)定》,于12月1日起施行��?�!度舾梢?guī)定》堅持推進藥品進口通關(guān)便利化和強化藥品質(zhì)量事中事后監(jiān)管理念����,取消進口藥品通關(guān)單、調(diào)整備案時間��、優(yōu)化通關(guān)流程��,并免費為企業(yè)提供通關(guān)憑證��,同時強調(diào)企業(yè)主體責(zé)任��,強化藥品安全監(jiān)管措施����。
2021年3月12日����,?���?谑惺袌霰O(jiān)督管理局發(fā)布《關(guān)于進一步優(yōu)化<進口藥品通關(guān)單>備案行政審批的公告》(以下簡稱《公告》)����,明確自當(dāng)日起,?�?谑修k理的《進口藥品通關(guān)單》備案行政審批事項可實行全流程互聯(lián)網(wǎng)“不見面審批”����。《公告》提出��,?���?谑修k理的《進口藥品通關(guān)單》備案行政審批事項,審批過程中可不收取紙質(zhì)材料����,轉(zhuǎn)而由申請人根據(jù)申請事項登錄相關(guān)行政審批系統(tǒng),進行網(wǎng)上申報����,按照要求上傳電子掃描材料即可����。
2018年��,重慶獲批設(shè)立了“首次進口藥品和生物制品口岸”����,成為繼北京、上海�、廣州后,第四個可進口首次在中國境內(nèi)銷售的藥品和生物制品的城市����。
業(yè)內(nèi)認(rèn)為,對于進口藥品注冊管理的不斷優(yōu)化����,可以使中國患者在臨床研究階段就接觸到更多新的藥品;同時����,也將加速進口新藥中國上市進程�,使得患者在第一時間接觸到新藥成為可能����。當(dāng)然�,在加速進口新藥上市速度的同時,我國對于藥品控價方面的經(jīng)驗積累也或?qū)⒅M口新藥可及性的增強��。