糖化修飾(Glycation)是蛋白質在葡萄糖、果糖��、半乳糖等還原性糖存在的情況下��,還原性糖共價結合到蛋白質氨基酸殘基上(主要為賴氨酸)的一種非酶促反應��,這與通常提到的酶促反應形成的糖基化修飾(Glycosylation)有所不同��。糖化修飾可以對蛋白的異質性��、穩(wěn)定性和功能活性等方面產生影響��,而其晚期糖化終末產物(AdvancedGlycation End Product��,AGE)[1-2]則與常見的糖尿病��、骨關節(jié)炎��、衰老��、血管并發(fā)癥等[1]密切相關��。
對于單抗制品��,由于葡萄糖在單抗發(fā)酵時被普遍使用��,同時在一些單抗制劑配方中也會添加還原性的糖��,或者配方中常見的蔗糖會水解成為還原性的糖,因此��,糖化修飾也是單抗常見的一種翻譯后修飾��。單抗的糖化受多種因素影響,發(fā)酵時培養(yǎng)基的pH��、葡萄糖濃度、培養(yǎng)基溫度和時間等因素均會影響單抗糖化的程度和糖化速率[3-4]��,而單抗在存貯階段的制劑配方組成、存貯溫度和時間也會影響其糖化[5]��。即使在通常認為比較穩(wěn)定的凍干劑型中也會發(fā)生糖化��。
單抗的糖化修飾會影響電荷異質性和聚集體的產生��,某些關鍵位點如互補決定區(qū)(Complementarity Determining Region,CDR)上的糖化還可能會影響其生物學功能和活性[6-7],對單抗藥物的批間一致性和用藥安全性造成潛在的影響��。因此��,基于QbD理念��,在單抗研發(fā)階段對單抗糖化進行表征研究并對特定單抗分子在生產過程中進行有效控制是十分必要的��,然而針對糖化的研究和評價通常被忽視��。目前��,國外研發(fā)機構對于單抗的糖化開展了相關研究��,包括糖化在單抗生產儲存階段的形成和影響因素、單抗糖化的定量定性檢測以及糖化對單抗功能活性和異質性的影響��,而國內對單抗糖化的研究不足,本文通過對單抗糖化的形成��、影響因素、糖化分析方法和糖化對單抗質量屬性的影響進行綜述��,旨在提高研發(fā)機構對糖化修飾的重視��,并在單抗研發(fā)和生產過程中進行評價和控制。
一��、 單抗糖化的形成
1.1 糖化形成過程
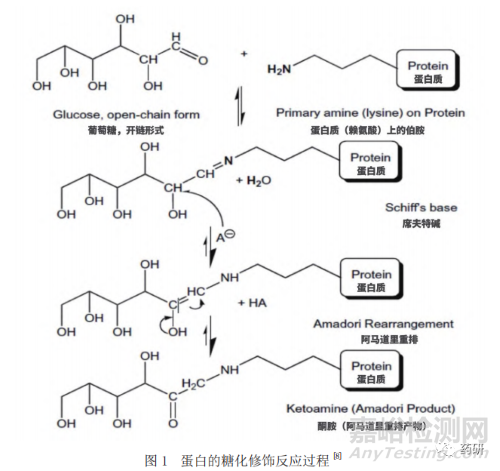
蛋白質的糖化通常主要發(fā)生在賴氨酸的α氨基和ε氨基末端上,當?shù)鞍踪|與還原型的糖孵育時��,通過非酶促反應��,還原型的糖會共價結合至賴氨酸上��,這一反應最初由Maillard于1912年提出��,因此被稱為Maillard反應(圖1)��。該反應首先由蛋白質賴氨酸上的氨基與還原性糖的醛基發(fā)生可逆的縮合反應��,形成一種不穩(wěn)定的席夫堿(SchiffBase)中間體,這一中間體可通過自發(fā)的Amadori重排生成更加穩(wěn)定的共價結合的酮胺��,從而完成了蛋白質的糖化過程[8]��。與此同時,糖化修飾在特定的情況下是可逆的��,研究發(fā)現(xiàn)將高度糖化的單抗在pH 7.0的磷酸鹽緩沖液中37 ℃孵育100小時后��,其糖化水平由42%下降至20%��,表明了糖化的可逆性[9]��。
對于單抗而言��,其序列上存在多個賴氨酸位點��,僅在重鏈恒定區(qū)上就存在約24~28個賴氨酸��,kappa和lamda輕鏈恒定區(qū)上各存在8個賴氨酸��,而在可變區(qū)也存在一定數(shù)量的賴氨酸��。研究發(fā)現(xiàn)盡管賴氨酸位點較多��,但通常單抗整體的糖化比例不高��,而糖化修飾也主要發(fā)生在個別賴氨酸位點上��,這些熱點賴氨酸主要與其空間分布有關,通常分布在抗體分子表面的賴氨酸容易與還原性的糖結合��。除此之外��,糖化位點附近的氨基酸殘基也會影響糖化的產生��。研究表明��,賴氨酸附近的羧酸可以通過促進Schiff Base轉化為Amadori 產物��,從而加速糖化[10]��,而臨近的天冬氨酸也會促進糖化的發(fā)生[11]��。
1.2 單抗糖化的產生及其影響因素
單抗制品生產工藝復雜��,而葡萄糖在單抗發(fā)酵生產時的細胞培養(yǎng)基中被普遍使用��,同時在一些單抗終產品的制劑配方中也會添加還原型的糖或者常見的蔗糖通過水解成為還原型的糖��,因此糖化修飾在單抗中較為常見��。單抗的糖化最早發(fā)生于細胞培養(yǎng)發(fā)酵時��,研究表明培養(yǎng)基的葡萄糖濃度��、pH��、離子強度��,以及培養(yǎng)溫度和培養(yǎng)時間等因素均會影響單抗糖化的程度和糖化速率��,其中葡萄糖濃度對糖化的產生影響最為直接��。Boyan Zhang等人發(fā)現(xiàn)在發(fā)酵早期使用高濃度的糖��,而在發(fā)酵后期降低糖濃度可有效降低產物的糖化水平[11]��。CynthiaQuan等研究發(fā)現(xiàn)��,通過調整培養(yǎng)基中半乳糖和葡萄糖的比例��,可以改變單抗的糖化比例��,且糖化比例隨著培養(yǎng)基中半乳糖比例的增加而顯著提高[8]��。此外��,細胞發(fā)酵時��,細胞生長溫度和pH也是影響糖化的兩大重要因素��。施貴寶公司的一項研究表明��,細胞發(fā)酵時的溫度��、培養(yǎng)基的離子強度和培養(yǎng)基存放時間��,以及抗氧化劑的濃度均會影響單抗的糖化修飾比例��,從而使單抗酸性組分增加[12]��。進一步研究表明��,這些培養(yǎng)條件的改變會增加發(fā)酵上清中的過氧化氫的濃度和細胞內活性氧的活性��,而糖化比例的升高也與發(fā)酵時的氧化壓力密切相關��。
在單抗生產完成后的存儲階段,如果制劑配方中存在還原性糖��,同樣會發(fā)生糖化反應��。盡管還原性糖在單抗制劑配方中不常使用,但單抗制劑配方中常用的蔗糖在酸性條件和高溫下也會降解為還原性的單糖��,因此單抗存儲階段也會發(fā)生糖化。單抗在存貯階段的制劑配方組成��、緩沖鹽種類,以及存貯溫度��、濕度和存儲時間會影響其糖化程度[5]��。Alex W研究發(fā)現(xiàn)��,特定緩沖鹽的類型可以明顯地改變單抗的糖化速率��。HEPES和檸檬酸鹽中糖化速率相對較低��,而磷酸鹽中糖化速率明顯升高��,碳酸鹽緩沖液最高[4]��。即使在通常認為比較穩(wěn)定的凍干劑型中也會發(fā)生糖化��,另一項研究表明��,較高的儲存溫度(如25 ℃)對凍干和液體制劑兩種劑型均會導致更高水平的糖化修飾水平[10,13]��。因此��,對于功能活性易受糖化影響的單抗,也應對其制劑配方進行研究優(yōu)化��,以降低糖化的發(fā)生��。
單抗在人體內同樣會發(fā)生糖化��。研究發(fā)現(xiàn)健康人體中內
源性IgG的糖化比例在14%~500%��,即平均一個IgG分子上有0.14~5個糖化修飾��,糖化的單抗藥物在注射入人體后��,還可以進一步氧化生成AGE形式[14]��,而研究發(fā)現(xiàn)一些AGE產物與人類慢性疾病的發(fā)生相關��。在單抗臨床給藥時��,如果需要提前與葡萄糖注射液混合��,則應在混合后盡快完成注射��,研究發(fā)現(xiàn)單抗糖化比例會隨著混合后藥物放置時間的增加而顯著上升[15]��。
二��、 單抗糖化修飾分析方法
由于糖化對單抗的活性��、異質性等方面可能產生潛在的影響��,因此需要對其進行充分的表征和測定��。目前��,糖化分析方法主要有硼酸親和色譜(BAC)��、基于電荷差異分離的方法(如離子交換色譜��、毛細管等電聚焦電泳等)��、硝基四氮唑藍還原試驗(NBT Reduction Assay)和液質聯(lián)用(LCMS)等[16]��。
2.1 硼酸親和色譜法(BAC)
BAC是一種用于分離糖上順式二醇結構的方法��,該方法因操作簡便��、無需樣品前處理等特點��,成為單抗糖化比例測定中最常用的定量分析方法��,可應用于單抗的批放行檢驗中對糖化比例進行質控��;同時��,也可用于單抗中糖化組分的收集純化��,以評價糖化組分對單抗功能活性的影響��。其原理是在堿性條件下色譜柱上的硼酸基團可以形成四面體結構的陰離子��,該陰離子可以特異性地結合單抗糖化修飾中的順式二醇[17]��,然后通過降低流動相的pH或者在流動相中加入山梨醇等羥基群來洗脫結合在色譜柱上的糖化單抗��,從而分離單抗糖化和未糖化的組分并對糖化比例進行定量��。對于該方法��,由于抗體分子和色譜柱固定相會發(fā)生一定程度的非特異性結合��,可以通過在流動相中加入Tris等試劑進行封閉��,以消除非特異性結合��。同時��,目前對于單抗糖基化修飾中的糖鏈是否會影響糖化比例的定量存在一定的爭議��,在針對特定單抗分子進行方法開發(fā)時應對糖基化修飾的影響進行評價,并對流動相的鹽組成��、pH以及封閉試劑進行優(yōu)化��,使之能夠對糖化比例進行準確定量��。本實驗室也通過方法學優(yōu)化和驗證建立了針對利妥昔單抗的BAC方法��,并對利妥昔單抗原研藥和生物類似藥的糖化比例進行了分析��,結果顯示利妥昔單抗整體上糖化比例較低��,且同一廠家糖化比例批間較為一致��,但原研藥和生物類似藥之間存在一定的差異��。由于不同單抗分子在氨基酸序列��、高級結構��、表面電荷分布等方面均存在差異��,而這些差異也會影響基于BAC測定的糖化比例��,因此不同的單抗不能用相同條件的BAC方法進行檢測��,應有針對性地開發(fā)分子特異的BAC方法��,即對流動相中的鹽組分和濃度��,以及封閉試劑的濃度分別進行優(yōu)化��。
2.2 基于電荷差異進行分離的方法
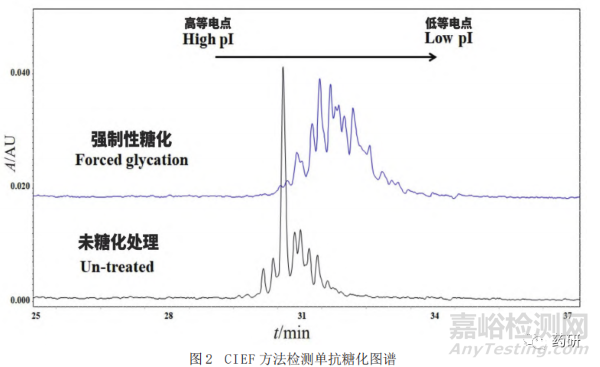
發(fā)生在賴氨酸等帶正電氨基酸上的糖化修飾會使其正電荷丟失��,從而使單抗的電荷分布整體上向酸區(qū)移動(圖2)��,因而可以通過基于電荷分離的分析方法對糖化進行檢測��。然而由于單抗的電荷異質性較強��,其他翻譯后修飾也可以影響單抗電荷的改變��,因此此類方法通常用于單抗糖化的定性分析��,尤其是用于糖化比例存在差異的同一單抗樣品間比對��。常用的方法如毛細管等電聚焦電泳(Capillary Isoelectric Focusing, CIEF)[18-19]和離子交換色譜(Ion Exchange Chromatography��,IEX)[20-21]都可以對糖化修飾進行檢測��。由于單抗電荷異質性較為復雜,氧化��、脫酰胺��、唾液酸修飾以及C末端賴氨酸等翻譯后修飾和單抗的降解/聚集均會引起單抗電荷的改變��,單抗整體的電荷分布是這些修飾疊加后的結果��,因此基于電荷分離的分析方法(CIEF��、IEC等)通常用來比較同一單抗完全糖化和未糖化��、高度糖化和低糖化單抗的電荷差異��,間接對糖化修飾進行確認��,并不能對糖化比例進行定量(圖2)��。
2.3 基于質譜的分析方法
單抗分子上一個賴氨酸位點發(fā)生糖化修飾后其分子量會增加162 Da,因此可以通過液質聯(lián)用等方法在完整蛋白或者亞基水平對單抗的糖化比例進行定量檢測��。同時結合酶切等手段��,也可以在肽段水平對單抗的糖化位點��、各位點的糖化比例進行分析。由于基于質譜的分析方法可以在肽段��、亞單位和完整分子水平獲得較為全面的糖化修飾數(shù)據(jù)��,因此常用于單抗糖化的表征��,該方法同樣也可用于糖化比例放行檢驗中��。需要注意的是��,在完整蛋白或亞基水平進行糖化比例檢測時��,需要對單抗Fc上糖基化修飾引入的糖鏈進行切除��,使質譜定量結果更為準確��;而對于C末端的賴氨酸修飾同樣會影響糖化比例檢測結果的準確性��,因增加1個賴氨酸會使單抗分子量變化128 Da��,增加1個糖化修飾分子量增加162 Da��,含有1個賴氨酸修飾(+128 Da)的單抗與1個糖化修飾(+162 Da)的單抗會產生34 Da的差異��,二者的同位素峰有疊加��,分離度不能滿足準確定量分析的要求,例如含有1個C末端賴氨酸的未糖化組分(K1)與不含C末端賴氨酸但含有1個糖化修飾的單抗之間無法有效分離進而定量計算��,尤其對于C末端賴氨酸比例較高而糖化比例較低的單抗影響更大��。對于這種情況��,可考慮用CpB酶對C末端賴氨酸進行切除后再進行質譜檢測��,但由于C末端賴氨酸同樣也是潛在的糖化位點��,CpB酶切處理后檢測的糖化比例較實際比例偏低��,因此��,應結合BAC方法��、亞單位/肽段水平的質譜檢測等正交方法綜合評價單抗的糖化修飾��。
2.4 比色法
單抗糖化形成的酮胺結構可以通過硝基四氮唑藍還原試驗(NBT Reduction Assay)進行定量��。NBT可以被糖化單抗中的酮胺還原��,引起在525nm波長處吸光度的改變��,進而對糖化比例進行定量��。該方法最早由Johnson在1983年用于蛋白糖化比例的檢測��,隨后在單抗的糖化比例檢測中也有所應用[17]��。
三��、 糖化修飾對單抗質量屬性的影響
3.1 糖化對單抗異質性的影響
糖化修飾會直接影響單抗的電荷分布��,糖化會使修飾位點上的正電荷丟失��,從而影響單抗的電荷異質性��,使其整體上向酸性區(qū)域移動��;除此之外��,一些研究發(fā)現(xiàn)��,糖化也會增加單抗聚集體的產生��,進而影響單抗的批間一致性以及功能活性��。安進公司在對IgG1和IgG2單抗進行加速穩(wěn)定性研究時發(fā)現(xiàn)��,兩種單抗在含有蔗糖的制劑配方中聚集體產生的速率顯著高于含有山梨醇的制劑配方單抗��,進一步的研究提示,聚集體的產生主要由單抗上的糖化引起��,而糖化促進單抗聚集體產生的機制��,可能主要由于糖化的產生改變了抗體分子表面的電荷以及疏水性而引起[22]��。由于在高溫等加速條件下��,制劑配方中非還原性的蔗糖會水解成為葡萄糖和果糖等還原性的單糖��,從而增加糖化的產生��,因此對于制劑配方中含有蔗糖等輔料的單抗��,通過加速穩(wěn)定性數(shù)據(jù)來預測其在2~8 ℃下的長期穩(wěn)定性是不適用的��。
糖化不僅會影響單抗的電荷和分子大小異質性��,糖化修飾后期產生的AGE形式同樣還會影響單抗制劑溶液的顏色��。CHO細胞表達的單抗制品通常表現(xiàn)出輕微的黃棕色��,普遍認為氧化會對單抗溶液的顏色產生影響��?�;蛱┛斯緦Χ鄠€CHO細胞表達的IgG1單抗的顏色產生機制進行研究發(fā)現(xiàn)��,單抗的顏色與其氧化程度和糖化水平呈弱相關��,但與糖化后期AGE形式的比例高度相關��,尤其與羥甲基賴氨酸(Carboxymethyllysine��,CML)這種形式的AGE相關性最強(R2=0.99)��,CML本身不產生顏色��,但其可以進一步修飾成為其他帶顏色的AGE形式[23]��。
3.2 糖化對生物學活性的影響
糖化對不同抗體分子活性的影響不盡相同��,對某些抗體活性無影響��,但對部分抗體可以使其活性完全消失��,這主要取決于糖化位點的數(shù)量和空間分布��。如果在抗體CDR區(qū)域上的糖化位點數(shù)量較多��,其活性可能更容易受到影響��。楊森公司研究糖化對一株IgG1單抗生物學活性的影響,通過分別收集糖化修飾和未糖化的抗體��,評價了兩種形式的抗體在抗原結合��、補體依賴的細胞毒作用(CDC)/抗體依賴細胞介導的細胞毒作用(ADCC)��,以及Fc受體親和力等方面的差異��。研究結果顯示��,糖化形式的抗體與抗原的結合能力顯著降低��,而其他活性則不受影響��。進一步研究發(fā)現(xiàn)��,該抗體重鏈CDR區(qū)第100位的賴氨酸高度糖化��,且該位點的糖化程度與抗原結合活性高度相關��,表明該位點的糖化會直接影響單抗與抗原之間的結合��,氫氘交換質譜的結果也表明該位點在與抗原結合時的重要性[6]��。在3個鼠源單抗上也發(fā)現(xiàn)了類似的結果,糖化可以顯著降低抗體與抗原的親和力��,顯著增加抗原抗體之間的解離速率[24]��。也有研究發(fā)現(xiàn)��,糖化修飾并不會影響特定抗體的生物學活性��。由此可見��,糖化修飾對不同單抗活性的影響不同��,主要取決于糖化修飾位點的位置��,因此在研發(fā)階段應充分評估糖化的影響��。對于活性易受影響的抗體��,應通過工藝優(yōu)化��、過程控制等手段保證糖化比例的批間一致性��。
3.3 糖化對單抗免疫原性的影響
糖化對單抗免疫原性的潛在影響主要由糖化晚期終末端產物AGE引起��。研究發(fā)現(xiàn)AGE形式單抗的免疫原性顯著強于正?�?贵w��,相比于正?�?贵w��,可在動物體內產生針對AGE的高滴度特異性抗體[25]��,而在類風濕關節(jié)炎患者體內也能檢測到針對AGE的高滴度IgM抗體[26-27]��。盡管在優(yōu)化的抗體生產工藝下��,單抗發(fā)生AGE形式的糖化修飾比例較低��,但糖化的單抗在進入體內循環(huán)過程中��,在高血糖及氧化等環(huán)境下��,仍能產生AGE形式的糖化修飾��。另一方面��,糖化引起的抗體聚集也會增加免疫原性��。除此之外��,AGE形式的蛋白還會在體內誘導AGE特異性細胞受體的表達,同時還會引發(fā)蛋白的交聯(lián)和聚集��,而這種非天然形式的蛋白也會對多種細胞產生毒性并引發(fā)疾病��。
四��、 單抗糖化修飾的控制策略
糖化修飾不僅會影響單抗的異質性��,同時還可能會影響單抗的功能活性以及免疫原性��,因此在分子開發(fā)時應對糖化進行充分的表征研究��,對于易受影響的單抗分子��,應在分子設計和生產工藝開發(fā)時盡可能減少其糖化修飾的影響��,并在生產時對其糖化比例進行有效控制以保證批間一致性��。目前控制單抗糖化修飾的策略主要集中在分子設計和生產工藝條件優(yōu)化兩方面��。阿斯利康公司發(fā)現(xiàn)多個單抗的細胞發(fā)酵后的澄清收獲液在放置一段時間后��,其酸性電荷變異體比例顯著增加��,研究發(fā)現(xiàn)這主要由單抗的糖化所引起��,電荷異質性的改變影響了單抗生產過程的穩(wěn)定性��,對該抗體生產工藝和批間一致性造成了挑戰(zhàn)��。通過將單抗上容易形成糖化修飾的賴氨酸突變?yōu)榫彼岷?�,電荷分布穩(wěn)定��,同時氨基酸突變也未影響該抗體的活性��,這一突變策略可應用于降低/消除抗體糖化修飾的影響[28]��。
重組單抗的糖化主要發(fā)生在細胞培養(yǎng)發(fā)酵過程中��,培養(yǎng)基的組成��、離子強度��、葡萄糖的加入量��、氧含量��、培養(yǎng)溫度和培養(yǎng)時間等因素均會影響單抗糖化��。通過建立糖化動力學模型等方式��,對發(fā)酵培養(yǎng)條件進行優(yōu)化,在保證單抗質量和表達量的情況下��,可以有效控制發(fā)酵培養(yǎng)階段糖化的形成��。另外��,由于糖化修飾的單抗組分主要集中在電荷分布中的酸性區(qū)域��,也可以在離子交換層析步驟中適當去除酸性組分��,使糖化單抗的比例降低��。對于在單抗存貯階段形成的糖化修飾��,應對制劑配方進行評估和優(yōu)化��,對于易受糖化影響的單抗��,其制劑配方中應避免使用葡萄糖等還原性糖��。
五��、小結
質量研究和評價是保障藥品安全有效的重要手段��。單抗由于結構功能復雜且存在多種翻譯后修飾類型��,具有復雜的關鍵質量屬性(CQA)��,根據(jù)先驗知識��、風險評估和實驗分析��,常見的翻譯后修飾(如糖基化��、末端賴氨酸截除等)對單抗影響比較明確[29-31]��,分析手段比較成熟��,易于進行質量屬性評估��,并結合抗體自身特點��,通過藥效學等評價��,確定其是否為CQA��。明確藥品的關鍵質量屬性及其影響程度��,一方面對產品質量有影響的產品特性得以研究和控制��,另一方面��,明確在工藝驗證以及商業(yè)化生產中需要持續(xù)關注的項目,以保持工藝的穩(wěn)定性��。
糖化作為單抗常見的翻譯后修飾��,在單抗生產��、儲存��、臨床使用以及注射入人體后均會發(fā)生��,同時糖化不僅會影響單抗的電荷異質性��,也可能影響聚集體的產生��,并對單抗的功能活性��、免疫原性等產生影響��,然而目前在單抗質量研究及可比性評價中通常缺乏對糖化的研究評價��。由于糖化對單抗的影響取決于單抗序列��、結構等因素��,對不同單抗的影響存在差異��,因此在單抗研發(fā)時應充分評估糖化的影響并確定是否為關鍵質量屬性��,對于生物類似藥也應根據(jù)單抗分子特性按照ICH Q9風險評估原則開展相應的糖化可比性評價��。根據(jù)風險評估和質控需求��,可以選擇對單抗的糖化比例(完整分子水平��、亞單位水平或肽段水平)��、糖化位點以及分布等進行質控評價��,也可以在充分表征后在電荷水平上控制糖化的批間一致性��。對于糖化是CQA的單抗品種��,應結合分子設計��、生產工藝優(yōu)化��、質控檢測等手段對其進行有效的控制和監(jiān)測��,保證批間一致性��。