特殊注射劑通常為改良型藥物�,通過(guò)對(duì)劑型、處方、工藝等進(jìn)行優(yōu)化設(shè)計(jì)解決藥物的先天不足�����,以降低藥物不良反應(yīng)�、提高療效、提升患者順應(yīng)性等�����,具有較高的臨床價(jià)值�����。特殊注射劑通常具有復(fù)雜的處方或采用特殊的制備工藝�,具有較高的技術(shù)壁壘,在競(jìng)爭(zhēng)日益激烈的仿制藥市場(chǎng)中具有較大的優(yōu)勢(shì)���。本文參考國(guó)內(nèi)外指導(dǎo)原則�,結(jié)合特殊注射劑的制劑特點(diǎn)�����,簡(jiǎn)要探討化學(xué)藥品特殊注射劑仿制藥開(kāi)發(fā)過(guò)程中藥學(xué)研究需要關(guān)注的內(nèi)容和技術(shù)要求�。
隨著我國(guó)藥物研發(fā)水平的迅速提升���、化學(xué)仿制藥一致性評(píng)價(jià)和國(guó)家藥品集中帶量采購(gòu)工作的推進(jìn)和深入,在競(jìng)爭(zhēng)日益激烈的仿制藥市場(chǎng)中���,復(fù)雜仿制藥已成為諸多企業(yè)瞄準(zhǔn)的目標(biāo)�����。根據(jù)美國(guó)FDA的指導(dǎo)原則,復(fù)雜仿制藥通常包括以下產(chǎn)品[1]:復(fù)雜的活性成分(如肽�、聚合物、活性藥物成分的復(fù)雜混合物�、天然來(lái)源成分)、復(fù)雜制劑(如脂質(zhì)體�����、膠體)�、復(fù)雜的給藥途徑(如配制成混懸液、乳劑或凝膠劑的局部作用藥物�,皮膚病用藥,復(fù)雜的眼科產(chǎn)品以及耳用劑型)�����、復(fù)雜劑型(如經(jīng)皮給藥劑型、定量吸入制劑�����、緩釋注射劑)�����、復(fù)雜的藥械組合產(chǎn)品(如自動(dòng)注射器���、定量吸入器)等���,以及其他可受益于早期科學(xué)參與、存在批準(zhǔn)途徑或替代方法的復(fù)雜性或不確定性的產(chǎn)品�����。我國(guó)目前沒(méi)有對(duì)于復(fù)雜仿制藥的定義和范圍�����,僅在化學(xué)仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作中�����,為與普通注射劑區(qū)分提出了特殊注射劑的概念[2]:與普通注射劑相比,特殊注射劑的質(zhì)量及其活性成分的體內(nèi)行為受處方和工藝的影響較大�,可能進(jìn)一步影響制劑在體內(nèi)的安全性和有效性,例如脂質(zhì)體�、靜脈乳、微球�����、混懸型注射劑�、油溶液、膠束等�?����?梢?jiàn)我國(guó)提出的特殊注射劑為美國(guó)FDA所述的復(fù)雜制劑或復(fù)雜劑型�����。
特殊注射劑通常為改良型藥物�,通過(guò)對(duì)劑型�����、處方、工藝等進(jìn)行優(yōu)化設(shè)計(jì)解決藥物的先天不足���,以達(dá)到降低藥物不良反應(yīng)�、提高療效���、提升患者順應(yīng)性等目的�����,具有較高的臨床價(jià)值和市場(chǎng)效益�����。例如:1995年批準(zhǔn)上市的第一個(gè)脂質(zhì)體抗癌藥物—鹽酸多柔比星脂質(zhì)體注射液�����,商品名Doxil®/Caelyx®�,它采用硫酸銨梯度法將鹽酸多柔比星包裹于PEG化脂質(zhì)體內(nèi)形成的特殊注射劑�����,相比普通的多柔比星注射液���,抗腫瘤作用增加���、藥物半衰期延長(zhǎng)�、心臟毒性降低�����。由Celgene公司研發(fā)的注射用紫杉醇(白蛋白結(jié)合型)�����,商品名Abraxane®���,則是以人血白蛋白為載體采用納米分散技術(shù)制備的納米微粒制劑,相比以聚氧乙烯蓖麻油為助溶劑的普通注射劑�,過(guò)敏反應(yīng)的發(fā)生率顯著降低�����、輸液時(shí)間縮短�����、耐受性明顯提升。
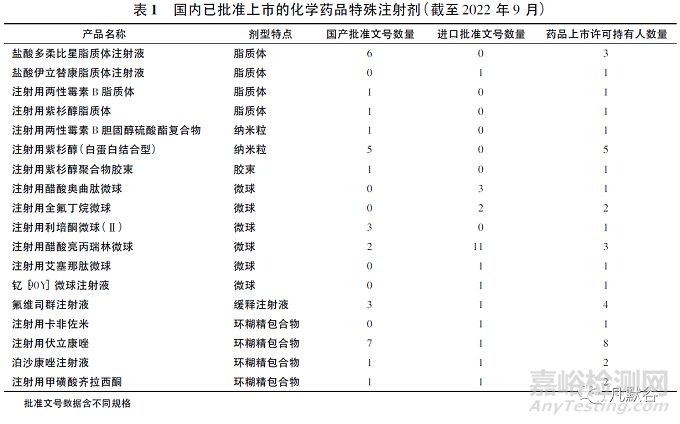
無(wú)論是前期產(chǎn)品開(kāi)發(fā)還是商業(yè)化生產(chǎn)過(guò)程控制和質(zhì)量保證���,特殊注射劑都有著較高的技術(shù)壁壘,能夠成功上市的品種并不多���。目前國(guó)內(nèi)已批準(zhǔn)上市的特殊注射劑主要有脂質(zhì)體、微球�����、膠束�、油溶液、包合物等�,而且每個(gè)品種藥品上市持有人數(shù)量均較少���,甚至多個(gè)產(chǎn)品無(wú)仿制藥上市�����,存在原研藥壟斷及尚未滿足的臨床需求�,詳見(jiàn)表1。
由于特殊注射劑通常具有相對(duì)復(fù)雜的處方或采用特殊的制備工藝�����,每個(gè)產(chǎn)品都具有特殊的性能和特點(diǎn)�,藥學(xué)研究方面需要結(jié)合制劑特性個(gè)性化地考慮研究和開(kāi)發(fā)方案,進(jìn)而確定不同于普通注射劑的關(guān)鍵質(zhì)量控制策略�����。在化學(xué)藥品特殊注射劑仿制藥研發(fā)的整體思路方面�,藥學(xué)研究是基礎(chǔ),若僅通過(guò)藥學(xué)研究不能充分確保與參比制劑質(zhì)量和療效的一致性�����,則可能需要進(jìn)一步的非臨床和/或臨床研究���。若藥學(xué)研究結(jié)果提示仿制藥與參比制劑不一致�����,可能需要對(duì)仿制藥的處方工藝進(jìn)一步優(yōu)化后重新開(kāi)展后續(xù)非臨床和/或臨床研究[2]。本文即以特殊注射劑為例簡(jiǎn)要介紹化學(xué)藥品復(fù)雜仿制藥藥學(xué)研究的一般要求�����。
需要指出的是�,部分特殊注射劑要真正做到與參比制劑做到質(zhì)量和療效一致存在極大挑戰(zhàn),比如醋酸亮丙瑞林緩釋微球�,在有些情況下企業(yè)或許會(huì)考慮突破仿制藥的研發(fā)思路按改良型新藥進(jìn)行開(kāi)發(fā),此類情形不在本文討論范圍之內(nèi)�����。
1�����、參比制劑選擇
參比制劑是指經(jīng)國(guó)家藥品監(jiān)管部門評(píng)估確認(rèn)的仿制藥研制使用的對(duì)照藥品�����。仿制藥應(yīng)具有與參比制劑相同的活性成分�����、劑型���、規(guī)格�����、適應(yīng)證���、給藥途徑和用法用量�,并證明質(zhì)量和療效與參比制劑一致[3]�����,臨床上可替代參比制劑發(fā)揮相同的臨床作用�����。因此���,選擇參比制劑是仿制藥研發(fā)的開(kāi)始�����,參比制劑選擇是否正確決定仿制藥的成敗���。
參比制劑的遴選與公布由國(guó)家藥品監(jiān)管部門負(fù)責(zé),隨著我國(guó)參比制劑遴選工作的日益成熟�,國(guó)家藥監(jiān)局在原國(guó)家食品藥品監(jiān)督管理總局《關(guān)于發(fā)布仿制藥質(zhì)量和療效一致性評(píng)價(jià)參比制劑備案與推薦程序的公告》(2016年第99號(hào))的基礎(chǔ)上,優(yōu)化工作程序���,于2019年和2020年相繼發(fā)布了《化學(xué)仿制藥參比制劑遴選與確定程序》和《化學(xué)仿制藥參比制劑遴選申請(qǐng)資料要求》�,以進(jìn)一步提高參比制劑遴選工作的質(zhì)量和效率[4-5]���。截至2022年9月�,國(guó)家藥品監(jiān)督管理局已正式發(fā)布60批參比制劑���,包括脂質(zhì)體�����、微球���、包合物等多種特殊注射劑。
2�����、處方研究
根據(jù)國(guó)內(nèi)外監(jiān)管機(jī)構(gòu)的技術(shù)要求�����,注射劑仿制藥的處方組成通常應(yīng)與參比制劑相同���,即輔料種類和用量通常應(yīng)與參比制劑相同���,輔料的用量相同是指仿制藥輔料用量為參比制劑相應(yīng)輔料用量的95%~105%[2,6]�����。特殊注射劑仿制藥也應(yīng)滿足上述要求�����,同時(shí)還應(yīng)關(guān)注影響制劑關(guān)鍵質(zhì)量屬性和/或體內(nèi)行為的輔料(如載體材料�、藥物釋放調(diào)節(jié)劑)的研究與控制。例如:注射用紫杉醇(白蛋白結(jié)合型)參比制劑說(shuō)明書中明確每瓶含紫杉醇100mg及人血白蛋白約900mg���,紫杉醇是藥物活性成分�����,人血白蛋白起分散�����、穩(wěn)定和運(yùn)載主藥作用�。關(guān)鍵輔料人血白蛋白所引入的穩(wěn)定劑同樣對(duì)制劑中白蛋白起到穩(wěn)定作用,由于不同來(lái)源的人血白蛋白使用的穩(wěn)定劑(辛酸鈉�、乙酰色氨酸等)可能存在差異(種類及用量)���,因此需要關(guān)注不同來(lái)源的人血白蛋白對(duì)制劑質(zhì)量的影響[7]�。又如�����,由阿斯利康公司研發(fā)的緩釋產(chǎn)品氟維司群注射液�����,商品名Faslodex®���,經(jīng)肌肉注射后在局部形成藥物貯庫(kù)���,緩慢吸收,發(fā)揮長(zhǎng)效作用�,終末半衰期約為50d���。該產(chǎn)品處方中非活性成分蓖麻油作為共溶劑的同時(shí)�����,也是釋放調(diào)節(jié)劑[8]�����。蓖麻油是由多種脂肪酸組成的植物來(lái)源脂肪油���,其主要成分包括蓖麻油酸、亞油酸���、油酸、硬脂酸�����、棕櫚酸�����、亞麻酸�、二十碳烯酸以及其他脂肪酸等[9]。根據(jù)氟維司群注射液的釋藥機(jī)理�����,溶解于油溶液中的藥物隨著局部組織的油水平衡而吸收�,蓖麻油中脂肪酸的組成也將影響藥物在體內(nèi)的擴(kuò)散和吸收���。因此,如果要基于與參比制劑處方相同而豁免仿制藥的人體內(nèi)生物等效性試驗(yàn)���,則需要進(jìn)行充分的研究來(lái)證明仿制藥所采用的蓖麻油與參比制劑所用蓖麻油的脂肪酸組成一致[10-11]�����。
3���、生產(chǎn)工藝開(kāi)發(fā)
對(duì)于復(fù)雜工藝的特殊注射液,特別是使用載體材料制備的脂質(zhì)體���、膠束�、微球等�,需根據(jù)參比制劑工藝原理�����、劑型特點(diǎn)�����、給藥途徑等考慮生產(chǎn)工藝的技術(shù)要求[12]�����。例如:多柔比星脂質(zhì)體可以通過(guò)不同原理的方法制備�����,相應(yīng)形成脂質(zhì)體的尺寸�����、形態(tài)�、釋藥機(jī)理等各不相同�����,進(jìn)而影響藥物的安全性和有效性。我國(guó)已批準(zhǔn)上市的鹽酸多柔比星脂質(zhì)體注射液的參比制劑采用硫酸銨梯度法制備�,主要步驟包括:①空白脂質(zhì)體的制備�。②硫酸銨梯度的形成。③活性藥物的裝載[13]���?��;钚运幬锏难b載是多柔比星在脂質(zhì)體內(nèi)外相的硫酸銨濃度梯度驅(qū)動(dòng)下擴(kuò)散到空白脂質(zhì)體內(nèi)完成的[14-15]。為保障質(zhì)量和療效的一致性���,仿制藥需采用與參比制劑相同原理的生產(chǎn)工藝���,并通過(guò)工藝研究確定內(nèi)水相溶液�����、脂相溶液�、透析液、藥物溶液等過(guò)程配制溶液的處方組成�����,確定油水兩相混合溫度和流速,高壓擠出次數(shù)�、溫度和壓力,透析倍數(shù)�、載藥溫度和時(shí)間、除菌過(guò)濾壓力和溫度等關(guān)鍵步驟的工藝參數(shù)���;并且空白脂質(zhì)體和載藥脂質(zhì)體均應(yīng)作為關(guān)鍵中間產(chǎn)品���,控制粒度和粒度分布、載藥量等�����。又如Celgene公司研發(fā)的注射用紫杉醇(白蛋白結(jié)合型)采用乳化-溶劑蒸發(fā)工藝制備[16]�����,由于構(gòu)建人血白蛋白二硫鍵的方法較多�,如有機(jī)溶劑、離子強(qiáng)度���、pH�����、高剪切力等[17]�,仿制藥可能采用不同于參比制劑的工藝??紤]制備工藝對(duì)產(chǎn)品質(zhì)量與療效差異的潛在影響,因此在仿制藥開(kāi)發(fā)時(shí)需分析其工藝與參比制劑工藝的異同���,提出合理支持依據(jù)���。
由于復(fù)雜工藝的變更及批量放大可能影響特殊注射劑的質(zhì)量和療效,根據(jù)《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》���,特殊劑型制劑生產(chǎn)批量的變更屬于重大變更[18]�����,因此對(duì)于復(fù)雜工藝生產(chǎn)的特殊注射劑���,注冊(cè)批生產(chǎn)規(guī)模應(yīng)與擬定商業(yè)化生產(chǎn)規(guī)模一致[19]���。
4���、質(zhì)量研究與控制
仿制藥的質(zhì)量研究應(yīng)根據(jù)產(chǎn)品特性和相關(guān)指導(dǎo)原則科學(xué)設(shè)計(jì)試驗(yàn)�����,證明仿制藥與參比制劑的質(zhì)量一致性�。原則上應(yīng)提供至少3批次參比制劑樣品的質(zhì)量對(duì)比考察數(shù)據(jù)[2]�。特殊注射劑的考察指標(biāo)除了普通注射劑關(guān)鍵質(zhì)量屬性外,還應(yīng)提出與其特性相關(guān)的質(zhì)量控制研究項(xiàng)�����,以及在藥物生產(chǎn)�、臨床使用、穩(wěn)定性保障等環(huán)節(jié)應(yīng)關(guān)注的質(zhì)量控制指標(biāo)[12]�����。例如:微粒制劑集中于粒子屬性的對(duì)比研究:粒子形態(tài)�、粒度和粒度分布、表面性質(zhì)(電位�、比表面積、包衣及厚度�、配體及密度等)、包封率和包封藥物狀態(tài)���、藥物/載體摩爾比�����、載藥量���、藥物釋放和泄漏等�����。粒度和粒度分布建議采用群體生物等效性分析方法證明與參比制劑等效[20]���。通過(guò)采用環(huán)糊精包合方式增加活性成分溶解度的注射劑,建議考察環(huán)糊精的取代度和取代度分布�����,結(jié)合臨床使用方法考察仿制藥與參比制劑在不同pH介質(zhì)中包合穩(wěn)定常數(shù)和復(fù)溶后藥液的配伍穩(wěn)定性�����,并關(guān)注仿制藥與參比制劑釋放動(dòng)力學(xué)的相似性[21]���。溶液型緩釋注射劑方面,以氟維司群注射液為例�,還應(yīng)關(guān)注可能影響給藥后所形成的藥液貯庫(kù)性質(zhì)的因素�,如藥液黏度對(duì)給藥后藥液貯庫(kù)擴(kuò)散和總表面積的影響�,給藥器械(如注射針頭的長(zhǎng)度與內(nèi)徑、注射器活塞的滑動(dòng)性能�、實(shí)際給藥體積等)對(duì)注射后貯庫(kù)位置的影響,仿制藥應(yīng)與參比制劑一致�,以避免影響活性成分在體內(nèi)的擴(kuò)散和吸收[11]。
5�、穩(wěn)定性研究
在常規(guī)藥物穩(wěn)定性研究要求的基礎(chǔ)上,特殊注射劑應(yīng)考察質(zhì)量研究與控制中確定的影響制劑特性的關(guān)鍵質(zhì)量屬性���,結(jié)合藥物自身的特點(diǎn)建立符合要求的評(píng)價(jià)方法和指標(biāo)�����。需要指出的是�����,應(yīng)關(guān)注可能降解���、聚集的非活性成分在貯藏、配制和臨床使用中的變化�。例如:氟維司群注射液應(yīng)考察油性溶劑降解情況,考察指標(biāo)包括酸值�、皂化值�����、過(guò)氧化值�、碘值等[11]�;由于人血白蛋白中單體、二聚體�、寡聚體和多聚體等與紫杉醇的結(jié)合屬性不同,穩(wěn)定性研究中也應(yīng)對(duì)注射用紫杉醇(白蛋白結(jié)合型)中白蛋白的低聚物狀態(tài)進(jìn)行表征[7�����,22]�����。
注射劑在臨床使用過(guò)程中���,通常需要采用基礎(chǔ)輸液等溶解�����、稀釋后使用���,特殊注射劑仿制藥的使用中穩(wěn)定性研究應(yīng)根據(jù)參比制劑說(shuō)明書中明確的臨床用法用量進(jìn)行試驗(yàn)設(shè)計(jì)和模擬研究�,考慮最高/低使用濃度���、臨床使用溫度、最長(zhǎng)使用時(shí)間(包括輸液時(shí)間)等�����,并與參比制劑在上述條件下進(jìn)行對(duì)比研究�����。
6���、結(jié)語(yǔ)
特殊注射劑具有較高的技術(shù)含量和臨床價(jià)值���,其仿制藥是對(duì)市場(chǎng)有效的補(bǔ)充和調(diào)節(jié),防止出現(xiàn)藥物短缺�,減輕患者負(fù)擔(dān)。注射用紫杉醇(白蛋白結(jié)合型)自2018年首家仿制藥按照“臨床急需�����、市場(chǎng)短缺”納入優(yōu)先審評(píng)批準(zhǔn)上市,至今已有5家仿制藥獲批上市���,曾經(jīng)的萬(wàn)元藥物在2022年集中采購(gòu)單價(jià)已降至百余元���。
特殊注射劑制劑特性復(fù)雜,產(chǎn)品開(kāi)發(fā)和審評(píng)的關(guān)注點(diǎn)與要求需要具體品種個(gè)性化考慮�����。目前我國(guó)已發(fā)布《鹽酸多柔比星脂質(zhì)體注射液仿制藥研究技術(shù)指導(dǎo)原則(試行)》�、《注射用紫杉醇(白蛋白結(jié)合型)仿制藥研究技術(shù)指導(dǎo)原則(試行)》、《氟維司群注射液仿制藥研究技術(shù)指導(dǎo)原則(試行)》等個(gè)藥指南���,以期更有效地促進(jìn)仿制藥開(kāi)發(fā)���,加快仿制藥的批準(zhǔn)上市和質(zhì)量提升,以期更好地滿足臨床需求���。
本文簡(jiǎn)要探討了特殊注射劑仿制藥開(kāi)發(fā)中藥學(xué)研究需要關(guān)注的內(nèi)容和技術(shù)要求�����。藥品上市許可持有人對(duì)藥品質(zhì)量在其整個(gè)生命周期內(nèi)承擔(dān)主體責(zé)任�,應(yīng)充分調(diào)研所研發(fā)品種包括參比制劑的特點(diǎn),基于科學(xué)的原則進(jìn)行仿制藥的研發(fā)�,以充分保障藥品的安全性、有效性和質(zhì)量可控�。