醫(yī)療器械作為一種強監(jiān)管產品�����,整個生命周期包括研發(fā)��、生產���、審批�����、運輸�����、存儲��、銷售�����、使用等一系列過程�����,醫(yī)療器械各個環(huán)節(jié)都需要科學管理��,否則可能發(fā)生醫(yī)療損害責任糾紛或醫(yī)療事故�����,對患者生命安全和健康都將造成重大威脅�����。醫(yī)療器械研發(fā)包括產品研制���、臨床評價��、注冊許可等流程���。對于不同類別的醫(yī)療器械,審批和監(jiān)管要求也各不相同��。
醫(yī)療器械分類
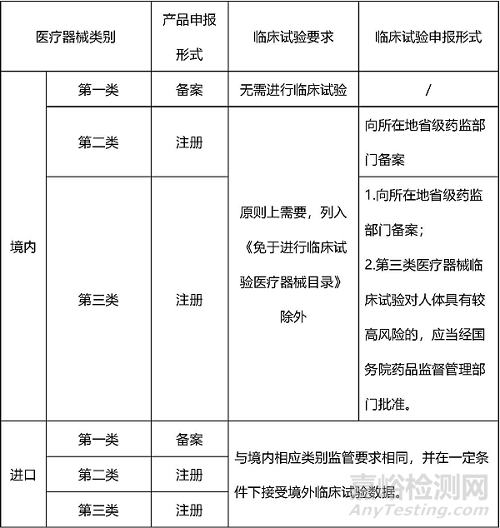
國家對醫(yī)療器械按照風險程度實行分類管理�����。醫(yī)療器械從風險程度高低分為三類�����,并采用不同的管理方式:第一類是風險程度低��,實行常規(guī)管理可以保證其安全��、有效的醫(yī)療器械���,如手術刀、止血鉗�����、壓舌板等。第二類是具有中度風險���,需要嚴格控制管理以保證其安全�����、有效的醫(yī)療器械���,如面部提拉線、面部埋植線等���。第三類是具有較高風險��,需要采取特別措施嚴格控制管理以保證其安全��、有效的醫(yī)療器械�����,如射頻治療儀���、超聲治療儀、水光針等��。根據(jù)《醫(yī)療器械分類規(guī)則》規(guī)定,評價醫(yī)療器械風險程度��,應當根據(jù)醫(yī)療器械的預期目的���、結構特征、使用形式���、使用狀態(tài)等因素綜合判定�����。
醫(yī)療器械研發(fā)及監(jiān)管
醫(yī)療器械研發(fā)環(huán)節(jié)一般包含從產品研制到獲得注冊許可或完成備案的流程��,具體包含產品研制��、注冊檢驗���、臨床評價、注冊申請��、技術審評�����、注冊許可等流程。醫(yī)療器械的臨床評價和注冊許可是醫(yī)療器械研發(fā)階段的監(jiān)管重點�����。
醫(yī)療器械臨床評價是指申請人采用合理的方法對臨床數(shù)據(jù)進行分析��,以確認產品是否滿足使用要求而進行確認的過程�����,目前臨床評價主要有以下三種方式:
一是直接豁免:列入《免于進行臨床試驗的醫(yī)療器械目錄》產品的臨床評價��。
二是同品種對比:通過對同品種醫(yī)療器械臨床文獻資料�����、臨床數(shù)據(jù)進行分析評價���,證明醫(yī)療器械安全�����、有效���。
三是臨床試驗:按照國家藥品監(jiān)督管理部門的規(guī)定��,進行醫(yī)療器械臨床評價時��,已有的臨床文獻資料和臨床數(shù)據(jù)不足以確認產品安全�����、有效的醫(yī)療器械,應當開展臨床試驗���。
醫(yī)療器械的監(jiān)管方式主要有以下幾種:
圖片醫(yī)療器械研發(fā)合規(guī)風險總結
1. 醫(yī)療器械臨床試驗
為加強醫(yī)療器械臨床試驗的監(jiān)督管理�����,國家食品藥品監(jiān)管總局每年都會對醫(yī)療器械臨床試驗進行監(jiān)督抽查并發(fā)布《總局關于開展醫(yī)療器械臨床試驗監(jiān)督抽查工作的通告》��,對臨床試驗數(shù)據(jù)的真實性和合規(guī)性進行檢查��,未發(fā)現(xiàn)真實性和合規(guī)性問題的���,視為臨床試驗符合要求。首先�����,臨床試驗存在真實性問題情況有以下情形:一是注冊申請?zhí)峤坏呐R床試驗資料與臨床試驗機構保存的相應臨床試驗資料不一致的;二是臨床試驗數(shù)據(jù)不能溯源的���;三是受試產品/試驗用體外診斷試劑或試驗用樣本不真實的���。其次,未發(fā)現(xiàn)真實性問題�����,但臨床試驗過程不符合醫(yī)療器械相關規(guī)定要求的��,判定為存在合規(guī)性問題�����。再次��,未發(fā)現(xiàn)真實性和合規(guī)性問題的��,判定為符合要求�����。對存在真實性問題的��,可能會作出責令改正、停止臨床試驗或進行罰款等處罰���。對僅存在合規(guī)性問題的�����,綜合評價注冊申請資料和監(jiān)督檢查發(fā)現(xiàn)的問題��,作出是否批準注冊的決定�����。
2. 醫(yī)療器械注冊備案
為確保醫(yī)療器械順利通過審批,申請人或備案人可能會出現(xiàn)提交虛假注冊資料或備案資料��、隱瞞真實情況或提供虛假信息等情況���,《醫(yī)療器械注冊與備案管理辦法》均對上述情況進行了規(guī)定�����,在審評���、核查��、審批過程中發(fā)現(xiàn)涉嫌存在隱瞞真實情況或者提供虛假信息等違法行為的���,申請人不得撤回醫(yī)療器械注冊申請。對于已受理的注冊申請��,有證據(jù)表明注冊申請資料可能虛假的���,藥品監(jiān)督管理部門可以中止審評審批��。經核實后�����,根據(jù)核實結論繼續(xù)審查或者作出不予注冊的決定�����。對于擬上市的醫(yī)療器械無法證明產品安全有效���、質量可控等情況的,藥品監(jiān)督管理部門作出不予注冊的決定��。
3. 醫(yī)療器械專利
醫(yī)療器械專利研發(fā)完成以后,更新迭代進程較慢���,而專利權具有獨占性�����、排他性等特點��,醫(yī)療器械研發(fā)過程容易產生專利侵權糾紛�����。從醫(yī)療器械研發(fā)的外部風險來說�����,如果專利技術方案落入他人的專利權保護范圍,可能被專利行政部門予以駁回���;即使被授予專利��,但權利人認為該專利權的授予不符合專利法規(guī)定的�����,可以請求專利復審委員會宣告該專利權無效���。從醫(yī)療器械的內部風險來說��,即在單位未與單位內部發(fā)明人�����、設計人明確職務發(fā)明的權利歸屬的情況下�����,員工對職務發(fā)明的權屬提出異議或者企業(yè)對發(fā)明人���、設計人給予職務發(fā)明獎勵和報酬而引發(fā)相應民事爭議的法律風險。