今日頭條
微芯口服HDAC抑制劑III期臨床積極����。微芯生物自研HDAC口服抑制劑西達(dá)本胺聯(lián)合R-CHOP方案(利妥昔單抗����、環(huán)磷酰胺���、阿霉素�、長(zhǎng)春新堿���、強(qiáng)的松)治療MYC/BCL2雙表達(dá)彌漫大B細(xì)胞淋巴瘤初治患者的III期臨床(DEB試驗(yàn))期中結(jié)果積極���。經(jīng)獨(dú)立數(shù)據(jù)監(jiān)查委員會(huì)(IDMC)評(píng)估,該項(xiàng)研究達(dá)到預(yù)設(shè)的療效與安全性指標(biāo)����,建議申辦者提前遞交附條件上市申請(qǐng)�。
國(guó)內(nèi)藥訊
1.新碼引進(jìn)HER2 ADC臨床積極。新碼生物與安博生物聯(lián)合開(kāi)發(fā)的靶向HER2抗體偶聯(lián)藥物(ADC)ARX788在治療HER2陽(yáng)性乳腺癌患者的Ⅱ/Ⅲ期臨床達(dá)到主要終點(diǎn)����。獨(dú)立數(shù)據(jù)監(jiān)測(cè)委員會(huì)(IDMC)的中期分析顯示,與對(duì)照藥物(拉帕替尼聯(lián)合卡培他濱)相比����,ARX788治療顯著改善患者的的無(wú)進(jìn)展生存期(PFS)�。新碼生物計(jì)劃盡快向NMPA提交ARX788的上市申請(qǐng)���。
2.榮昌「泰它西普」啟動(dòng)IgA腎病III期臨床���。榮昌生物BLyS/APRIL雙靶點(diǎn)融合蛋白泰它西普登記啟動(dòng)一項(xiàng)III期臨床,評(píng)估用于治療原發(fā)性IgA腎病患者的有效性和安全性����。該項(xiàng)研究主要研究者由北京大學(xué)第一醫(yī)院醫(yī)學(xué)博士呂繼成擔(dān)任。II期臨床(登記號(hào):NCT04291781)數(shù)據(jù)顯示����,用藥24周后,泰它西普240mg組受試者24小時(shí)尿蛋白平均水平較基線下降49%(p<0.05)���。在美國(guó)����,F(xiàn)DA已批準(zhǔn)該藥開(kāi)展IgA腎病的Ⅲ期臨床試驗(yàn)�。
3.恒瑞1類(lèi)新藥獲批肺部感染臨床。恒瑞醫(yī)藥1類(lèi)化藥HRS-8427獲國(guó)家藥監(jiān)局臨床默示許可�,擬開(kāi)發(fā)用于肺部感染的治療�。HRS-8427可通過(guò)抑制細(xì)胞壁的生物合成發(fā)揮抑菌殺菌作用����,臨床前顯示其在多個(gè)標(biāo)準(zhǔn)菌株和臨床分離菌株構(gòu)建的小鼠感染模型中發(fā)揮抗菌藥效,且安全性良好�。此前,該新藥已獲CDE批準(zhǔn)開(kāi)展針對(duì)尿路感染的I期臨床�。
4.新型TRPV3抑制劑在華報(bào)IND。Kamari Pharma公司進(jìn)口1類(lèi)化藥KM-001乳膏的臨床試驗(yàn)申請(qǐng)獲CDE受理����。KM-001是一款TRPV3抑制劑,可與TRPV3通道結(jié)合���,阻斷其對(duì)離子的通透性����,從而減少其活性和對(duì)生理過(guò)程和疾病發(fā)展的影響���。TRPV3已被證明是導(dǎo)致瘙癢的重要通路之一。目前KM-001正在開(kāi)展兩項(xiàng)Ⅰ期臨床試驗(yàn)�,評(píng)估用于慢性單純性地衣和點(diǎn)狀掌跖角化病(PPKP1)/先天性厚甲癥(PC)患者的治療潛力�。
5.康寧杰瑞與斯微生物開(kāi)展臨床合作���。康寧杰瑞自研PD-L1/OX40雙抗KN052擬與斯微生物SWP1001個(gè)性化腫瘤疫苗開(kāi)展聯(lián)合用藥臨床研究。KN052能同時(shí)識(shí)別PD-L1與OX40����,可有效阻斷PD-L1與PD-1的相互作用,并激活OX40信號(hào)通路���。在MC38腫瘤模型中�,KN052已顯示出具有協(xié)同抗腫瘤活性�。該新藥去年2月已在國(guó)內(nèi)獲批開(kāi)展治療晚期實(shí)體瘤的Ⅰ期臨床。
6.和譽(yù)EGFR抑制劑授權(quán)給艾力斯����。和譽(yù)醫(yī)藥與艾力斯醫(yī)藥簽署《許可協(xié)議》,和譽(yù)醫(yī)藥授予后者新一代小分子表皮生長(zhǎng)因子受體酪氨酸激酶抑制劑(EGFR-TKI)ABK3376在中國(guó)(中國(guó)大陸����、香港、澳門(mén)和臺(tái)灣地區(qū))區(qū)域研究����、開(kāi)發(fā)、制造、使用以及銷(xiāo)售的獨(dú)家許可����。根據(jù)協(xié)議,和譽(yù)醫(yī)藥將獲得最高不超過(guò)1.8790億美元的首付款�、開(kāi)發(fā)及銷(xiāo)售里程碑付款,以及產(chǎn)品的銷(xiāo)售分成����。
國(guó)際藥訊
1.3月5款創(chuàng)新藥有望獲FDA批準(zhǔn)上市。根據(jù)PDUFA的預(yù)期目標(biāo)日期����,F(xiàn)DA預(yù)計(jì)3月將對(duì)5款創(chuàng)新藥物的批準(zhǔn)做出監(jiān)管決定。5款藥物分別為:Acadia公司擬用于治療Rett綜合征的新型合成類(lèi)似物Trofinetide����;Cidara公司擬用于治療念珠菌血癥與侵襲性念珠菌病的創(chuàng)新棘球白素Rezafungin;Pharming公司擬用于磷脂酰肌醇3-激酶δ綜合征的PI3K抑制劑Leniolisib���;BioMarin公司擬用于治療血友病A的基因療法Valoctocogene Roxaparvovec���;Biohaven/輝瑞擬用于治療偏頭痛的小分子CGRP拮抗劑Zavegepant。
2.IL-6單抗獲批治療風(fēng)濕性多肌痛���。FDA批準(zhǔn)再生元與賽諾菲聯(lián)合開(kāi)發(fā)的IL-6單抗sarilumab(商品名:Kevzara)新適應(yīng)癥����,用于治療對(duì)皮質(zhì)類(lèi)固醇(CS)反應(yīng)不佳或無(wú)法耐受皮質(zhì)類(lèi)固醇減量的風(fēng)濕性多肌痛成年患者����。在III期臨床(SAPHYR)中,與安慰劑相比����,sarilumab治療達(dá)到持續(xù)緩解的患者比例顯著更高(28%vs10%,p=0.0193)����。Sarilumab也是首款獲FDA批準(zhǔn)治療該疾病的生物制劑。
3.K藥治療早期NSCLC達(dá)Ⅲ期主要終點(diǎn)���。默沙東PD-1抗體Keytruda(pembrolizumab)聯(lián)合鉑類(lèi)化療用于新輔助治療可切除II�、IIIA���、IIIB期非小細(xì)胞肺癌(NSCLC)以及在患者手術(shù)后單藥輔助治療的Ⅲ期臨床達(dá)到共同無(wú)事件存活期(EFS)主要終點(diǎn)�。中期分析顯示���,與新輔助安慰劑+化療和手術(shù)后輔助安慰劑相比����,pembrolizumab的輔助與新輔助治療方案顯著改善患者的EFS;患者的病理學(xué)完全緩解(pCR)和主要病理緩解(mPR)均具統(tǒng)計(jì)顯著性的改善���。此外�,未觀察到新的安全性信號(hào)�。
4.補(bǔ)體C3靶向RNAi療法早期臨床積極。Arrowhead公司靶向補(bǔ)體蛋白C3的RNAi療法ARO-C3在Ⅰ/Ⅱ期臨床中獲積極結(jié)果�。中期結(jié)果顯示:ARO-C3導(dǎo)致血清中C3蛋白水平出現(xiàn)劑量依賴(lài)性降低,在檢驗(yàn)的最高劑量平均降低88%����。由于C3蛋白在補(bǔ)體信號(hào)通路中位于C5蛋白的上游,Arrowhead認(rèn)為它在治療多種補(bǔ)體介導(dǎo)疾病(包括IgA腎病����、C3腎小球病、陣發(fā)性睡眠性血紅蛋白尿和其他腎臟和血液學(xué)適應(yīng)癥)中具有潛力�。
5.CAR-T公司完成2億美元A輪融資。CARGO Therapeutics宣布完成2億美元的A輪融資�,以用于支持其靶向CD22的CAR-T候選療法CRG-022開(kāi)展Ⅱ期臨床試驗(yàn)。Ⅰ期臨床中期結(jié)果顯示����,在38例CD19靶向CAR-T療法耐藥的大B細(xì)胞淋巴瘤(LBCL)患者中�,CRG-022的客觀緩解率和完全緩解率分別達(dá)到68%和53%����,患者中位總生存期為22.5個(gè)月�。此前,該新藥已獲得FDA授予突破性療法認(rèn)定����。
6.默沙東退還NASH新藥權(quán)益。NGM Bio在2022年財(cái)報(bào)中披露����,默沙東已終止MK-3655(NGM313)治療非酒精性脂肪性肝炎(NASH)的IIb期研究,并于2023年4月底將MK-3655及其相關(guān)化合物的許可權(quán)全部歸還NGM Bio公司�。NGM313是一款β-Klotho/FGFR1c靶向單抗,擬開(kāi)發(fā)用于治療NASH和2型糖尿病���。在I期臨床中����,注射一次NGM313可顯著降低肥胖且具有胰島素抗性的非酒精性脂肪肝病(NAFLD)患者的肝臟脂肪水平����,并且改善多項(xiàng)代謝指標(biāo)����。
醫(yī)藥熱點(diǎn)
1.雷平任天津市衛(wèi)健委主任�。2月28日,天津市第十八屆人民代表大會(huì)常務(wù)委員會(huì)第一次會(huì)議通過(guò)一批人事任命�。其中提到,任命雷平為天津市衛(wèi)健委主任�。根據(jù)公開(kāi)信息,雷平�,中共黨員,醫(yī)學(xué)博士�,教授,主任醫(yī)師���,博士生導(dǎo)師����,國(guó)家“百千萬(wàn)”人才工程國(guó)家級(jí)人選���,國(guó)務(wù)院特貼專(zhuān)家����。天津市衛(wèi)健委官網(wǎng)“領(lǐng)導(dǎo)信息”欄目更新信息還顯示,雷平除擔(dān)任天津市衛(wèi)健委主任外���,還擔(dān)任天津市衛(wèi)健委黨委副書(shū)記���、天津市中醫(yī)藥管理局局長(zhǎng)、天津市愛(ài)國(guó)衛(wèi)生運(yùn)動(dòng)委員會(huì)辦公室主任���。
2.葛均波建議縮短醫(yī)生培養(yǎng)時(shí)間。全國(guó)兩會(huì)召開(kāi)前夕����,全國(guó)政協(xié)委員、中國(guó)科學(xué)院院士葛均波建議建立體系縮短醫(yī)生培養(yǎng)時(shí)間���。他表示���,目前國(guó)內(nèi)醫(yī)學(xué)生的畢業(yè)后教育和研究生培養(yǎng)是割裂的,醫(yī)院還有規(guī)培和專(zhuān)培制度����,體系較為混亂,應(yīng)該建立體系使人才培養(yǎng)更加節(jié)省時(shí)間���,醫(yī)生拿到執(zhí)業(yè)證書(shū)后����,哪怕不是博士也可以看病。葛均波表示����,學(xué)歷不等于能力,他呼吁建立協(xié)調(diào)機(jī)制�,讓好醫(yī)生、醫(yī)學(xué)科學(xué)家并存���,“兩條腿走路”���。
3.禮來(lái)胰島素狂降70%。3月1日�,禮來(lái)胰島素類(lèi)藥物全線降價(jià)70%。具體降價(jià)方式如下:非品牌賴(lài)脯胰島素(100U/ml)價(jià)格下調(diào)至25美元/瓶���,2023年5月1日生效�;品牌賴(lài)脯胰島素Humalog(100U/ml)和人胰島素Humulin(100U/ml)降價(jià)70%�,2023年四季度生效;可互換胰島素生物類(lèi)似藥Rezvoglar(甘精胰島素-aglr)5支裝KwikPens定價(jià)為92美元����,相當(dāng)于賽諾菲Lantus的78%折扣����,2023年4月1日生效���。
評(píng)審動(dòng)態(tài)
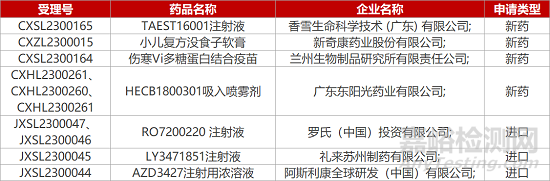
1. CDE新藥受理情況(03月02日)
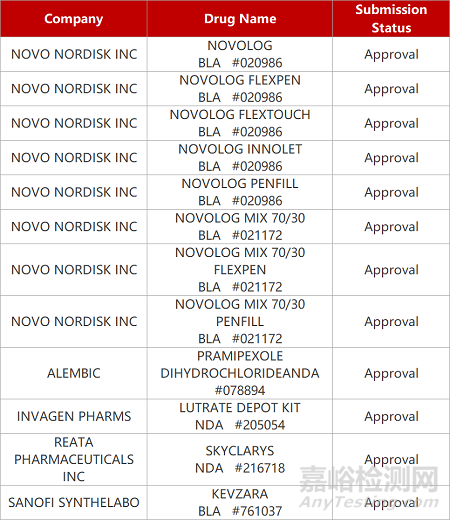
2. FDA新藥獲批情況(北美03月01日)