2023年3月2日�����,F(xiàn)DA藥品審評(píng)和研究中心發(fā)布了《Artificial Intelligence in Drug Manufacturing》討論文件�����,供公眾在2023年5月1日前提出意見�����。
人工智能是FRAME優(yōu)先考慮的四種技術(shù)之一
先進(jìn)的生產(chǎn)技術(shù)有可能提高生產(chǎn)過程和供應(yīng)鏈的可靠性和穩(wěn)健性�����,并增加美國(guó)公眾及時(shí)獲得優(yōu)質(zhì)藥品的機(jī)會(huì)。藥品審評(píng)和研究中心(CDER)建立了先進(jìn)生產(chǎn)評(píng)估監(jiān)管框架(Regulatory Advanced Manufacturing Evaluation�����,F(xiàn)RAME)計(jì)劃�����,以支持采用可以為患者帶來益處的先進(jìn)生產(chǎn)技術(shù)�����。
美國(guó)國(guó)家科學(xué)院�����、工程院和醫(yī)學(xué)院(NASEM)發(fā)布了一份報(bào)告�����,確定CDER可能遇到的具有推進(jìn)制藥生產(chǎn)潛力的創(chuàng)新�����。根據(jù)這份報(bào)告以及通過新興技術(shù)計(jì)劃與利益相關(guān)者的接觸�����,F(xiàn)RAME計(jì)劃優(yōu)先考慮四種技術(shù):
端到端連續(xù)生產(chǎn)(End-to-End Continuous Manufacturing,E2E CM):一個(gè)完全集成的過程�����,原材料不斷被輸入和轉(zhuǎn)化�����,藥品成品不斷被生產(chǎn)出來�����。
分布式生產(chǎn)(Distributed Manufacturing�����,DM):一個(gè)分散的生產(chǎn)平臺(tái)�����,其生產(chǎn)單元可以部署到多個(gè)位置�����。
即時(shí)護(hù)理生產(chǎn)(Point-of-Care Manufacturing�����,POC):一個(gè)DM平臺(tái)�����,其生產(chǎn)單元靠近患者護(hù)理�����,例如�����,在醫(yī)療機(jī)構(gòu)�����。
人工智能:可以感知環(huán)境�����、解釋數(shù)據(jù)和決定行動(dòng)的軟件和硬件系統(tǒng)�����。
以下是討論稿全文內(nèi)容。
1�����、簡(jiǎn)介
藥品審評(píng)和研究中心(CDER)的使命是確保人類藥物的安全和有效�����,符合既定的質(zhì)量標(biāo)準(zhǔn)�����,并提供給患者�����。為了推進(jìn)這一使命�����,F(xiàn)DA的"Pharmaceutical Quality for the 21st Century(21世紀(jì)藥品質(zhì)量計(jì)劃)"促進(jìn)了一個(gè)高效�����、敏捷和靈活的藥品生產(chǎn)部門�����,在沒有過度監(jiān)管的情況下可靠地生產(chǎn)優(yōu)質(zhì)藥品�����。
藥物開發(fā)的趨勢(shì)凸顯了對(duì)生產(chǎn)過程中更多靈活性的需求�����。
先進(jìn)生產(chǎn)(Advanced manufacturing)是一個(gè)術(shù)語�����,它描述了一種創(chuàng)新的藥品生產(chǎn)技術(shù)或方法�����,有可能提高生產(chǎn)過程的可靠性和穩(wěn)健性以及供應(yīng)鏈的彈性�����。先進(jìn)生產(chǎn)可以:(a)整合新的技術(shù)方法,(b)以創(chuàng)新的方式使用已有的技術(shù)�����,或(c)在沒有確定的最佳實(shí)踐的新領(lǐng)域中應(yīng)用生產(chǎn)方法�����。先進(jìn)生產(chǎn)可用于新的或目前上市的大分子或小分子藥物�����。
FDA已經(jīng)認(rèn)識(shí)到并接受了先進(jìn)生產(chǎn)的潛力�����。2014年�����,CDER建立了新興技術(shù)項(xiàng)目(Emerging Technology Program�����,ETP)�����,與企業(yè)合作�����,支持先進(jìn)生產(chǎn)的使用�����。CDER通過ETP觀察到先進(jìn)生產(chǎn)技術(shù)的快速出現(xiàn)�����,并認(rèn)識(shí)到監(jiān)管政策和計(jì)劃可能需要演變�����,讓技術(shù)得到及時(shí)采用�����。
美國(guó)國(guó)家科學(xué)�����、工程和醫(yī)學(xué)研究院在2021年發(fā)布了一份報(bào)告,題目是Innovation in Pharmaceutical Manufacturing on the Horizon: Technical Challenge, Regulatory Issues, and Recommendations(地平線上的藥品生產(chǎn)創(chuàng)新:技術(shù)挑戰(zhàn)�����、監(jiān)管問題和建議) �����,強(qiáng)調(diào)了綜合藥品生產(chǎn)過程中的創(chuàng)新�����。這些創(chuàng)新可能會(huì)對(duì)制藥生產(chǎn)中使用的測(cè)量�����、建模和控制技術(shù)產(chǎn)生影響�����。人工智能(AI)可能在監(jiān)測(cè)和控制先進(jìn)的生產(chǎn)過程中發(fā)揮重要作用�����。
2�����、范圍
當(dāng)FDA考慮將其基于風(fēng)險(xiǎn)的監(jiān)管框架應(yīng)用于藥品生產(chǎn)中的人工智能技術(shù)時(shí)�����,該機(jī)構(gòu)在本討論文件中確定了公眾反饋將是有價(jià)值的領(lǐng)域�����。CDER的科學(xué)和政策專家通過對(duì)適用于批準(zhǔn)使用人工智能技術(shù)生產(chǎn)的藥物的現(xiàn)有監(jiān)管要求進(jìn)行全面分析�����,確定了這些領(lǐng)域�����。
本討論文件中的考慮領(lǐng)域是FDA希望得到公眾反饋的領(lǐng)域�����。還有一些考慮的領(lǐng)域沒有包括在本文件中�����,例如,在如何將現(xiàn)有的《現(xiàn)行藥品生產(chǎn)質(zhì)量管理規(guī)范》(CGMP)法規(guī)應(yīng)用于人工智能方面可能存在的模糊性�����,或缺乏機(jī)構(gòu)的指導(dǎo)或經(jīng)驗(yàn)�����,都可能導(dǎo)致困難�����。本討論文件中提出的考慮領(lǐng)域集中在根據(jù)新藥申請(qǐng)(NDA)�����、簡(jiǎn)略新藥申請(qǐng)(ANDA)或生物制劑許可申請(qǐng)(BLA)上市的藥物產(chǎn)品的生產(chǎn)�����。
公眾反饋將有助于CDER對(duì)我們現(xiàn)有的監(jiān)管框架進(jìn)行評(píng)估�����。雖然最初的分析側(cè)重于由CDER監(jiān)管的產(chǎn)品,但FDA的生物制品評(píng)估和研究中心(CBER)也遇到了與人工智能相關(guān)的先進(jìn)生產(chǎn)技術(shù)的快速出現(xiàn)。因此�����,我們邀請(qǐng)CDER和CBER的利益相關(guān)者對(duì)討論問題提供反饋�����。
3�����、背景介紹
人工智能為制藥業(yè)提供了許多可能性�����,包括但不限于優(yōu)化工藝設(shè)計(jì)和工藝控制,智能監(jiān)測(cè)和維護(hù)�����,以及趨勢(shì)監(jiān)測(cè)以推動(dòng)持續(xù)改進(jìn)。使用人工智能來支持藥品生產(chǎn)�����,可以與其他先進(jìn)的生產(chǎn)技術(shù)一起部署�����,以實(shí)現(xiàn)預(yù)期的效益。人工智能是實(shí)施工業(yè)4.0模式的助推器�����,可以為生產(chǎn)商帶來一個(gè)控制良好、超級(jí)連接、數(shù)字化的生態(tài)系統(tǒng)和醫(yī)藥價(jià)值鏈�����。
通過與行業(yè)的互動(dòng),F(xiàn)DA收到了寶貴的反饋�����,包括潛在的人工智能在藥品生產(chǎn)中的使用案例�����。以下是基于這些互動(dòng)和對(duì)已發(fā)表信息的審查�����,預(yù)測(cè)人工智能如何用于制藥業(yè)的例子�����。這些例子并不詳盡�����,人工智能在制藥業(yè)的潛在應(yīng)用可能會(huì)繼續(xù)發(fā)展�����。
工藝設(shè)計(jì)和放大�����?����?梢岳脵C(jī)器學(xué)習(xí)等人工智能模型--使用工藝開發(fā)數(shù)據(jù)生成--更快速地確定最佳加工參數(shù)或放大工藝�����,減少開發(fā)時(shí)間和浪費(fèi)�����。
先進(jìn)工藝控制(APC)�����。APC允許對(duì)生產(chǎn)過程進(jìn)行動(dòng)態(tài)控制�����,以達(dá)到理想的產(chǎn)出。人工智能方法也可用于開發(fā)過程控制�����,通過使用人工智能與實(shí)時(shí)傳感器數(shù)據(jù)相結(jié)合�����,可以預(yù)測(cè)過程的進(jìn)展情況�����。將對(duì)生產(chǎn)過程中發(fā)生的基本化學(xué)�����、物理和生物轉(zhuǎn)化的理解與人工智能技術(shù)相結(jié)合的APC方法預(yù)計(jì)將看到越來越多的采用�����,并且已經(jīng)被一些制藥公司報(bào)告�����。
過程監(jiān)控和故障檢測(cè)�����。人工智能方法可用于監(jiān)測(cè)設(shè)備�����,并檢測(cè)出與正常性能不同的變化�����,從而觸發(fā)維護(hù)活動(dòng)�����,減少工藝停工時(shí)間�����。人工智能方法也可用于監(jiān)測(cè)產(chǎn)品質(zhì)量�����,包括包裝質(zhì)量(例如�����,基于視覺的質(zhì)量控制,使用包裝�����、標(biāo)簽或玻璃瓶的圖像�����,由基于人工智能的軟件進(jìn)行分析�����,以檢測(cè)產(chǎn)品的特定質(zhì)量屬性要求的偏差)�����。
趨勢(shì)監(jiān)測(cè)�����。人工智能可用于檢查消費(fèi)者投訴和包含大量文本的偏差報(bào)告�����,以確定集中問題領(lǐng)域并優(yōu)先考慮持續(xù)改進(jìn)的領(lǐng)域�����。這提供了識(shí)別生產(chǎn)相關(guān)偏差的趨勢(shì)的優(yōu)勢(shì)�����,以支持更全面的根源識(shí)別�����。與工藝性能和工藝能力指標(biāo)相結(jié)合的人工智能方法可用于主動(dòng)監(jiān)測(cè)生產(chǎn)業(yè)務(wù)的趨勢(shì)�����。這些方法還可以預(yù)測(cè)觸發(fā)糾正和預(yù)防行動(dòng)有效性評(píng)估的閾值�����。
4�����、術(shù)語
以下定義僅用于本討論文件的目的�����。
人工智能(AI)。計(jì)算機(jī)科學(xué)�����、統(tǒng)計(jì)學(xué)和工程學(xué)的一個(gè)分支�����,使用表現(xiàn)出學(xué)習(xí)�����、決策和預(yù)測(cè)等行為的算法或模型�����。
機(jī)器學(xué)習(xí)(ML)�����。人工智能的一個(gè)分支�����,為系統(tǒng)提供通過分析數(shù)據(jù)開發(fā)模型的能力�����,而不需要明確的編程�����,并根據(jù)數(shù)據(jù)或經(jīng)驗(yàn)加以改進(jìn)�����。
模型(Model)�����。對(duì)一個(gè)物理系統(tǒng)的抽象描述�����,以任何形式(包括數(shù)學(xué)�����、符號(hào)�����、圖形或描述性)表示該物理系統(tǒng)的某個(gè)方面。
云計(jì)算(Cloud Computing)�����。一種模式�����,用于實(shí)現(xiàn)無處不在的�����、方便的�����、按需的網(wǎng)絡(luò)訪問�����,共享可配置的計(jì)算資源(例如�����,網(wǎng)絡(luò)�����、服務(wù)器�����、存儲(chǔ)�����、應(yīng)用�����、服務(wù))�����,可以快速配置和釋放�����,只需最小的管理努力或服務(wù)提供商的互動(dòng)�����。
元數(shù)據(jù)(Metadata)。了解數(shù)據(jù)所需的背景信息�����。
邊緣計(jì)算(Edge Computing)�����。在特定數(shù)據(jù)源處或附近完成的分布式計(jì)算形式�����。
數(shù)據(jù)管理(Data Management)�����。收集�����、存儲(chǔ)�����、組織、維護(hù)和保護(hù)一個(gè)組織所創(chuàng)建的數(shù)據(jù)的過程�����。
物聯(lián)網(wǎng)(IOT):一種網(wǎng)絡(luò)物理系統(tǒng)�����,包括相互連接的計(jì)算設(shè)備�����、傳感器�����、儀器和設(shè)備�����,在線整合成一個(gè)有凝聚力的設(shè)備網(wǎng)絡(luò)�����,其中包含硬件�����、軟件�����、固件和執(zhí)行器�����,使設(shè)備能夠連接�����、互動(dòng)并交換數(shù)據(jù)和信息�����。物聯(lián)網(wǎng)設(shè)備包括傳感器�����、控制器和機(jī)械設(shè)備�����。
5、與人工智能相關(guān)的考慮領(lǐng)域
1)云應(yīng)用可能會(huì)影響對(duì)藥品生產(chǎn)數(shù)據(jù)和記錄的監(jiān)督
隨著云計(jì)算和邊緣計(jì)算的不斷發(fā)展�����,涉及藥品生產(chǎn)的軟件的部署位置可能發(fā)生變化�����。例如�����,控制執(zhí)行的軟件可能仍然在靠近生產(chǎn)設(shè)備的地方部署�����,以確保不影響性能或安全�����,而其他不是時(shí)間關(guān)鍵的軟件功能可以在云中進(jìn)行(例如�����,模型更新�����、控制診斷和過程監(jiān)控分析)�����。第三方數(shù)據(jù)管理系統(tǒng)可用于數(shù)據(jù)存儲(chǔ)之外的功能�����。例如�����,存儲(chǔ)在這些系統(tǒng)中的數(shù)據(jù)可以由人工智能進(jìn)行分析�����,以支持過程監(jiān)測(cè)和APC的模型�����。
在這些環(huán)境中必須確保數(shù)據(jù)的完整性和數(shù)據(jù)質(zhì)量�����。雖然FDA允許在生產(chǎn)商的適當(dāng)監(jiān)督下使用第三方的CGMP功能,但生產(chǎn)商和第三方之間現(xiàn)有的質(zhì)量協(xié)議(例如�����,云數(shù)據(jù)管理)在管理生產(chǎn)監(jiān)測(cè)和控制方面的人工智能風(fēng)險(xiǎn)方面可能存在差距�����。在檢查過程中�����,這可能導(dǎo)致在確保第三方創(chuàng)建和更新人工智能軟件時(shí)有適當(dāng)?shù)臄?shù)據(jù)安全和保障措施方面的挑戰(zhàn)�����。
此外�����,由于管理第三方云數(shù)據(jù)和模型的復(fù)雜性�����,F(xiàn)DA對(duì)記錄管理的證據(jù)收集的檢查方法可能需要擴(kuò)大�����。例如�����,云應(yīng)用程序和流程控制之間的持續(xù)互動(dòng)可能會(huì)使建立數(shù)據(jù)可追溯性的能力復(fù)雜化�����,產(chǎn)生潛在的網(wǎng)絡(luò)安全漏洞�����,并需要在檢查期間評(píng)估監(jiān)測(cè)數(shù)據(jù)完整性漏洞的現(xiàn)有程序�����。
一些潛在的相關(guān)要求和政策
Regulations:
21 CFR 11, 211.180, 211.184, 211.194, 600.12
Draft Guidance for Industry:
Data Integrity and Compliance with CGMP (April 2016)
Guidance for Industry:
Contract Manufacturing Arrangements for Drugs: Quality Agreements (November 2016)
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
2)物聯(lián)網(wǎng)可能會(huì)增加藥品生產(chǎn)過程中產(chǎn)生的數(shù)據(jù)量�����,影響現(xiàn)有的數(shù)據(jù)管理實(shí)踐
生產(chǎn)控制的數(shù)字化可能會(huì)產(chǎn)生更多關(guān)于工藝和產(chǎn)品的信息�����。數(shù)據(jù)的增加可能體現(xiàn)在記錄數(shù)據(jù)的頻率和類型兩方面。有法規(guī)和指南涉及每批藥品生產(chǎn)的數(shù)據(jù)和元數(shù)據(jù)的存儲(chǔ)量�����;但是�����,如果生產(chǎn)過程中收集的原始數(shù)據(jù)顯著增加�����,可能需要結(jié)合數(shù)據(jù)管理組織工作�����,平衡數(shù)據(jù)的完整性和保留�����。
申請(qǐng)人可能需要明確生成數(shù)據(jù)的監(jiān)管合規(guī)性(例如�����,哪些數(shù)據(jù)需要存儲(chǔ)和/或?qū)彶?����,以及這些數(shù)據(jù)的丟失將如何影響未來的質(zhì)量決策�����,如產(chǎn)品召回)�����。此外�����,申請(qǐng)人可能需要進(jìn)一步明確數(shù)據(jù)采樣率�����、數(shù)據(jù)壓縮或其他數(shù)據(jù)管理方法�����,以確保保持藥品生產(chǎn)過程的準(zhǔn)確記錄�����。
另外,在以結(jié)構(gòu)化的方式存儲(chǔ)數(shù)據(jù)�����,以便檢索和分析以支持申請(qǐng)人的決策方面可能存在挑戰(zhàn)�����。此外�����,隨著生產(chǎn)設(shè)備互聯(lián)成網(wǎng)�����,維護(hù)設(shè)備所產(chǎn)生的這些數(shù)據(jù)的管理�����、隱私和安全�����,可能對(duì)保持產(chǎn)品質(zhì)量或維持藥品生產(chǎn)構(gòu)成挑戰(zhàn)�����。
一些潛在的相關(guān)要求和政策
Regulations:
21 CFR 211 Subparts D and J
Draft Guidance for Industry:
Data Integrity and Compliance with CGMP (April 2016)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
3)申請(qǐng)人可能需要明確人工智能在藥品生產(chǎn)中的應(yīng)用是否以及如何受到監(jiān)管部門的監(jiān)督
人工智能可用于各種生產(chǎn)操作�����,如監(jiān)測(cè)和維護(hù)設(shè)備�����,確定需要持續(xù)改進(jìn)的領(lǐng)域�����,調(diào)度和供應(yīng)鏈物流�����,以及原材料的特性�����。申請(qǐng)人需要了解人工智能在受監(jiān)管部門監(jiān)督的生產(chǎn)業(yè)務(wù)中的應(yīng)用(例如�����,CGMP合規(guī)性、新藥或生物制品許可證申請(qǐng))�����。
一些潛在的相關(guān)要求和政策
Regulations:
21 CFR 11, 211.68, 211.84, 211.180, 211.184, 314.50, 314.94, 601.20
Draft Guidance for Industry:
ICH Q9(R1) Quality Risk Management (June 2022)
ICH Q12 Implementation Considerations for FDA-Regulated Products (May 2021)
Data Integrity and Compliance with CGMP (April 2016)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
ICH Q8(R2) Pharmaceutical Development (November 2009)
ICH Q10 Pharmaceutical Quality System (April 2009)
ICH Q11 Development and Manufacture of Drug Substances (November 2012)
ICH Q12 Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management (May 2021)
Q8, Q9, & Q10 Questions and Answers — Appendix: Q&As from Training Sessions (July 2012)
Process Validation: General Principles and Practices (January 2011)
Compliance Program:
7346.832 — Preapproval Inspections (October 2022)
7356.002 — Drug Manufacturing Inspections (October 2022)
7356.002M — Surveillance Inspections of Protein Drug Substance Manufacturers (October 2021)
4)申請(qǐng)人可能需要開發(fā)和驗(yàn)證用于過程控制和支持釋放測(cè)試的AI模型的標(biāo)準(zhǔn)
人工智能可用于APC應(yīng)用中�����,通過基于實(shí)時(shí)數(shù)據(jù)調(diào)整工藝參數(shù)來控制生產(chǎn)過程�����。此外�����,人工智能模型可以與過程中的材料或最終產(chǎn)品的審查結(jié)合起來使用�����,以:(1)支持過程中或最終產(chǎn)品測(cè)試的分析程序�����,(2)支持實(shí)時(shí)釋放測(cè)試�����,或(3)預(yù)測(cè)過程中產(chǎn)品質(zhì)量屬性�����。在開發(fā)和驗(yàn)證影響產(chǎn)品質(zhì)量的模型方面�����,可用的行業(yè)標(biāo)準(zhǔn)和FDA指南有限�����,這可能對(duì)建立特定用途的模型的可信度造成挑戰(zhàn)�����。
基礎(chǔ)數(shù)據(jù)的穩(wěn)健性決定了人工智能模型的決策�����。這可能會(huì)在避免模型開發(fā)和驗(yàn)證過程中出現(xiàn)意外的偏見方面帶來挑戰(zhàn)�����。人工智能模型也可以存儲(chǔ)在為特定用例開發(fā)過程中獲得的知識(shí),然后將其應(yīng)用于不同但相關(guān)的用例�����,以加速模型的開發(fā)�����。申請(qǐng)人和生產(chǎn)商可能需要明確如何在模型開發(fā)和驗(yàn)證中考慮將學(xué)習(xí)從一個(gè)人工智能模型轉(zhuǎn)移到另一個(gè)模型的可能性�����。
隨著人工智能方法變得越來越復(fù)雜�����,解釋模型輸入的變化如何影響模型的輸出變得越來越有挑戰(zhàn)性�����。在這些情況下�����,申請(qǐng)人可能面臨的挑戰(zhàn)是如何定義驗(yàn)證模型的標(biāo)準(zhǔn),并維持模型輸出的可解釋性和對(duì)產(chǎn)品質(zhì)量的影響�����。
一些潛在的相關(guān)要求和政策
Regulations:
21 CFR 11, 211.68, 211.110, 211.165, 211.180
Draft Guidance for Industry:
ICH Q14 Analytical Procedure Development (August 2022)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
ICH Q8(R2) Pharmaceutical Development (November 2009)
ICH Q9 Quality Risk Management (June 2006)
ICH Q10 Pharmaceutical Quality System (April 2009)
ICH Q11 Development and Manufacture of Drug Substances (November 2012)
Process Validation: General Principles and Practices (January 2011)
Development and Submission of Near Infrared Analytical Procedures (August 2021)
Compliance Program:
7346.832 — Preapproval Inspections (October 2022)
7356.002 — Drug Manufacturing Inspections (October 2022)
7356.002M — Surveillance inspections of Protein Drug Substance Manufacturers (October 2021)
5)不斷學(xué)習(xí)適應(yīng)實(shí)時(shí)數(shù)據(jù)的人工智能系統(tǒng)可能對(duì)監(jiān)管評(píng)估和監(jiān)督提出挑戰(zhàn)
在目前的范式中�����,部署在生產(chǎn)中的模型(如過程中的控制�����、實(shí)時(shí)釋放測(cè)試)是通過制藥質(zhì)量體系內(nèi)的變更控制過程�����,根據(jù)需要進(jìn)行開發(fā)�����、驗(yàn)證�����、實(shí)施和更新�����。人工智能模型(例如�����,基于機(jī)器學(xué)習(xí)的模型)可以持續(xù)學(xué)習(xí)�����,其中模型隨著新信息的出現(xiàn)而不斷發(fā)展�����。
要確定人工智能模型何時(shí)可被視為一個(gè)過程的既定條件�����,這可能是一個(gè)挑戰(zhàn)�����。作為產(chǎn)品生命周期中模型維護(hù)的一部分�����,確定對(duì)模型變化的監(jiān)管標(biāo)準(zhǔn)也可能是一個(gè)挑戰(zhàn)。申請(qǐng)人可能需要明確:(a)對(duì)模型生命周期戰(zhàn)略的驗(yàn)證的期望�����,以及FDA在現(xiàn)場(chǎng)檢查期間對(duì)不斷更新的人工智能控制模型的檢查方法�����,以及(b)在人工智能模型引入生產(chǎn)條件的變化后建立產(chǎn)品可比性的期望�����,特別是對(duì)生物產(chǎn)品�����。
一些潛在的相關(guān)要求和政策
Regulations:
21 CFR 11, 211.68, 211.180, 314.70, 314.97, 601.12
Draft Guidance for Industry:
ICH Q12 Implementation Considerations for FDA-Regulated Products (May 2021)
Guidance for Industry:
ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients (September 2016)
Q8, Q9, & Q10 Questions and Answers — Appendix: Q&As from Training Sessions (July 2012)
ICH Q12 Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management (May 2021)
Development and Submission of Near Infrared Analytical Procedures (August 2021)
Changes to an Approved NDA or ANDA (April 2004)
Changes to an Approved Application for Specified Biotechnology and Specified Synthetic Biological Products (July 1997)
SUPAC-MR: Modified Release Solid Oral Dosage Forms Scale-Up and Post-Approval Changes: Chemistry, Manufacturing, and Controls; In Vitro Dissolution Testing and In Vivo Bioequivalence Documentation: Guidance for Industry (October 1997)
SUPAC-IR: Immediate-Release Solid Oral Dosage Forms: Scale-Up and Post-Approval Changes: Chemistry, Manufacturing and Controls, In Vitro Dissolution Testing, and In Vivo Bioequivalence Documentation (November 1995)
6�����、AI問題和反饋部分
1)你設(shè)想哪些類型的人工智能應(yīng)用會(huì)被用于藥品生產(chǎn)�����?
2)目前的監(jiān)管框架是否有其他方面(例如�����,上面沒有列出的方面)可能會(huì)影響人工智能在藥品生產(chǎn)中的實(shí)施�����,并應(yīng)由FDA考慮�����?
3)藥品生產(chǎn)中的人工智能領(lǐng)域的指導(dǎo)是否有益�����?如果是這樣�����,應(yīng)考慮人工智能技術(shù)的哪些方面�����?
4)生產(chǎn)商在CGMP環(huán)境中實(shí)施基于人工智能的模型的必要因素是什么�����?
5)驗(yàn)證和維護(hù)自學(xué)人工智能模型的常見做法是什么,需要考慮哪些步驟來建立最佳做法�����?
6)在藥品生產(chǎn)中�����,管理用于生成人工智能模型的數(shù)據(jù)的必要機(jī)制是什么�����?
7)在為制藥業(yè)實(shí)施模型(包括基于人工智能的模型)的過程中�����,是否有其他方面需要進(jìn)一步指導(dǎo)�����?
8)本文件中未涉及的人工智能在藥品生產(chǎn)中的應(yīng)用�����,是否有FDA應(yīng)該考慮的方面�����?
7�����、總結(jié)
本討論文件提出了需要考慮的領(lǐng)域和潛在的政策發(fā)展�����。
CDER 在評(píng)估現(xiàn)有監(jiān)管框架在藥品生產(chǎn)中應(yīng)用人工智能的基礎(chǔ)上�����,確定了需要考慮的領(lǐng)域和潛在的政策發(fā)展�����。先進(jìn)生產(chǎn)評(píng)估的監(jiān)管框架將解決這些領(lǐng)域的問題�����,同時(shí)也考慮潛在的變化會(huì)如何影響現(xiàn)有的技術(shù)和設(shè)施�����。CDER將利用提交給備查文件的反饋意見為未來的政策制定提供參考。請(qǐng)將您對(duì)本討論文件的意見提交至 https:// www.regulations.gov�����,備查文件號(hào):FDA-2023-N-0487�����。
8�����、附錄
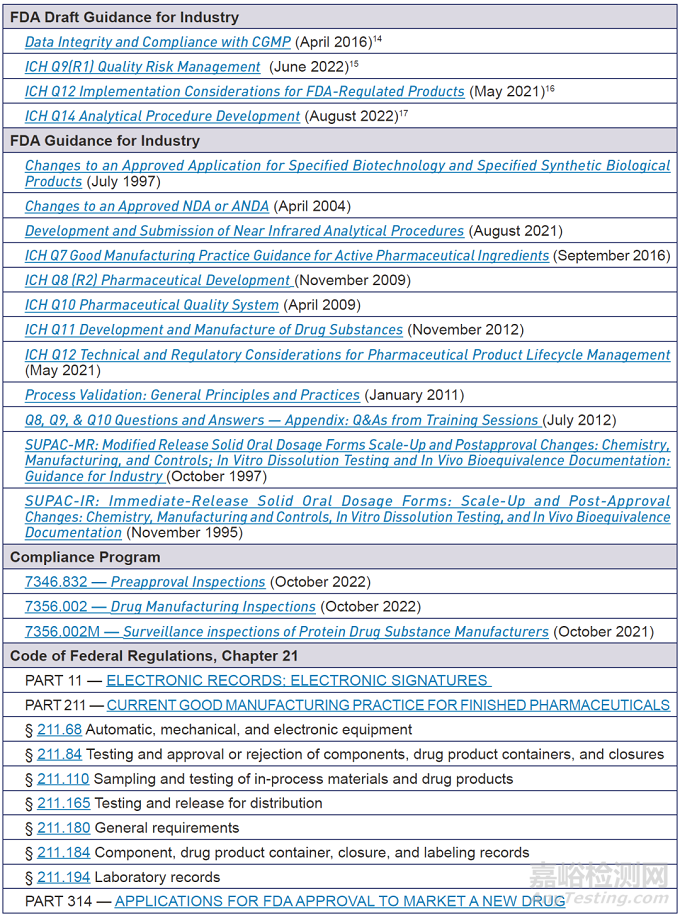
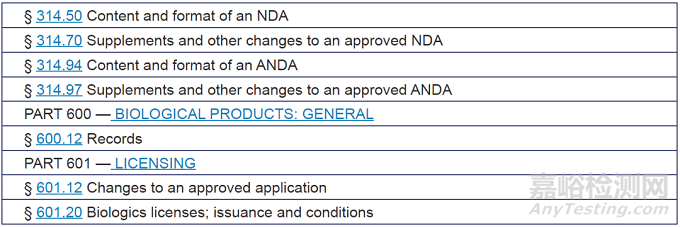
附錄A:相關(guān)指南�����、政策和法規(guī)
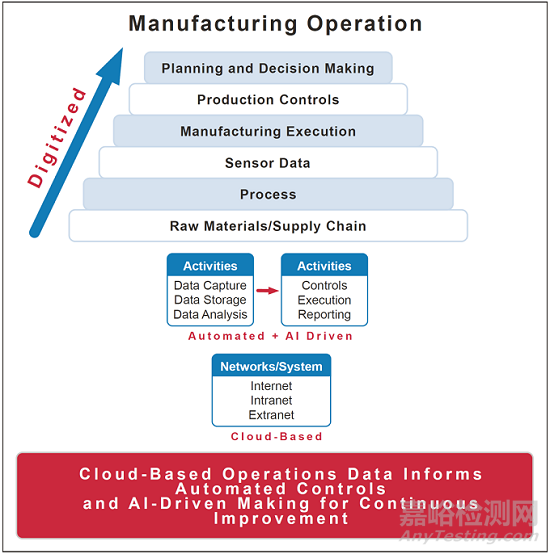
附錄B:人工智能技術(shù)概述
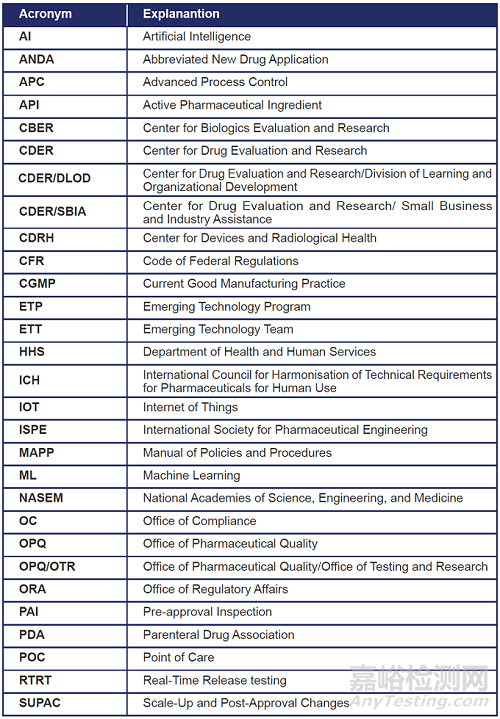
附錄C:首字母縮寫詞和縮略語
參考資料
https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/cders-framework-regulatory-advanced-manufacturing-evaluation-frame-initiative
https://www.fda.gov/media/165743/download