摘要
本文對國內(nèi)外有關(guān)化學(xué)藥品貯藏條件的法規(guī)指南�、現(xiàn)行藥典進(jìn)行調(diào)研和對比分析,結(jié)合已上 市藥品貯藏條件表述存在的問題�,提出化學(xué)藥品貯藏條件制定的考慮與建議�,以期為化學(xué)藥品貯藏條件規(guī)范 化提供參考。
背景
藥品穩(wěn)定性除與自身結(jié)構(gòu)����、理化性質(zhì)及處方工藝有關(guān)外,與藥品包裝容器和貯藏條件也有很大關(guān)系��,如溫度����、濕度��、光照��、空氣中氧氣和微生物等����,不當(dāng)?shù)馁A藏條件對藥品質(zhì)量有很大影響�,進(jìn)而影響藥品的安全性和有效性。本文通過檢索國內(nèi)外法規(guī)指南��、藥典規(guī)定等對化學(xué)藥品貯藏條件要求進(jìn)行對比分析��,并結(jié)合貯藏條件表述存在的問題提出化學(xué)藥品貯藏條件制定的考慮與建議��,供同行參考��。
1����、國內(nèi)法規(guī)和技術(shù)指南
我國關(guān)于貯藏條件的法規(guī)及技術(shù)指南涵蓋藥品研發(fā)、注冊及上市后流通等藥品全生命周期����。
國家藥品監(jiān)督管理局于 2015 年發(fā)布的《化學(xué)藥品原料藥和制劑穩(wěn)定性研究指導(dǎo)原則》[1]中規(guī)定,應(yīng)基于對穩(wěn)定性信息的全面評估制定貯藏條件,對不能冷凍的藥品應(yīng)有特殊的說明��,避免使用如“環(huán)境條件”或“室溫”等不確切的表述��。
《藥品說 明 書 和 標(biāo) 簽 管 理 規(guī) 定》( 局 令 第 24號) 及其規(guī)范細(xì)則[2-4]����、《化學(xué)藥品及生物制品說明書通用格式和撰寫指南》[5]中規(guī)定,【貯藏】項(xiàng)下“具體條件的表示方法按《中華人民共和國藥典》要求書寫����,并注明具體溫度,如: 陰 涼 處( 不 超 過20 ℃ ) 保存�。”
《藥品經(jīng)營質(zhì)量管理規(guī)范》2016 年版[6]中規(guī)定,按包裝標(biāo)示的溫度要求儲存藥品�,包裝上沒有標(biāo)示具體溫度的,按照《中華人民共和國藥典》規(guī)定的藏要求進(jìn)行儲存; 儲存藥品的相對濕度為 35% ~75% ; 強(qiáng)化冷鏈管理�,加強(qiáng)冷藏、冷凍藥品溫濕度的控制和設(shè)施設(shè)備要求��,確保全過程冷鏈�。
我國關(guān)于貯藏條件的法規(guī)及技術(shù)指南對不同階段藥品貯藏條件的制定和管理具有指導(dǎo)作用��,但涉及內(nèi)容較為概括����,對具體藥品的貯藏條件制定和規(guī)范撰寫指導(dǎo)作用有限����。
2����、國外法規(guī)和技術(shù)指南
2.1 美國法規(guī)和技術(shù)指南
美國聯(lián)邦法規(guī)21CFR Sec. 201規(guī)定了處方藥和非處方藥說明書及標(biāo)簽內(nèi)容和格式要求。其中處方藥專業(yè)醫(yī)師藥品說明書中在“16 如何供應(yīng)/貯藏和處理”項(xiàng)下規(guī)定�,應(yīng)描述“特殊處理和貯藏條件”; 患者說明書如患者信息(patient information) 、用藥指導(dǎo)(medication guides) 或使用說明 (instruction for use)等在不同位置均有“我該如何儲藏藥品”的相關(guān)描述��,且不同形式患者說明書相關(guān)描述項(xiàng)下均增加了“將藥品放置在兒童接觸不到的地方”的描述����。非處方藥說明書在“其他信息”項(xiàng)下提供貯藏要求,并在“警告”項(xiàng)下有“放在兒童接觸不到的地方”的描述����,該描述有時(shí)可省略。
《藥品標(biāo)簽中兒童防開啟包裝聲明》[7]中規(guī)定�,如果使用了兒童防開啟包裝,應(yīng)在說明書及標(biāo)簽中明確處方藥說明書在“16 如何供應(yīng)/貯藏和處理”和“我該如何儲藏藥品”項(xiàng)下寫明��,非處方藥建議與貯藏條件一并寫在“其他信息”項(xiàng)下��。
2.2 歐洲法規(guī)和技術(shù)指南
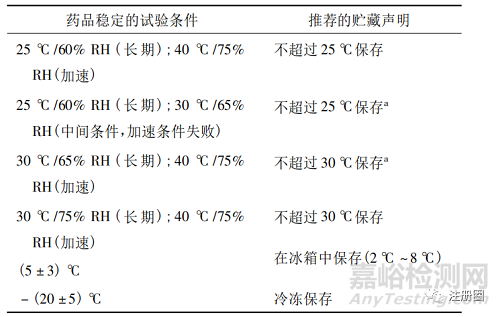
歐盟委員會發(fā)布的《產(chǎn)品特征概要( SmPC) 撰寫指南》[8]中包含“6.4 貯藏特別注意事項(xiàng)”��,規(guī)定應(yīng)列出未開啟包裝的藥品貯藏條件以及已開啟包裝�、稀釋或復(fù)溶的無菌藥品貯藏條件。2007年歐盟發(fā)布了《貯藏條件聲明的指南》[9]��,其根據(jù)不同穩(wěn)定性試驗(yàn)考察結(jié)果�,提供了推薦的原料藥和制劑貯藏條件具體描述(見表1和表2) ,以指導(dǎo)藥品貯藏條件的制定與規(guī)范撰寫����。1998 年歐盟發(fā)布了《無菌藥品開啟后有效期指南》[10],分別列出了有無防腐劑的無菌產(chǎn)品推薦的使用中穩(wěn)定性貯藏條件規(guī)范描述�,可供參考。
表 1-根據(jù)穩(wěn)定性試驗(yàn)結(jié)果推薦的貯藏條件
a:根據(jù)藥物形式和產(chǎn)品特性��,藥品在低溫下可能會因物理變化而變質(zhì)����。在某些情況下��,低溫也可能對包裝產(chǎn)生影響��?�?紤]到這種可能性,可能需要額外的聲明;
b:SPC 和包裝說明書( PL) 應(yīng)包括溫度具體范圍��,如 2 ℃ ~ 8 ℃; c: SPC 和 PL 要以下聲明: 該藥品不需要任何特殊的存儲條件;
d:在決定是否需要冷藏運(yùn)輸時(shí),應(yīng)考慮 25 ℃ /60% RH( 加速) 下的穩(wěn)定性數(shù)據(jù)�。該語句只應(yīng)在特殊情況下使用;
e:該語句只應(yīng)在關(guān)鍵時(shí)使用
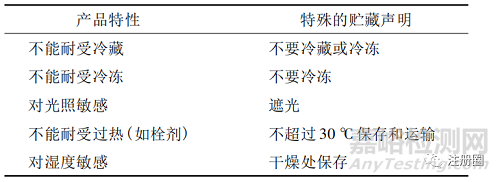
表 2-基于包裝的額外貯藏說明
a:當(dāng)使用此類標(biāo)準(zhǔn)聲明時(shí),應(yīng)添加藥品是否對光和/或濕氣敏感的說明;
b:評估的詳細(xì)信息包含在 CPMP /人用藥品注冊技術(shù)要求國際協(xié)調(diào)會( ICH)穩(wěn)定性指南中;
c: 應(yīng)使用容器的實(shí)際名稱,如瓶��、泡罩
《產(chǎn)品特征概要(SmPC) 撰寫指南》規(guī)定�,對于使用兒童防開啟包裝的,應(yīng)在包裝項(xiàng)下進(jìn)行說明。不在SmPC 貯藏項(xiàng)下撰寫“請將本品置于兒童接觸不到的地方”等描述�,查詢歐洲 EMA 官方網(wǎng)站發(fā)布的 SmPC�,Label 和 Package Leaflet 撰寫模板以及多個歐洲獲批上市藥品說明書可知,一 般在標(biāo)簽(label) 和包裝說明書(package leaflet) 中有專門章節(jié)對兒童不可觸及進(jìn)行描述�。
2.3 日本法規(guī)和技術(shù)指南
日本發(fā)布了《處方藥說明書記載要點(diǎn)》[11]以及《處方藥說明書記載要點(diǎn)注意事項(xiàng)》[14]、《非處方藥說明書記載要點(diǎn)》[15]以及《非處方藥說明書記載要點(diǎn)注意事項(xiàng)》[16]等指南,其中對貯藏條件均有不同程度的規(guī)定�。處方藥說明書中應(yīng)該包括長期貯藏條件以及開封后暫存條件����,并記載“應(yīng)存放在兒童接觸不到的地方”等相關(guān)描述�。非處方藥說明書中對貯藏條件沒有特殊要求����。
美國和日本針對化學(xué)藥品穩(wěn)定性研究的指南較為簡略����,主要針對說明書中貯藏條件的撰寫提出要求����。歐盟《貯藏條件聲明的指南》和《無菌藥品開啟后有效期指南》詳細(xì)描述了藥品貯藏條件該如何撰寫并提供了貯藏條件推薦的描述����,對藥品貯藏條件的制定與規(guī)范撰寫具有實(shí)際的指導(dǎo)意義��。
3、ICH/WHO 國際組織相關(guān)技術(shù)指南
3.1 WHO 技術(shù)指南
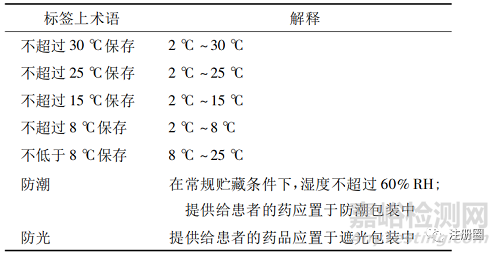
WHO 早在1996年發(fā)布了《原料藥和制劑穩(wěn)定性指導(dǎo)原則》[15]�,2009年進(jìn)行了更新[16]�,要求應(yīng)根據(jù)穩(wěn)定性試驗(yàn)結(jié)果確定貯藏條件�,以確保整個生命周期內(nèi)藥品的質(zhì)量����、安全和有效�。更新后穩(wěn)定性指導(dǎo)原則在附錄中增加了標(biāo)簽中推薦的貯藏聲明和特殊的貯藏聲明(見表3和表4) ,與歐盟《貯藏條件聲明的指南》相似但具體要求又不完全相同����。2003 年發(fā)布了《良好的藥品貯藏規(guī)范指南》[19]�,對藥品貯藏環(huán)境��、溫度監(jiān)測�、文件記錄等有明確規(guī)定,同時(shí)對貯藏條件術(shù)語進(jìn)行了解釋,如“常規(guī)貯藏條件”指在干燥��、通風(fēng)處保存�,溫度為 15 ℃ ~ 25 ℃����,或根據(jù)氣候帶不同��,最高溫度為 30 ℃��,無異味��、其他污染和強(qiáng)光照射; 其他標(biāo)簽中貯藏條件術(shù)語解釋見表 5。
表 3-推薦的貯藏聲明
a:必要時(shí)增加“防潮”
表 4-其他特殊的貯藏聲明
表 5-對標(biāo)簽上術(shù)語的解釋
WHO 為全球性組織,其制定的穩(wěn)定性指導(dǎo)原則綜合考慮全球不同的氣候與條件��。處于氣候帶 III( 干熱帶) 和氣候帶 IV( 濕熱帶) 的國家和地區(qū)不屬于 ICH 區(qū)域范疇����,這些國家和地區(qū)可根據(jù) WHO 穩(wěn)定性指南定義長期穩(wěn)定性試驗(yàn)條件,如30 ℃ /75%RH����。由于 WHO 涉及的國家及區(qū)域廣泛�,因此制定《貯藏條件聲明的指南》時(shí)嚴(yán)格根據(jù)長期穩(wěn)定性試驗(yàn)條件確定藥品的貯藏條件并注明具體溫度��,以避免含糊不清的貯藏條件描述使得同一藥品在不同氣候帶上市銷售時(shí)因不當(dāng)貯藏引起安全性風(fēng)險(xiǎn)��。
3.2 ICH 技術(shù)指南
我國已加入 ICH,在藥品的研究與評價(jià)方面應(yīng)遵循 ICH 三方協(xié)調(diào)指導(dǎo)原則�。ICH Q1A ~ 1E 為新原料藥和制劑的穩(wěn)定性試驗(yàn)指導(dǎo)原則��,Q1A 中提供了一般情況( 25 ℃ /60% RH 或 30 ℃ /65% RH) 、擬冷藏( 5 ± 3) ℃�、擬冷凍 - ( 20 ± 5) ℃ 貯藏藥物的穩(wěn)定性試驗(yàn)條件,Q1B 中提供了光穩(wěn)定試驗(yàn)條件����,選擇的試驗(yàn)條件和研究時(shí)長應(yīng)充分考慮貯藏����、運(yùn)輸和使用的整個過程,根據(jù)穩(wěn)定性試驗(yàn)結(jié)果確定藥物的貯藏條件。
4、各國藥典對比
各國藥典概論部分均收載有貯藏條件的表述�,主要涵蓋光照�、包裝狀態(tài)和溫度�,美國藥典還對“干燥處”進(jìn)行了闡述����。但具體到某一維度�,各國藥典的具體規(guī)定尚存在一定差異。如貯藏溫度( 見表6) ����,各國藥典收載情況并不相同。各藥典收載的包裝狀態(tài)也不盡相同����,《中華人民共和國藥典》、歐洲藥典和日本藥典均是列舉了幾個術(shù)語解釋����,如《中華人民共和國藥典》包含“密封”����、“密閉”��、“嚴(yán)封”等,歐洲藥典有“In an airtight container”��,日本藥典包含“A well-closed container”����,“A tight container”��,“A hermetic container”; 而美國藥典則包含了較為全面的包裝類型和定義����,如兒童防開啟包裝( child-resistant packaging) 、老年人友好型包裝( senior-friendly packaging) ��、密閉/密封包裝( tight container/wellclosed container) 、遮光包裝( light-resistant container)等��,并包含了注射劑包裝����、非注射劑包裝��、醫(yī)用氣體包裝等包裝類型�。僅美國藥典中對“干燥處( dryplace) ”有規(guī)定��,指“在 20 ℃下或其他溫度的等效水蒸氣壓力下����,平均相對濕度不超過 40% ; 將藥品貯藏在經(jīng)驗(yàn)證防潮的容器中,也可被認(rèn)為是干燥處”��,其他國家藥典中均未見相關(guān)規(guī)定。
表-6 各國藥典對藥品貯藏溫度的規(guī)定
a:有時(shí)推薦溫度會低于 - 20 ℃�,此時(shí)溫度范圍應(yīng)控制在 ± 10 ℃之間;
b:受控冷處(controlled cold temperature) 指溫度主要控制在 2 ℃ ~ 8 ℃范圍內(nèi),貯藏、運(yùn)輸或分發(fā)過程可短暫偏移至 2 ℃ ~ 15 ℃����,但偏移時(shí)間不能超過 24 h�,此時(shí)平均動力學(xué)溫度(mtk) 不高于 8 ℃����,同時(shí)各時(shí)間點(diǎn)溫度都在 2 ℃ ~ 15 ℃ 之間;
c:受控室溫( controlled room temperature) 指溫度主要控制在 20 ℃ ~25 ℃��,mtk 不超過25 ℃情況下����,可短暫偏移至15 ℃ ~30 ℃,瞬時(shí)偏移最高不能超過40 ℃����,偏移時(shí)間不超過24h
《中華人民共和國藥典》凡例中收載的貯藏條件較為有限,貯藏溫度僅包括“冷處�、陰涼處和常溫(室溫) ”,缺少“冷凍”�,同時(shí)缺少對于“干燥處”或濕度的定義等。相比而言,美國藥典〈659〉對于包裝狀態(tài)和貯藏條件的闡述則較為全面�。除此之外��,美國藥典〈659〉和〈1072〉還對藥品貯藏過程中溫度短暫偏移進(jìn)行了闡述與規(guī)定����,更貼合藥品長期貯藏過程的實(shí)際情況����。
5、審評建議與思考
5.1 我國化學(xué)藥品貯藏條件存在的問題
5.1.1 法規(guī)和技術(shù)指南方面
從前文國內(nèi)外法規(guī)和技術(shù)指南對比可知����,我國關(guān)于貯藏條件的法規(guī)指南涵蓋范圍較為廣泛,包括藥品研發(fā)����、注冊及上市后流通����,體現(xiàn)出藥品貯藏條件在藥品全生命周期管理中的重要性。但法規(guī)和技術(shù)指南的詳細(xì)程度尚不如歐美國家�,例如: 指導(dǎo)藥品研發(fā)過程中根據(jù)藥品穩(wěn)定性研究數(shù)據(jù)合理制定��、規(guī)范撰寫藥品貯藏條件方面的技術(shù)指南尚存在空缺; 避免兒童觸及的特殊貯藏要求僅在非處方藥【注意事項(xiàng)】中略有提及�,但處方藥相關(guān)的法規(guī)和技術(shù)指南中并沒有相關(guān)規(guī)定。通過對比國內(nèi)外法規(guī)和技術(shù)指南��,提示我國關(guān)于藥品貯藏條件的法規(guī)和技術(shù)指南尚需進(jìn)一步完善����。本文撰寫期間監(jiān)管機(jī)構(gòu)正在起草更具針對性的技術(shù)指南以指導(dǎo)藥品研發(fā)企業(yè)科學(xué)合理地制定藥品貯藏條件并規(guī)范撰寫,相關(guān)指南的發(fā)布將進(jìn)一步完善和細(xì)化我國藥品貯藏條件相關(guān)法規(guī)和技術(shù)指南體系的建設(shè)�。
5.1.2 藥典方面
《中華人民共和國藥典》凡例中收載了包括光照��、包裝狀態(tài)和溫度 3 個維度的貯藏條件�,但包含內(nèi)容較為有限,且與主流國家藥典中收載貯藏條件以及 ICH Q1 推薦的穩(wěn)定性條件不一致、不匹配��,例如: 缺少“冷凍”條件; “冷處”溫度范圍為“2 ℃ ~ 10 ℃”,與 ICH Q1 推薦的冷藏長期穩(wěn)定性條件( 5 ± 3) ℃ 不匹配; 陰涼條件沒有溫度下限; 缺少對“干燥處”的解釋等��。建議國家藥典委員會進(jìn)一步完善《中華人民共和國藥典》凡例中貯藏相關(guān)規(guī)定��,如增加“冷凍”等貯藏溫度要求�,以“冷藏”替換掉“冷處”,與主流國家藥典及 ICH 指南統(tǒng)一����,同時(shí)建議“陰涼處”增加溫度下限控制�、增加“干燥處”解釋說明等�。
5.1.3 化學(xué)藥品貯藏條件制定與規(guī)范撰寫存在的問題
我國化學(xué)藥品貯藏條件制定與規(guī)范撰寫方面尚存在一定問題����,主要包括: ① 貯藏條件表述不規(guī)范: 貯藏溫度表述不規(guī)范����,如在“4 ℃以下保存”、“低溫( 低于-5 ℃ ) 保存”等����,該類貯藏條件對藥品上市后的貯藏與流通挑戰(zhàn)很大; 對光照重復(fù)要求,如“遮光�、在涼暗處保存”等。② 同一品種不同廠家貯藏條件不一致[18]: 一些早期上市的化學(xué)藥品�,由于不同廠家研發(fā)水平差異�、不同廠家生產(chǎn)的同一品種處方工藝也不盡相同��,導(dǎo)致不同廠家生產(chǎn)的同一品種貯藏條件不一致��。如早期多西他賽注射液��,不同廠家貯藏條件包括“2 ℃ ~ 8 ℃,密閉��,遮光保存”����、“遮光,密閉����,在2 ℃ ~ 20 ℃ 保存”、“遮光��,2 ℃ ~ 25 ℃保存”等����,給臨床使用和貯藏造成困擾。伴隨仿制藥質(zhì)量和療效一致性評價(jià)工作的推進(jìn)��,該類問題得到了很大程度改善��。③ 同一品種國內(nèi)外貯藏條件不一致: 由于國內(nèi)外法規(guī)和技術(shù)指南��、藥典中貯藏條件的規(guī)定并不完全相同��,導(dǎo)致境外品種在境內(nèi)申報(bào)上市時(shí)需注意根據(jù)穩(wěn)定性數(shù)據(jù)和國內(nèi)貯藏條件要求制定及撰寫貯藏條件��。④ 穩(wěn)定性研究數(shù)據(jù)不充分:此問題包含多個方面����,如穩(wěn)定性樣品選擇不具有代表性����、考察指標(biāo)不全面�、試驗(yàn)條件與貯藏條件不匹配等����,故不能給藥品貯藏條件的制定提供充分可靠的依據(jù)。⑤ 其他: 我國多數(shù)藥品還缺少兒童防開啟或防觸及的提醒����,導(dǎo)致兒童誤服藥品事件偶有發(fā)生[19];也未區(qū)分專業(yè)說明書和患者說明書,可能導(dǎo)致患者對貯藏條件等理解不到位引起用藥安全性風(fēng)險(xiǎn)等�。
5.2 化學(xué)藥品貯藏條件制定基本原則
化學(xué)藥品貯藏條件應(yīng)綜合藥品穩(wěn)定性試驗(yàn)結(jié)果和流通過程中可能遇到的情況進(jìn)行綜合分析。用于支持藥品貯藏條件制定的穩(wěn)定性研究數(shù)據(jù)應(yīng)充分準(zhǔn)確����,結(jié)合藥品特性并參考 ICH Q1 和《化學(xué)藥品原料藥和制劑穩(wěn)定性研究指導(dǎo)原則》設(shè)計(jì)和開展穩(wěn)定性試驗(yàn)。涉及特殊貯藏條件的化學(xué)藥品��,應(yīng)結(jié)合具體品種特性開展穩(wěn)定性研究����,確保制定的每一項(xiàng)貯藏要求均有穩(wěn)定性數(shù)據(jù)的支持。
仿制藥的貯藏條件通常應(yīng)參照參比制劑制定��,不能通過降低貯藏條件以使仿制藥質(zhì)量與參比制劑達(dá)成一致��。如果參比制劑獲批貯藏條件為“不超過30 ℃保存”,而仿制藥必須貯藏在“陰涼處( 不超過20 ℃ ) ”才能在有效期內(nèi)穩(wěn)定��,恰說明仿制藥的質(zhì)量與參比制劑不一致����。這種情況,需要對藥品的處方工藝等進(jìn)一步優(yōu)化�,來確保仿制藥與參比制劑質(zhì)量和療效一致,而不是簡單降低貯藏條件以掩蓋質(zhì)量不一致的事實(shí)����。
境外已上市藥品在國內(nèi)上市銷售時(shí),應(yīng)特別注意依據(jù)穩(wěn)定性數(shù)據(jù)確定貯藏條件�,不能簡單翻譯境外獲批貯藏條件。如在室溫保存或無特殊溫度要求的境外已上市藥品進(jìn)口到中國時(shí)����,不能簡單確定貯藏條件為“常溫保存”,因?yàn)闅W美藥典中室溫( 不超過25 ℃ ) 并不等同于《中華人民共和國藥典》中規(guī)定的常溫( 室溫����,10 ℃~30 ℃ ) ,此時(shí)應(yīng)根據(jù)穩(wěn)定性試驗(yàn)結(jié)果合理制定貯藏條件�。
《中華人民共和國藥典》收載的藥品貯藏溫度包括冷處(2 ℃~10 ℃) ��、陰涼處( 不高于20 ℃ ) 和常溫(10 ℃~30 ℃ ) ,與 ICH 推薦的穩(wěn)定性試驗(yàn)條件不完全匹配����,比如置于陰涼條件下貯藏的藥品無對應(yīng)的 ICH 推薦長期穩(wěn)定性試驗(yàn)條件。如有藥品確需在陰涼條件下貯藏時(shí)�,建議在符合 GMP 要求的條件下開展穩(wěn)定性研究,并對穩(wěn)定性試驗(yàn)條件的溫濕度進(jìn)行實(shí)時(shí)監(jiān)測和記錄��,以便做好管理和溯源����。
為避免兒童誤服,應(yīng)注明“請將本品放在兒童不能接觸的地方”相關(guān)描述或使用兒童防開啟包裝����。
5.3 化學(xué)藥品貯藏條件書寫規(guī)范
化學(xué)藥品貯藏條件應(yīng)按照規(guī)范的術(shù)語描述。對光照敏感的藥品應(yīng)包括遮光/避光要求; 建議注明保存的具體溫度�,必要時(shí)應(yīng)增加溫度的上下限; 如藥品對濕度敏感,因《中華人民共和國藥典》中并未定義何為“干燥處”��,建議主要通過包裝來避免藥品受潮�,如采用防潮材質(zhì),或在瓶內(nèi)加入干燥劑等��,此時(shí)【貯藏】項(xiàng)下可增加描述“在原包裝中保存以防受潮”��。貯藏條件一般按照光照、包裝狀態(tài)����、溫度和特殊貯藏要求順序列出,筆者查詢近期獲批的不同劑型已上市化學(xué)藥品說明書�,匯總了不同劑型典型的貯藏條件表述( 見表 7) ,以供參考�。化學(xué)藥品貯藏條件復(fù)雜多樣��,特殊類型制劑可根據(jù)制劑特點(diǎn)及特殊保存要求制定合理的貯藏條件�。
表 7-不同劑型典型貯藏條件表述
如涉及藥品使用過程中的暫存,包括多劑量藥品開啟后保存����、藥品稀釋配伍后、給藥裝置裝載藥品后等����,需要開展相應(yīng)使用中穩(wěn)定性研究,并根據(jù)研究結(jié)果確定暫存條件和允許時(shí)限��。
6��、結(jié)語
目前我國化學(xué)藥品貯藏條件在制定和規(guī)范撰寫方面尚存在一定問題��,需要業(yè)界與監(jiān)管界共同努力完善。藥品上市許可持有人作為藥品的第一責(zé)任人��,應(yīng)根據(jù)準(zhǔn)確規(guī)范的研究結(jié)果科學(xué)制定藥品貯藏條件����,并進(jìn)行全生命周期管理��。建議監(jiān)管機(jī)構(gòu)進(jìn)一步完善和細(xì)化我國藥品貯藏條件相關(guān)的法規(guī)和技術(shù)指南體系建設(shè)�,同時(shí)建議國家藥典委員會進(jìn)一步完善《中華人民共和國藥典》凡例中貯藏相關(guān)規(guī)定,加強(qiáng)與主流國家藥典的協(xié)調(diào)��。伴隨我國藥品說明書和標(biāo)簽管理不斷完善和規(guī)范����,建議區(qū)分專業(yè)說明書和患者說明書,在患者說明書中使用通俗易懂的文字描述貯藏條件等��。正確做好藥品貯藏管理工作�,保證藥品質(zhì)量,能夠有效防止?jié)撛谫A藏相關(guān)用藥風(fēng)險(xiǎn)的發(fā)生����,進(jìn)而保證人民群眾用藥安全。
參考文獻(xiàn)
[1] 原國家食品藥品監(jiān)督管理局. 國家食品藥品監(jiān)督管理總局關(guān)于發(fā)布普通口服固體制劑溶出度試驗(yàn)技術(shù)指導(dǎo)原則和化學(xué)藥物( 原料藥和制劑) 穩(wěn)定性研究技術(shù)指導(dǎo)原則的通告( 2015年第 3 號) [EB/OL].[2022 - 09 - 23].
https: / /www. nmpa.gov. cn /xxgk /ggtg /qtggtg /20150205120001100. html.
[2] 原國家食品藥品監(jiān)督管理局. 《藥品說明書和標(biāo)簽管理規(guī)定》( 2006 年第 24 號) [EB/OL].[2022 - 09 - 23]. https: / /gkml. samr. gov. cn /nsjg /bgt /202106 /t20210630_331795. html.
[3] 國家食品藥品監(jiān)督管理局. 關(guān)于印發(fā)化學(xué)藥品和生物制品說明書規(guī)范細(xì)則的通知( 國食藥監(jiān)注[2006]202 號) [EB/OL].[2022 - 09 - 23].
https: / /www. nmpa. gov. cn /directory /web /nmpa /xxgk /fgwj /gzwj /gzwjyp/20060510010101566. html.
[4] 原國家食品藥品監(jiān)督管理局. 關(guān)于印發(fā)非處方藥說明書規(guī)范細(xì)則的通知( 國食藥監(jiān)注[2006]540 號)