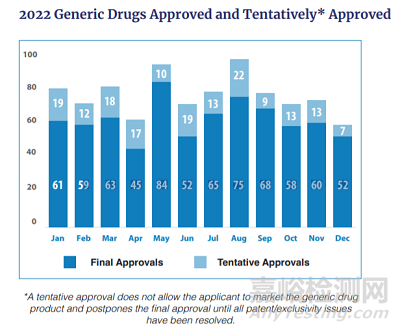
2022年全年,F(xiàn)DA一共批準(zhǔn)(或暫時性批準(zhǔn))了914個ANDA�����,其中暫時性批準(zhǔn)172個�����,正式批準(zhǔn)742個�。從數(shù)量上看�,相比2021年的669個有明顯的提升,但仍然不及2017-2020年間的水平���。由于美國仿制藥競爭高度激烈�,仿制藥的投資回報率較低(就如FDA報告中所說,普瑞巴林膠囊的平均價格在一年內(nèi)下降了95%)�����,故近年來ANDA的申報積極性有所回落�����,而且近35%的產(chǎn)品從來沒有在美國上市�。因為競爭過于激烈,近年來仿制藥都是拼首仿�,比難度的游戲,盡管只有為數(shù)不多的幾個產(chǎn)品面臨專利懸崖���,但FDA已經(jīng)提前批準(zhǔn)了“暫時性的”ANDA�。
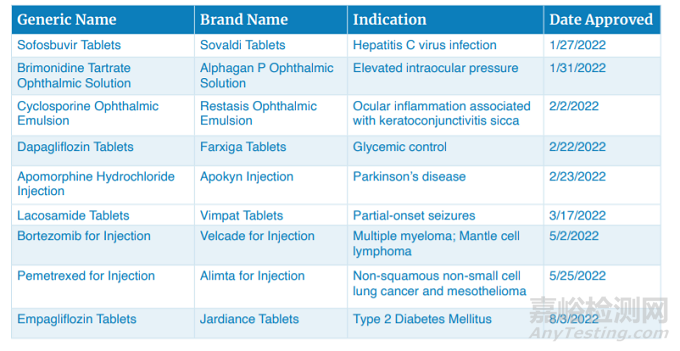
2022年�,F(xiàn)DA仿制藥辦公室一共批準(zhǔn)了106個首仿藥,其中意義最為重大的仿藥包括索非布韋片�����、溴莫尼定滴眼液���、環(huán)孢素滴眼液���、達(dá)格列凈片�����、阿撲嗎啡注射液���、拉考酰胺片、注射用硼替佐米�����、注射用培美曲塞�、恩格列凈片等。
具有重大意義的首仿藥
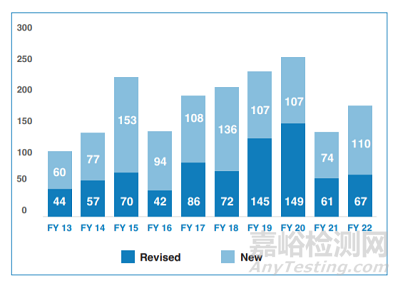
2015年之后���,價格下降導(dǎo)致的市場萎縮超過了銷量增長所帶來的增量���,美國仿制藥市場開始逐漸萎縮���,但為了進(jìn)一步增加仿制藥競爭���,F(xiàn)DA制定了一攬子的“藥品競爭行動計劃”(FDA Drug Competition Action Plan)�����。雖然FDA加大了仿制藥的審批���,但制藥企業(yè)對幾乎“無利可圖”的美國仿制藥喪失了積極性,為了進(jìn)一步加大仿制藥的競爭�����,F(xiàn)DA也是“操透了心”���,通過各種措施來提高仿制藥的積極性�����,為高度復(fù)雜產(chǎn)品審評審批進(jìn)行了多種嘗試���,發(fā)布或修訂了大量的產(chǎn)品專業(yè)指南(product specific guidance)。
FDA新發(fā)或修訂的產(chǎn)品專業(yè)指南
FDA 仿制藥審評辦公室2022年的業(yè)績